Проблема повышения устойчивости организма к воздействию экстремальных факторов среды является весьма существенной, поскольку расширяет спектр исследований природы от космоса до глубин океана. В качестве одного из способов повышения устойчивости организма к воздействию экстремальных факторов была предложена предварительная обработка организма малыми дозами токсического агента, которая получила название предварительной адаптации, или предадаптации [9]. Феномен повышения устойчивости организма в результате предадаптации получил название адаптивного ответа [10]. Показана неспецифичность феномена адаптивного ответа для различных факторов, условий воздействия (in vivo и in vitro) и объектов - микроорганизмов, растений и животных [2; 7; 9]. Известно, что организмы, обработанные низкими дозами токсических веществ, могут обладать увеличенной жизнеспособностью против намного более сильных стимулов из-за предадаптации их метаболических систем. Предадаптация проявляется как устойчивость организма, обработанного низким безвредным количеством токсина к высокому количеству данного токсина или его аналогов. Ранее было показано, что однократное воздействие гипербарической оксигенации на ранних этапах онтогенеза Xenopus laevis и Rattus norvegicus изменяет способность антиоксидантных систем новорожденного организма реагировать на окислительный стресс в половозрелом возрасте. При этом малые давления (0,2 МПа) способствуют биохимической адаптации, в то время как высокие (0,7 МПа) приводят к дисбалансу и ингибированию систем, ответственных за антиоксидантную защиту. Эти данные свидетельствуют о формировании онтогенетического импринтинга после адаптивного воздействия окислительного стресса [2].
На клеточном уровне сигналом для запуска неспецифической адаптационной реакции служит сдвиг прооксидантно-антиоксидантного равновесия в направлении активации процессов перекисного окисления липидов в биологических мембранах и жидкостях - т.е. окислительный стресс [3]. Окислительный стресс является индуктором запуска неспецифических реакций, в результате которых реализуется каскад разнонаправленных метаболитических процессов, результатом которых может быть деструкция мембран, инактивация активности ферментов и гормонов, нарушение клеточного цикла, повреждения ДНК, супрессия, экспрессия и гипер- и гипометилирование генов [2].
Клетки новорожденных более приспосабливаемы к изменениям физиологических условий, чем клетки зрелого организма. Предполагается, что обработка новорожденных животных низкой дозой гипербарической оксигенации облегчит формирование широкой кислородчувствительной нейронной сети, которая, в свою очередь, ведет к увеличению сопротивления животных окислительному стрессу в дальнейшем онтогенезе.
Настоящее исследование нацелено на изучение механизмов, лежащих в основе формирования устойчивости крыс к гипербарической оксигенации, а также на поиск новых механизмов предадаптации метаболической системы организма новорожденных крыс к окислительному стрессу, основанный на полногеномном исследовании экспрессии генов.
Материалы и методы исследований
Эксперименты с крысами были выполнены в соответствии с руководящими принципами, сформулированными комитетом по биоэтике Южного федерального университета.
Исследования проводились на 24 белых аутбредных крысах. Животные рандомизировались и обрабатывались высоким давлением кислорода в 25-литровой барокамере, содержащей щелочной поглотитель углекислого газа. Скорость увеличения давления и декомпрессии составляла 0,1 МПа/мин. Гипербарическая оксигенация (ГБО) при 0,2 МПа в течение 1 часа использовалась в качестве «низкодозового» условия обработки, выбор которого определялся на предварительно описанном предадаптивном эффекте такой обработки [2]. Экспериментальных и интактных животных декапитировали спустя 3 часа после ГБО. Мозг быстро извлекали и погружали в лед. Для исследования использовалась лобная кора над глазами животных. Для дальнейшего выделения рибонуклеиновой кислоты лобную кору от каждого животного помещали в тубу микроцентрифуги и быстро замораживали на сухом льду. Исследования проводились на биочипах фирмы Affymetrix, Санта-Клара, Калифорния, содержащих 12289 образцов генов для гибридизации.
Тотальную РНК выделяли с помощью Тризола согласно протоколу производителя (Invitrogen). 1 мл раствора Тризол был добавлен в каждую пробирку с замороженным блоком ткани, и ткань гомогенизировали. После центрифугирования РНК осаждали из водного слоя, промывали и растворяли в воде, свободной от РНКазы. Концентрацию и целостность РНК оценивали спектрофотометрически и с помощью гельэлектрофореза. РНК образцы хранились при температуре -80 °C. На одном чипе располагали РНК от одной контрольной и одной опытной крысы, затем проводили гибридизацию при 45 °C. Далее чипы промывали и окрашивали на струйной станции (Affymetrix) и сканировали с разрешением 3 мкм в конфокальном сканере (Agilent Affymetrix GeneArray Scanner) с использованием ПО GeneSpring GT (Agilent). Экспрессию генов мозга исследовали через 3 часа после окончания воздействия низкой (предадаптирующей) дозой ГБО 0,2 МПа-1ч на новорожденных крысят. В общей сложности на чип было нанесено 12288 олигонуклеотидов различных генов (array). В таблице 1 представлен общий перечень генов, анализируемых на чипе, по классификации Genome Ontology (www.geneontology.org), и число генов с повышенной экспрессией или супрессией в ответ на данный режим ГБО (соотношение Cy3/Cy5 >2,0 и <0,5 соответственно). Данные были нормализованы, используя Robust Multichip Average (RMA) посредством RMA Express. Были использованы алгоритмы для определения различий в экспрессии генов из руководства к Microarray Suite 4.0. Статистический анализ молекулярно-генетических показателей проведен с помощью лицензионного пакета StatPlus Professional версия 2009, а также GraphPad InStat версия 3.06 для Windows. Достоверными считались результаты при уровне значимости p < 0,05.
Результаты и их обсуждение
Изучение экспрессионных паттернов генома при воздействии окислительного стресса
Экспрессия генов в мозгу была изучена спустя 3 дня после предадаптации новорожденных крыс низкой дозой ГБО (0,2 МПа в течение 1 ч). Результаты показали повышенную экспрессию нескольких сотен генов в мозге крыс, однако многопараметрический анализ транскриптов у всех исследуемых животных позволил с высокой долей уверенности остановиться лишь на следующих генах: Pdk4, Nid2, Golph2, Actr1a, Api5, Mrpl3, Scn7a, Acox3, Lamr1, Sv2b, Stmn2, Trpc3, Crebzf, Scnn1a, Herc1, Ssc1, Sm11, Snrpb и Zfhx1b.
Ранее было показано, что в головном мозге существует сеть нейронов, чувствительных к кислороду [8]. С другой стороны, в основе формирования новых функциональных систем при поражениях нервной системы, повреждениях тела, голоде, стрессе лежит селекция нейронов из резерва (ранее «молчавших», импульсно неактивных клеток) и активизация «ранних» генов. Селекция нейронов зависит от их индивидуальных свойств, от особенностей их метаболических потребностей [1]. Возможно, что воздействие повышенного давления кислорода на новорожденных животных способствует формированию более широкой сети нейронов, чувствительных к кислороду (за счет механизмов, указанных выше), что способствует повышенной устойчивости животных к окислительному стрессу в течение всего онтогенеза.
Таблица 1 - Динамика экспрессии/супрессии генов в мозгу крыс, подвергнутых обработке 0,2 МПа -1ч ГБО (функции генов представлены в соответствии с Genome Ontology Database)
|
Гены |
Всего |
Увеличение экспрессии |
Супрессия |
Гены |
Всего |
Увеличение экспрессии |
Супрессия |
||
|
GO: клеточные компоненты |
Нуклеазы |
18 |
0 |
0 |
|||||
|
Мембрана |
343 |
2 |
1 |
Монооксигеназы |
18 |
1 |
1 |
||
|
Мембранные белки |
119 |
0 |
1 |
NADH-дегидрогеназы |
21 |
1 |
0 |
||
|
Иммуноглобули-ны |
90 |
0 |
0 |
Глутатионперокси-дазы |
12 |
1 |
0 |
||
|
Синапсы |
14 |
1 |
0 |
СОД |
3 |
1 |
0 |
||
|
Пероксисомы |
20 |
0 |
1 |
Каталазы |
2 |
0 |
0 |
||
|
Жирные кислоты |
46 |
2 |
0 |
Миелопероксидазы |
1 |
1 |
0 |
||
|
Эндоплазматиче-ский ретикулум |
17 |
0 |
0 |
Эозинофилперокси-дазы |
1 |
0 |
0 |
||
|
Ядро |
242 |
1 |
0 |
Убихинон |
23 |
1 |
0 |
||
|
Ядерная мембрана |
6 |
1 |
1 |
Транспортеры |
135 |
1 |
2 |
||
|
Ядерные поры |
8 |
1 |
0 |
GABA-транспорт |
6 |
0 |
0 |
||
|
Околоядерное пространство |
5 |
0 |
0 |
Везикулярный транспорт |
3 |
0 |
0 |
||
|
Ядерный рибонуклеиново-белковый комплекс |
3 |
1 |
0 |
Транскрипцион-ные факторы |
|
|
|
||
|
Каналы: |
|
|
|
Факторы роста |
115 |
1 |
0 |
||
|
Натриевые каналы |
15 |
1 |
0 |
Инсулинподобный фактор роста |
15 |
0 |
0 |
||
|
Калиевые каналы |
17 |
1 |
1 |
Гормоны |
56 |
1 |
1 |
||
|
Кальциевые каналы |
47 |
0 |
0 |
Рецепторы |
1268 |
21 |
7 |
||
|
Хлоридные каналы |
16 |
1 |
0 |
Цитокины |
15 |
1 |
1 |
||
|
Потенциал-зависимые каналы |
18 |
4 |
1 |
Интерлейкины |
25 |
0 |
0 |
||
|
Сигнальные трансдукторы |
13 |
1 |
0 |
Хемокины |
14 |
0 |
0 |
||
|
Переходные каналы |
14 |
0 |
0 |
Циклины |
56 |
0 |
0 |
||
|
Лигандсвязыва-ние и белки-переносчики: |
610 |
|
|
Метилирование |
61 |
0 |
0 |
||
|
Цинковые пальцы |
101 |
2 |
0 |
GO: биопроцессы |
|||||
|
Связывание нуклеиновых кислот |
20 |
0 |
0 |
Клеточные рецепторы |
881 |
2 |
0 |
||
|
Связывание нуклеотидов |
27 |
2 |
1 |
G-белок связывание |
38 |
9 |
4 |
||
|
CpG-связывание |
6 |
2 |
0 |
Межклеточные сигнальные каскады |
13 |
0 |
0 |
||
|
GO: молекулярные функции |
Деление клеток |
13 |
1 |
0 |
|||||
|
Ферменты: |
|
|
|
Регуляция клеточного роста |
5 |
0 |
0 |
||
|
Трансферазы |
280 |
1 |
1 |
Процессы развития |
489 |
4 |
0 |
||
|
Гидролазы |
71 |
2 |
0 |
Эмбриогенез |
93 |
0 |
0 |
||
|
Лиазы |
15 |
1 |
0 |
Морфогенез |
19 |
0 |
0 |
||
|
Оксидоредуктазы |
9 |
1 |
2 |
Нейрогенез |
161 |
0 |
0 |
||
|
Изомеразы |
18 |
1 |
0 |
Стрессовая реакция |
452 |
2 |
1 |
||
|
Лигазы |
44 |
1 |
1 |
Апоптоз |
89 |
2 |
2 |
||
|
Синтазы |
105 |
1 |
0 |
Репарация |
9 |
0 |
0 |
||
|
Киназы |
413 |
1 |
1 |
Транспорт |
2 |
1 |
0 |
||
|
Фосфатазы |
198 |
0 |
0 |
Связывание |
53 |
22 |
7 |
||
|
Эстеразы |
65 |
0 |
0 |
Транскрибиро-ванные последователь-ности |
873 |
37 |
2 |
||
|
Липазы |
60 |
1 |
0 |
Функция неизвестна |
3665 |
16 |
4 |
||
|
Оксидазы |
69 |
2 |
0 |
||||||
Ранее было показано, что формирование долговременной памяти (адаптация) зависит от концентрации CREB-белка в ядре нейрона, который разрешает формирование новых синапсов в ответ на внешние стимулы [6]. CREB-белок взаимодействует с цАМФ-чувствительным элементом. Подобные наблюдения были сделаны и в нашем исследовании: на 3-й день после ГБО-обработки новорожденных крыс наблюдалось подавление экспрессии генов scl25b, CREB и Rn. 48050 (функция неизвестна) в мозговой ткани.
Исследования по изучению экспрессии полного генома крыс в ответ на окислительный стресс выявили новые механизмы формирования устойчивого ответа в ответ на повторное воздействие окислительного стресса - это ранние генетические механизмы формирования предадаптации к окислительному стрессу, которые включают активацию генов, обеспечивающих 6 ключевых биопроцессов: регуляцию ионной проницаемости биологических мембран, активацию синаптической передачи, модификации межклеточного взаимодействия, внутриклеточного транспорта, окислительного метаболизма и регуляции апоптоза и пролиферации, а также выявлена группа генов с ранее неизвестными функциями в мозгу крыс (рис. 1).
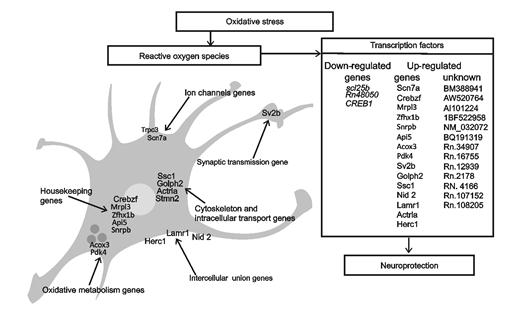
Рис. 1. Локализация в нейроне генов с повышенной экспрессией (Up-regulated) и супрессией (Down-regulated) в ответ на воздействие ГБО, также указаны гены с повышенной экспрессией в ответ на окислительный стресс, функции которых ранее не были известны (unknown).
1. Регулирование мембранной проницаемости для ионов и формирования мембранных потенциалов
К данному процессу можно отнести следующие гены, показавшие изменение экспрессии в ответ на окислительный стресс:
Scn7a - потенциалзависимый натриевый канал, тип VII, альфа, это наиболее распространеный канал мозга. Канал открывается при изменении мембранного потенциала. Открытие потенциалзависимых каналов приводит к пассивному перемещению ионов по электрохимическому градиенту.
Trpc3 - рецептор транзиторного потенциала катионного канала, подтип C, член 3. Представители семейства TRP (Transient Receptor Potential) участвуют в генерации кратковременных (преходящих) рецепторных потенциалов. Катионные каналы TRPC участвуют в передаче сигнала в чувствительных нейронах.
Rn.4166 (Clm1) - ген, кодирующий белок кальмодулин. Кальмодулин контролирует большое количество ферментов и других белков посредством связывания ионов кальция.
2. Синаптическая передача
Кратковременная синаптическая пластичность инициируется короткими вспышками активности, которые вызывают временное накопление ионов кальция в пресинаптических терминалах. Вследствие этого накопления происходит изменение вероятности высвобождения нейротрансмиттера из-за непосредственной модуляции биохимических процессов, Экспериментальное изучение долговременной синаптической пластичности базируется на постулате Хэбба, сформулированном в 1949 году: «Если аксон клетки А расположен достаточно близко к клетке Б, чтобы возбуждать её, и постоянно участвует в её активации, то в одной или обеих клетках происходят такие метаболические изменения или процессы роста, что эффективность А как одной из клеток, активирующих Б, повышается» [5]. В современной формулировке постулат Хэбба понимается так, что изменение эффективности передачи сигнала в синапсе управляется корреляцией силы, необходимой для активации пре- и постсинаптического нейрона.
Sv2b - обе формы SV2 экспрессируются во всех областях мозга, SV2B экспрессируется на самом высоком уровне в коре и гиппокампе, тогда как самый высокий уровень экспрессии Sv2a наблюдается в подкорковых областях. Возможно, играет роль в контролировании регуляции секреции в нервных и эндокринных клетках.
Rn.34907 (Nptxr) - белок, кодируемый этим геном, - интегральный мембранный белок, функционирующий в качестве нейронного рецептора.
Rn.12939 (Vamp2) - белок, кодируемый этим геном, - член семейства везикуло-ассоциированных мембранных белков (VAMP)/синаптобревина. Синаптобревины, синтаксины и 25-кДа синаптосомально-ассоциированный белок SNAP25 - главные компоненты белкового комплекса, вовлеченного в докинг и/или слияние синаптических пузырьков с предсинаптической мембраной. Белок формирует устойчивый комплекс с синтаксином и синаптотагмином. Он также формирует отдельный комплекс с синаптофузином.
Crebzf - сильно активизирует транскрипцию, когда связывается с HCFC1. Способен снижать экспрессию некоторых клеточных генов в CREBZF-экспрессирующих клетках.
Stmn2 - ген, кодирующий белок статмин 2, который является ключевым регулятором роста нейронов посредством регуляции стабильности микротрубочек. Максимальный уровень экспрессии гена наблюдается в развивающемся мозге на 7-й день после рождения и коррелирует с началом дифференцировки нейронов. Также принимает участие во внутриклеточной сигнальной трансдукции.
3. Модификация межклеточных контактов
Все виды информационных межклеточных взаимодействий реализуются в рамках концепции «сигнал-ответ», основы которой заложил Пауль Эрлих. Информационные межклеточные взаимодействия укладывается в схему, предусматривающую следующую последовательность событий: сигнал Þ рецептор Þ (второй посредник) Þ ответ.
Nid 2 - ген, кодирующий белок нидоген, являющийся гликопротеином клеточной адгезии, вероятно участвует во взаимодействиях с внеклеточным матриксом, связывает ионы кальция. Также есть данные об участии нидогена 2 в передаче нервномышечных испульсов, при этом нидоген 2 локализуется в синапсах [4].
Lamr1 - 40S рибосомальный белок SA, необходим для сборки и стабилизации 40S рибосомальной субъединицы. Также функционирует в качестве клеточного рецептора к ламинину, играет роль в адгезии клеток к базальной мембране и последующей активации путей сигнальной трансдукции, может участвовать в детерминации клеток и морфогенезе тканей.
Herc1 - возможная Е3 убиквитин-протеин лигаза. Участвует в мембранном транспорте посредством активности в качестве фактора обмена гауниновых нуклеотидов (GEF) и способности связываться с клатрином. Действует в качестве GEF для Arf и Rab. Может также действовать в качестве убиквинтин-протеин лигазы, которая акцептирует убиквитин с Е2 убиквитин-связывающего фермента в форме тиоэфира и затем непосредственно транпортирует убиквитин на целевой субстрат.
BQ191319 - этот белок может играть отрицательную роль в клеточной миграции в качестве антагониста активности Rac в процессе организации цитоскелета и движении клеток.
4. Внутриклеточный транспорт
По современным представлениям, транспорт органелл в животных клетках происходит в две стадии: на большие расстояния они двигаются по микротрубочкам, а их локальное перемещение происходит по актиновым филаментам. Являясь основой внутриклеточного транспорта, микротрубочки и актиновые филаменты вместе с моторными белками играют решающую роль в клеточном делении, секреции, фагоцитозе и др.
Stmn2 - ген, кодирующий белок статмин 2, который является ключевым регулятором роста нейронов посредством регуляции стабильности микротрубочек.
Actr1a - этот ген кодирует 42,6 кДа субъединицу динактина (моторного белка), макромолекулярного комплекса, состоящего из 10-11 субъединиц, имеющих массу от 22 до 150 кДаD. Динактин связывается как с динеином микротрубочек, так и с цитоплазматическим динеином. Он вовлечен во множество различных клеточных функций, включая транспортировку из эндоплазматического ретикулума в комплекс Гольджи, центростремительное движение лизосом и эндосом, образование веретена деления, движения хромосом, позиционирование ядра и аксоногенеза.
5. Окислительный обмен веществ
Acox3 пероксисомальная ацил-КоА оксидаза 3, также известная как пристаноил-CoA оксидаза (ACOX3), вовлечена в десатурацию разветвленных жирных кислот с 2 метилами в пероксисомах.
Pdk4 - этот ген - член PDK/BCKDK семейства протеинкиназ и кодирует митохондриальный белок с гистидиновым киназным доменом. Этот белок локализуется в митохондриальном матриксе и ингибирует пируватдегидрогеназный комплекс посредством фосфорилирования одной из его субъединиц, таким образом способствуя регулированию метаболизма глюкозы.
1BF522958 (Abca1) - белок, кодируемый данным геном, выступает в качестве откачивающего насоса холестерина в клеточном пути удаления липидов.
Rn.107152 (Cyp51) - этот ген кодирует член суперсемейства ферментов цитохром P450. Цитохром P450 белки - монооксигеназы, которые катализируют множество реакций, участвующих в метаболизме лекарственных препаратов и синтезе холестерина, стероидов и других липидов.
Ssc1 - белок 1, похожий на синтетазу длинноцепочечных жирных кислот (Elo2), изоформа CRA_b. Ssc1 - повсеместно экспрессируемый ген, продукт которого принадлежит к высококонсервативным микросомальным ферментам, участвующим в синтезе длинноцепочечных жирных кислот.
6. Регулирование апоптоза и пролиферации
Mrpl3 - рибосомная рибонуклеиновая кислота (rRNA) - РНК-компонент рибосомы.
Api5 - ингибитор апоптоза 5.
Zfhx1b - ген, который кодирует Smad-взаимодействующий белок 1 (SIP1) и представляет собой член delta-EF1/Zfh1 семейства двухсвязывающих цинковых пальцев/гомеодоменных белков. Является фактором транскрипции.
Snrpb - кодирует один из нескольких ядерных белков, которые часто обнаруживаются среди U1, U2, U4/U6, и U5 маленьких рибонуклеопротеиновых частиц (snRNPs).
Rn.16755 - ген, кодирующий белок, подобный MutS белку. В E. coli, MutS белок помогает в распозновании мис-матч нуклеотидов, до их репарации.
NM_032072 (Appbp1) - этот белок необходим для прохождения клеткой в течение клеточного цикла S/M контрольной точки.
Rn.108205 - ингибитор связывания ДНК. Белки-игибиторы ДНК-связывания типа спираль - петля - спираль не имеют основного ДНК-связывающего домена, однако способны образовывать гетеродимеры с другими белками типа спираль - петля - спираль, таким образом ингибируя связывание ДНК. Белки данного семейства функционируют в качестве ингибиторов клеточной дифференцировки, и экспрессия их генов супрессируется по мере клеточной дифференцировки. Играют одну из ключевых ролей в дифференцировке нейронов.
AW520764 (MPP3) - белок, кодируемый данным геном, относится к семейству белков DLG, которые имеют общую структурную организацию и вовлечены в пути сигнальной трансдукции, а также участвуют в опосредовании белок-белковых взаимодействий на границе цитоплазмы и клеточной мембраны.
Rn.2178 (Ghr) - рецептор гормона роста, участвующий в регуляции постнатального роста организма. При связывании лиганда активирует JAK2/STAT5 сигнальный путь. Растворимая форма (GHBP) выступает в качестве резервного хранилища гормона роста в плазме и может служить модулятором/ингибитором сигналинга, опосредованного гормоном роста.
Таким образом, на уровне регуляции экспрессии генов в процессе ответа на окислительный стресс предадаптация к нему зависит от активации в нервных клетках определенных транскрипционных факторов (рис. 2). Белковые продукты этих генов выполняют разнообразные функции в нервных клетках. В частности, молекулы клеточной адгезии и другие синаптические белки изменяют связи нейрона, устанавливая функциональную специализацию клетки в системе межклеточных отношений. После воздействия ГБО в новорожденный период возрастает активация генов, регулирующих формирование синаптической памяти, об этом свидетельствует выраженная активация экспрессии Actr1a кодирующего диактин-альфа-центрактина, который обеспечивает движение везикул. Субъединица диактина связывается с микротубулярными и цитоплазматическими деиминааминами. Повышенная экспрессия гена Stmn2, кодирующего белок статмин, являющийся ключевым фактором в регуляции роста нейронов, также позволяет провести связь между влиянием ГБО и функциями нейронов. Более того, обнаружено увеличение экспрессии гена Vamp2, который является везикулоассоциированным белком и участвует в слиянии синаптических пузырьков с предсинаптической мембраной. Увеличение экспрессии гена Sv2b, продукт которого контролирует регуляцию секреции в нейронах, служит дополнительным фактом в поддержку гипотезы формирования синаптической памяти в ответ на гипербарическую оксигенацию. Активация генов Acox3 и Pdk4 свидетельствует об активации окисления разветвленных жирных кислот и подавлении окислительного декарбоксилирования пирувата, что, вероятно, отражает определенную модификацию энергетического метаболизма с ограничением утилизации глюкозы и преимущественным использованием жирных кислот.
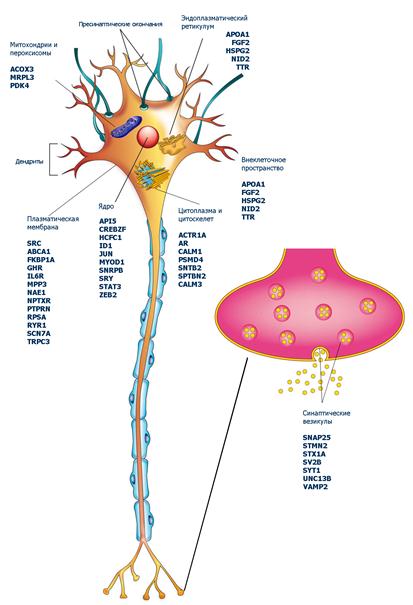
Рис. 2. Активации в нервных клетках новорожденных крыс транскрипционных факторов и генов в ответ на окислительный стресс.
Исследования по изучению экспрессии полного генома крыс в ответ на окислительный стресс выявили новые механизмы формирования устойчивого ответа в ответ на повторное воздействие окислительного стресса - это ранние генетические механизмы формирования предадаптации к окислительному стрессу, включающие активацию генов, обеспечивающих 6 ключевых биопроцессов: регуляцию ионной проницаемости биологических мембран, активацию синаптической передачи, модификации межклеточного взаимодействия, внутриклеточного транспорта, окислительного метаболизма и регуляции апоптоза и пролиферации.
Исследования выполнены в рамках госконтракта № 14.740.11.0006. ФЦП «Научные и научно-педагогические кадры инновационной России на 2009-2013 гг.».
Рецененты:
- Амелина С.С., д.м.н., руководитель Медико-генетической консультацией государственного учреждения здравоохранения Ростовской областной клинической больницы, главный специалист Министерства здравоохранения Ростовской области по генетике, г. Ростов-на Дону.
- Афонин А.А., д.м.н., профессор, заместитель директора по науке Федерального государственного учреждения «Ростовский научно-исследовательский институт акушерства и педиатрии» Минздравсоцразвития РФ.
Работа получена 26.10.2011



