Проблема повышения устойчивости организма к воздействию экстремальных факторов среды является весьма существенной, поскольку расширяет спектр исследований природы от космоса до глубин океана. В качестве одного из способов повышения устойчивости организма к воздействию экстремальных факторов была предложена предварительная обработка организма малыми дозами токсического агента, которая получила название предварительной адаптации, или предадаптации [9]. Феномен повышения устойчивости организма в результате предадаптации получил название адаптивного ответа [10]. Показана неспецифичность феномена адаптивного ответа для различных факторов, условий воздействия (in vivo и in vitro) и объектов - микроорганизмов, растений и животных [2; 7; 9]. Известно, что организмы, обработанные низкими дозами токсических веществ, могут обладать увеличенной жизнеспособностью против намного более сильных стимулов из-за предадаптации их метаболических систем. Предадаптация проявляется как устойчивость организма, обработанного низким безвредным количеством токсина к высокому количеству данного токсина или его аналогов. Ранее было показано, что однократное воздействие гипербарической оксигенации на ранних этапах онтогенеза Xenopus laevis и Rattus norvegicus изменяет способность антиоксидантных систем новорожденного организма реагировать на окислительный стресс в половозрелом возрасте. При этом малые давления (0,2 МПа) способствуют биохимической адаптации, в то время как высокие (0,7 МПа) приводят к дисбалансу и ингибированию систем, ответственных за антиоксидантную защиту. Эти данные свидетельствуют о формировании онтогенетического импринтинга после адаптивного воздействия окислительного стресса [2].
На клеточном уровне сигналом для запуска неспецифической адаптационной реакции служит сдвиг прооксидантно-антиоксидантного равновесия в направлении активации процессов перекисного окисления липидов в биологических мембранах и жидкостях - т.е. окислительный стресс [3]. Окислительный стресс является индуктором запуска неспецифических реакций, в результате которых реализуется каскад разнонаправленных метаболитических процессов, результатом которых может быть деструкция мембран, инактивация активности ферментов и гормонов, нарушение клеточного цикла, повреждения ДНК, супрессия, экспрессия и гипер- и гипометилирование генов [2].
Клетки новорожденных более приспосабливаемы к изменениям физиологических условий, чем клетки зрелого организма. Предполагается, что обработка новорожденных животных низкой дозой гипербарической оксигенации облегчит формирование широкой кислородчувствительной нейронной сети, которая, в свою очередь, ведет к увеличению сопротивления животных окислительному стрессу в дальнейшем онтогенезе.
Настоящее исследование нацелено на изучение механизмов, лежащих в основе формирования устойчивости крыс к гипербарической оксигенации, а также на поиск новых механизмов предадаптации метаболической системы организма новорожденных крыс к окислительному стрессу, основанный на полногеномном исследовании экспрессии генов.
Материалы и методы исследований
Эксперименты с крысами были выполнены в соответствии с руководящими принципами, сформулированными комитетом по биоэтике Южного федерального университета.
Исследования проводились на 24 белых аутбредных крысах. Животные рандомизировались и обрабатывались высоким давлением кислорода в 25-литровой барокамере, содержащей щелочной поглотитель углекислого газа. Скорость увеличения давления и декомпрессии составляла 0,1 МПа/мин. Гипербарическая оксигенация (ГБО) при 0,2 МПа в течение 1 часа использовалась в качестве «низкодозового» условия обработки, выбор которого определялся на предварительно описанном предадаптивном эффекте такой обработки [2]. Экспериментальных и интактных животных декапитировали спустя 3 часа после ГБО. Мозг быстро извлекали и погружали в лед. Для исследования использовалась лобная кора над глазами животных. Для дальнейшего выделения рибонуклеиновой кислоты лобную кору от каждого животного помещали в тубу микроцентрифуги и быстро замораживали на сухом льду. Исследования проводились на биочипах фирмы Affymetrix, Санта-Клара, Калифорния, содержащих 12289 образцов генов для гибридизации.
Тотальную РНК выделяли с помощью Тризола согласно протоколу производителя (Invitrogen). 1 мл раствора Тризол был добавлен в каждую пробирку с замороженным блоком ткани, и ткань гомогенизировали. После центрифугирования РНК осаждали из водного слоя, промывали и растворяли в воде, свободной от РНКазы. Концентрацию и целостность РНК оценивали спектрофотометрически и с помощью гельэлектрофореза. РНК образцы хранились при температуре -80 °C. На одном чипе располагали РНК от одной контрольной и одной опытной крысы, затем проводили гибридизацию при 45 °C. Далее чипы промывали и окрашивали на струйной станции (Affymetrix) и сканировали с разрешением 3 мкм в конфокальном сканере (Agilent Affymetrix GeneArray Scanner) с использованием ПО GeneSpring GT (Agilent). Экспрессию генов мозга исследовали через 3 часа после окончания воздействия низкой (предадаптирующей) дозой ГБО 0,2 МПа-1ч на новорожденных крысят. В общей сложности на чип было нанесено 12288 олигонуклеотидов различных генов (array). В таблице 1 представлен общий перечень генов, анализируемых на чипе, по классификации Genome Ontology (www.geneontology.org), и число генов с повышенной экспрессией или супрессией в ответ на данный режим ГБО (соотношение Cy3/Cy5 >2,0 и <0,5 соответственно). Данные были нормализованы, используя Robust Multichip Average (RMA) посредством RMA Express. Были использованы алгоритмы для определения различий в экспрессии генов из руководства к Microarray Suite 4.0. Статистический анализ молекулярно-генетических показателей проведен с помощью лицензионного пакета StatPlus Professional версия 2009, а также GraphPad InStat версия 3.06 для Windows. Достоверными считались результаты при уровне значимости p < 0,05.
Результаты и их обсуждение
Изучение экспрессионных паттернов генома при воздействии окислительного стресса
Экспрессия генов в мозгу была изучена спустя 3 дня после предадаптации новорожденных крыс низкой дозой ГБО (0,2 МПа в течение 1 ч). Результаты показали повышенную экспрессию нескольких сотен генов в мозге крыс, однако многопараметрический анализ транскриптов у всех исследуемых животных позволил с высокой долей уверенности остановиться лишь на следующих генах: Pdk4, Nid2, Golph2, Actr1a, Api5, Mrpl3, Scn7a, Acox3, Lamr1, Sv2b, Stmn2, Trpc3, Crebzf, Scnn1a, Herc1, Ssc1, Sm11, Snrpb и Zfhx1b.
Ранее было показано, что в головном мозге существует сеть нейронов, чувствительных к кислороду [8]. С другой стороны, в основе формирования новых функциональных систем при поражениях нервной системы, повреждениях тела, голоде, стрессе лежит селекция нейронов из резерва (ранее «молчавших», импульсно неактивных клеток) и активизация «ранних» генов. Селекция нейронов зависит от их индивидуальных свойств, от особенностей их метаболических потребностей [1]. Возможно, что воздействие повышенного давления кислорода на новорожденных животных способствует формированию более широкой сети нейронов, чувствительных к кислороду (за счет механизмов, указанных выше), что способствует повышенной устойчивости животных к окислительному стрессу в течение всего онтогенеза.
Таблица 1 - Динамика экспрессии/супрессии генов в мозгу крыс, подвергнутых обработке 0,2 МПа -1ч ГБО (функции генов представлены в соответствии с Genome Ontology Database)
|
Гены |
Всего |
Увеличение экспрессии |
Супрессия |
Гены |
Всего |
Увеличение экспрессии |
Супрессия |
||
|
GO: клеточные компоненты |
Нуклеазы |
18 |
0 |
0 |
|||||
|
Мембрана |
343 |
2 |
1 |
Монооксигеназы |
18 |
1 |
1 |
||
|
Мембранные белки |
119 |
0 |
1 |
NADH-дегидрогеназы |
21 |
1 |
0 |
||
|
Иммуноглобули-ны |
90 |
0 |
0 |
Глутатионперокси-дазы |
12 |
1 |
0 |
||
|
Синапсы |
14 |
1 |
0 |
СОД |
3 |
1 |
0 |
||
|
Пероксисомы |
20 |
0 |
1 |
Каталазы |
2 |
0 |
0 |
||
|
Жирные кислоты |
46 |
2 |
0 |
Миелопероксидазы |
1 |
1 |
0 |
||
|
Эндоплазматиче-ский ретикулум |
17 |
0 |
0 |
Эозинофилперокси-дазы |
1 |
0 |
0 |
||
|
Ядро |
242 |
1 |
0 |
Убихинон |
23 |
1 |
0 |
||
|
Ядерная мембрана |
6 |
1 |
1 |
Транспортеры |
135 |
1 |
2 |
||
|
Ядерные поры |
8 |
1 |
0 |
GABA-транспорт |
6 |
0 |
0 |
||
|
Околоядерное пространство |
5 |
0 |
0 |
Везикулярный транспорт |
3 |
0 |
0 |
||
|
Ядерный рибонуклеиново-белковый комплекс |
3 |
1 |
0 |
Транскрипцион-ные факторы |
|
|
|
||
|
Каналы: |
|
|
|
Факторы роста |
115 |
1 |
0 |
||
|
Натриевые каналы |
15 |
1 |
0 |
Инсулинподобный фактор роста |
15 |
0 |
0 |
||
|
Калиевые каналы |
17 |
1 |
1 |
Гормоны |
56 |
1 |
1 |
||
|
Кальциевые каналы |
47 |
0 |
0 |
Рецепторы |
1268 |
21 |
7 |
||
|
Хлоридные каналы |
16 |
1 |
0 |
Цитокины |
15 |
1 |
1 |
||
|
Потенциал-зависимые каналы |
18 |
4 |
1 |
Интерлейкины |
25 |
0 |
0 |
||
|
Сигнальные трансдукторы |
13 |
1 |
0 |
Хемокины |
14 |
0 |
0 |
||
|
Переходные каналы |
14 |
0 |
0 |
Циклины |
56 |
0 |
0 |
||
|
Лигандсвязыва-ние и белки-переносчики: |
610 |
|
|
Метилирование |
61 |
0 |
0 |
||
|
Цинковые пальцы |
101 |
2 |
0 |
GO: биопроцессы |
|||||
|
Связывание нуклеиновых кислот |
20 |
0 |
0 |
Клеточные рецепторы |
881 |
2 |
0 |
||
|
Связывание нуклеотидов |
27 |
2 |
1 |
G-белок связывание |
38 |
9 |
4 |
||
|
CpG-связывание |
6 |
2 |
0 |
Межклеточные сигнальные каскады |
13 |
0 |
0 |
||
|
GO: молекулярные функции |
Деление клеток |
13 |
1 |
0 |
|||||
|
Ферменты: |
|
|
|
Регуляция клеточного роста |
5 |
0 |
0 |
||
|
Трансферазы |
280 |
1 |
1 |
Процессы развития |
489 |
4 |
0 |
||
|
Гидролазы |
71 |
2 |
0 |
Эмбриогенез |
93 |
0 |
0 |
||
|
Лиазы |
15 |
1 |
0 |
Морфогенез |
19 |
0 |
0 |
||
|
Оксидоредуктазы |
9 |
1 |
2 |
Нейрогенез |
161 |
0 |
0 |
||
|
Изомеразы |
18 |
1 |
0 |
Стрессовая реакция |
452 |
2 |
1 |
||
|
Лигазы |
44 |
1 |
1 |
Апоптоз |
89 |
2 |
2 |
||
|
Синтазы |
105 |
1 |
0 |
Репарация |
9 |
0 |
0 |
||
|
Киназы |
413 |
1 |
1 |
Транспорт |
2 |
1 |
0 |
||
|
Фосфатазы |
198 |
0 |
0 |
Связывание |
53 |
22 |
7 |
||
|
Эстеразы |
65 |
0 |
0 |
Транскрибиро-ванные последователь-ности |
873 |
37 |
2 |
||
|
Липазы |
60 |
1 |
0 |
Функция неизвестна |
3665 |
16 |
4 |
||
|
Оксидазы |
69 |
2 |
0 |
||||||
Ранее было показано, что формирование долговременной памяти (адаптация) зависит от концентрации CREB-белка в ядре нейрона, который разрешает формирование новых синапсов в ответ на внешние стимулы [6]. CREB-белок взаимодействует с цАМФ-чувствительным элементом. Подобные наблюдения были сделаны и в нашем исследовании: на 3-й день после ГБО-обработки новорожденных крыс наблюдалось подавление экспрессии генов scl25b, CREB и Rn. 48050 (функция неизвестна) в мозговой ткани.
Исследования по изучению экспрессии полного генома крыс в ответ на окислительный стресс выявили новые механизмы формирования устойчивого ответа в ответ на повторное воздействие окислительного стресса - это ранние генетические механизмы формирования предадаптации к окислительному стрессу, которые включают активацию генов, обеспечивающих 6 ключевых биопроцессов: регуляцию ионной проницаемости биологических мембран, активацию синаптической передачи, модификации межклеточного взаимодействия, внутриклеточного транспорта, окислительного метаболизма и регуляции апоптоза и пролиферации, а также выявлена группа генов с ранее неизвестными функциями в мозгу крыс (рис. 1).
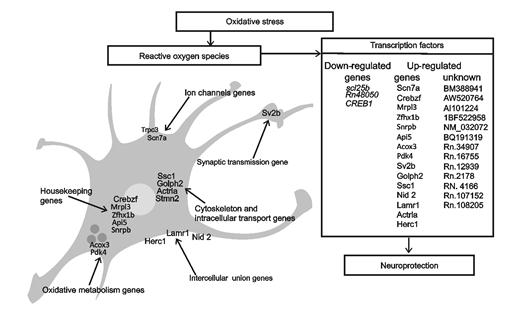
Рис. 1. Локализация в нейроне генов с повышенной экспрессией (Up-regulated) и супрессией (Down-regulated) в ответ на воздействие ГБО, также указаны гены с повышенной экспрессией в ответ на окислительный стресс, функции которых ранее не были известны (unknown).
1. Регулирование мембранной проницаемости для ионов и формирования мембранных потенциалов
К данному процессу можно отнести следующие гены, показавшие изменение экспрессии в ответ на окислительный стресс:
Scn7a - потенциалзависимый натриевый канал, тип VII, альфа, это наиболее распространеный канал мозга. Канал открывается при изменении мембранного потенциала. Открытие потенциалзависимых каналов приводит к пассивному перемещению ионов по электрохимическому градиенту.
Trpc3 - рецептор транзиторного потенциала катионного канала, подтип C, член 3. Представители семейства TRP (Transient Receptor Potential) участвуют в генерации кратковременных (преходящих) рецепторных потенциалов. Катионные каналы TRPC участвуют в передаче сигнала в чувствительных нейронах.
Rn.4166 (Clm1) - ген, кодирующий белок кальмодулин. Кальмодулин контролирует большое количество ферментов и других белков посредством связывания ионов кальция.
2. Синаптическая передача
Кратковременная синаптическая пластичность инициируется короткими вспышками активности, которые вызывают временное накопление ионов кальция в пресинаптических терминалах. Вследствие этого накопления происходит изменение вероятности высвобождения нейротрансмиттера из-за непосредственной модуляции биохимических процессов, Экспериментальное изучение долговременной синаптической пластичности базируется на постулате Хэбба, сформулированном в 1949 году: «Если аксон клетки А расположен достаточно близко к клетке Б, чтобы возбуждать её, и постоянно участвует в её активации, то в одной или обеих клетках происходят такие метаболические изменения или процессы роста, что эффективность А как одной из клеток, активирующих Б, повышается» [5]. В современной формулировке постулат Хэбба понимается так, что изменение эффективности передачи сигнала в синапсе управляется корреляцией силы, необходимой для активации пре- и постсинаптического нейрона.
Sv2b - обе формы SV2 экспрессируются во всех областях мозга, SV2B экспрессируется на самом высоком уровне в коре и гиппокампе, тогда как самый высокий уровень экспрессии Sv2a наблюдается в подкорковых областях. Возможно, играет роль в контролировании регуляции секреции в нервных и эндокринных клетках.
Rn.34907 (Nptxr) - белок, кодируемый этим геном, - интегральный мембранный белок, функционирующий в качестве нейронного рецептора.
Rn.12939 (Vamp2) - белок, кодируемый этим геном, - член семейства везикуло-ассоциированных мембранных белков (VAMP)/синаптобревина. Синаптобревины, синтаксины и 25-кДа синаптосомально-ассоциированный белок SNAP25 - главные компоненты белкового комплекса, вовлеченного в докинг и/или слияние синаптических пузырьков с предсинаптической мембраной. Белок формирует устойчивый комплекс с синтаксином и синаптотагмином. Он также формирует отдельный комплекс с синаптофузином.
Crebzf - сильно активизирует транскрипцию, когда связывается с HCFC1. Способен снижать экспрессию некоторых клеточных генов в CREBZF-экспрессирующих клетках.
Stmn2 - ген, кодирующий белок статмин 2, который является ключевым регулятором роста нейронов посредством регуляции стабильности микротрубочек. Максимальный уровень экспрессии гена наблюдается в развивающемся мозге на 7-й день после рождения и коррелирует с началом дифференцировки нейронов. Также принимает участие во внутриклеточной сигнальной трансдукции.
3. Модификация межклеточных контактов
Все виды информационных межклеточных взаимодействий реализуются в рамках концепции «сигнал-ответ», основы которой заложил Пауль Эрлих. Информационные межклеточные взаимодействия укладывается в схему, предусматривающую следующую последовательность событий: сигнал Þ рецептор Þ (второй посредник) Þ ответ.
Nid 2 - ген, кодирующий белок нидоген, являющийся гликопротеином клеточной адгезии, вероятно участвует во взаимодействиях с внеклеточным матриксом, связывает ионы кальция. Также есть данные об участии нидогена 2 в передаче нервномышечных испульсов, при этом нидоген 2 локализуется в синапсах [4].
Lamr1 - 40S рибосомальный белок SA, необходим для сборки и стабилизации 40S рибосомальной субъединицы. Также функционирует в качестве клеточного рецептора к ламинину, играет роль в адгезии клеток к базальной мембране и последующей активации путей сигнальной трансдукции, может участвовать в детерминации клеток и морфогенезе тканей.
Herc1 - возможная Е3 убиквитин-протеин лигаза. Участвует в мембранном транспорте посредством активности в качестве фактора обмена гауниновых нуклеотидов (GEF) и способности связываться с клатрином. Действует в качестве GEF для Arf и Rab. Может также действовать в качестве убиквинтин-протеин лигазы, которая акцептирует убиквитин с Е2 убиквитин-связывающего фермента в форме тиоэфира и затем непосредственно транпортирует убиквитин на целевой субстрат.
BQ191319 - этот белок может играть отрицательную роль в клеточной миграции в качестве антагониста активности Rac в процессе организации цитоскелета и движении клеток.
4. Внутриклеточный транспорт
По современным представлениям, транспорт органелл в животных клетках происходит в две стадии: на большие расстояния они двигаются по микротрубочкам, а их локальное перемещение происходит по актиновым филаментам. Являясь основой внутриклеточного транспорта, микротрубочки и актиновые филаменты вместе с моторными белками играют решающую роль в клеточном делении, секреции, фагоцитозе и др.
Stmn2 - ген, кодирующий белок статмин 2, который является ключевым регулятором роста нейронов посредством регуляции стабильности микротрубочек.
Actr1a - этот ген кодирует 42,6 кДа субъединицу динактина (моторного белка), макромолекулярного комплекса, состоящего из 10-11 субъединиц, имеющих массу от 22 до 150 кДаD. Динактин связывается как с динеином микротрубочек, так и с цитоплазматическим динеином. Он вовлечен во множество различных клеточных функций, включая транспортировку из эндоплазматического ретикулума в комплекс Гольджи, центростремительное движение лизосом и эндосом, образование веретена деления, движения хромосом, позиционирование ядра и аксоногенеза.
5. Окислительный обмен веществ
Acox3 пероксисомальная ацил-КоА оксидаза 3, также известная как пристаноил-CoA оксидаза (ACOX3), вовлечена в десатурацию разветвленных жирных кислот с 2 метилами в пероксисомах.
Pdk4 - этот ген - член PDK/BCKDK семейства протеинкиназ и кодирует митохондриальный белок с гистидиновым киназным доменом. Этот белок локализуется в митохондриальном матриксе и ингибирует пируватдегидрогеназный комплекс посредством фосфорилирования одной из его субъединиц, таким образом способствуя регулированию метаболизма глюкозы.
1BF522958 (Abca1) - белок, кодируемый данным геном, выступает в качестве откачивающего насоса холестерина в клеточном пути удаления липидов.
Rn.107152 (Cyp51) - этот ген кодирует член суперсемейства ферментов цитохром P450. Цитохром P450 белки - монооксигеназы, которые катализируют множество реакций, участвующих в метаболизме лекарственных препаратов и синтезе холестерина, стероидов и других липидов.
Ssc1 - белок 1, похожий на синтетазу длинноцепочечных жирных кислот (Elo2), изоформа CRA_b. Ssc1 - повсеместно экспрессируемый ген, продукт которого принадлежит к высококонсервативным микросомальным ферментам, участвующим в синтезе длинноцепочечных жирных кислот.
6. Регулирование апоптоза и пролиферации
Mrpl3 - рибосомная рибонуклеиновая кислота (rRNA) - РНК-компонент рибосомы.
Api5 - ингибитор апоптоза 5.
Zfhx1b - ген, который кодирует Smad-взаимодействующий белок 1 (SIP1) и представляет собой член delta-EF1/Zfh1 семейства двухсвязывающих цинковых пальцев/гомеодоменных белков. Является фактором транскрипции.
Snrpb - кодирует один из нескольких ядерных белков, которые часто обнаруживаются среди U1, U2, U4/U6, и U5 маленьких рибонуклеопротеиновых частиц (snRNPs).
Rn.16755 - ген, кодирующий белок, подобный MutS белку. В E. coli, MutS белок помогает в распозновании мис-матч нуклеотидов, до их репарации.
NM_032072 (Appbp1) - этот белок необходим для прохождения клеткой в течение клеточного цикла S/M контрольной точки.
Rn.108205 - ингибитор связывания ДНК. Белки-игибиторы ДНК-связывания типа спираль - петля - спираль не имеют основного ДНК-связывающего домена, однако способны образовывать гетеродимеры с другими белками типа спираль - петля - спираль, таким образом ингибируя связывание ДНК. Белки данного семейства функционируют в качестве ингибиторов клеточной дифференцировки, и экспрессия их генов супрессируется по мере клеточной дифференцировки. Играют одну из ключевых ролей в дифференцировке нейронов.
AW520764 (MPP3) - белок, кодируемый данным геном, относится к семейству белков DLG, которые имеют общую структурную организацию и вовлечены в пути сигнальной трансдукции, а также участвуют в опосредовании белок-белковых взаимодействий на границе цитоплазмы и клеточной мембраны.
Rn.2178 (Ghr) - рецептор гормона роста, участвующий в регуляции постнатального роста организма. При связывании лиганда активирует JAK2/STAT5 сигнальный путь. Растворимая форма (GHBP) выступает в качестве резервного хранилища гормона роста в плазме и может служить модулятором/ингибитором сигналинга, опосредованного гормоном роста.
Таким образом, на уровне регуляции экспрессии генов в процессе ответа на окислительный стресс предадаптация к нему зависит от активации в нервных клетках определенных транскрипционных факторов (рис. 2). Белковые продукты этих генов выполняют разнообразные функции в нервных клетках. В частности, молекулы клеточной адгезии и другие синаптические белки изменяют связи нейрона, устанавливая функциональную специализацию клетки в системе межклеточных отношений. После воздействия ГБО в новорожденный период возрастает активация генов, регулирующих формирование синаптической памяти, об этом свидетельствует выраженная активация экспрессии Actr1a кодирующего диактин-альфа-центрактина, который обеспечивает движение везикул. Субъединица диактина связывается с микротубулярными и цитоплазматическими деиминааминами. Повышенная экспрессия гена Stmn2, кодирующего белок статмин, являющийся ключевым фактором в регуляции роста нейронов, также позволяет провести связь между влиянием ГБО и функциями нейронов. Более того, обнаружено увеличение экспрессии гена Vamp2, который является везикулоассоциированным белком и участвует в слиянии синаптических пузырьков с предсинаптической мембраной. Увеличение экспрессии гена Sv2b, продукт которого контролирует регуляцию секреции в нейронах, служит дополнительным фактом в поддержку гипотезы формирования синаптической памяти в ответ на гипербарическую оксигенацию. Активация генов Acox3 и Pdk4 свидетельствует об активации окисления разветвленных жирных кислот и подавлении окислительного декарбоксилирования пирувата, что, вероятно, отражает определенную модификацию энергетического метаболизма с ограничением утилизации глюкозы и преимущественным использованием жирных кислот.
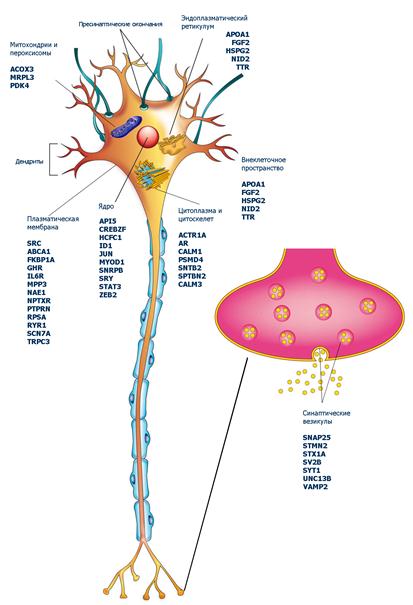
Рис. 2. Активации в нервных клетках новорожденных крыс транскрипционных факторов и генов в ответ на окислительный стресс.
Исследования по изучению экспрессии полного генома крыс в ответ на окислительный стресс выявили новые механизмы формирования устойчивого ответа в ответ на повторное воздействие окислительного стресса - это ранние генетические механизмы формирования предадаптации к окислительному стрессу, включающие активацию генов, обеспечивающих 6 ключевых биопроцессов: регуляцию ионной проницаемости биологических мембран, активацию синаптической передачи, модификации межклеточного взаимодействия, внутриклеточного транспорта, окислительного метаболизма и регуляции апоптоза и пролиферации.
Исследования выполнены в рамках госконтракта № 14.740.11.0006. ФЦП «Научные и научно-педагогические кадры инновационной России на 2009-2013 гг.».
Рецененты:
- Амелина С.С., д.м.н., руководитель Медико-генетической консультацией государственного учреждения здравоохранения Ростовской областной клинической больницы, главный специалист Министерства здравоохранения Ростовской области по генетике, г. Ростов-на Дону.
- Афонин А.А., д.м.н., профессор, заместитель директора по науке Федерального государственного учреждения «Ростовский научно-исследовательский институт акушерства и педиатрии» Минздравсоцразвития РФ.
Работа получена 26.10.2011
Библиографическая ссылка
Шкурат Т.П., Шестопалов А.В., Гуськов Г.Е., Прокофьев В.Н., Бутенко А.И., Белик Т.В., Бибов М.Ю., Лянгасова О.В., Шкурат М.А., Машкина Е.В., Манджиева С.С., Бутенко Е.В., Севастьянова И.Н., Рыжков П., Вечканов Е.М. ПОИСК НОВЫХ МЕХАНИЗМОВ ПРЕДАДАПТАЦИИ МОЗГА ЖИВОТНЫХ К ОКИСЛИТЕЛЬНОМУ СТРЕССУ, С ИСПОЛЬЗОВАНИЕМ ТЕХНОЛОГИИ DNA ARRAY // Современные проблемы науки и образования. 2011. № 5. ;URL: https://science-education.ru/ru/article/view?id=4888 (дата обращения: 23.02.2026).



