Введение
Исследованию комплексообразования междувольфраматом натрия и D-(+)-виннойкислотой было посвящено достаточное число работ,в которых авторы едины в том, что образуемое в растворе комплексное соединение с соотношением компонентов 1:1 диссоциируетна комплексный анион и ионы металла [3; 5-8]. Однако результаты этих исследований несколько противоречивы относительно состава анионного комплекса и зависимости величины заряда его от ![]() раствора.Так, например, в работе [5] методами кондуктометрии, потенциометрии и поляриметрии установлено, что в зависимости от
раствора.Так, например, в работе [5] методами кондуктометрии, потенциометрии и поляриметрии установлено, что в зависимости от ![]() раствора существуют следующие анионы
раствора существуют следующие анионы![]() ,
, ![]() ,
, ![]() . При
. При ![]() имеет место распад анионного комплекса на вольфрамат и тартратионы.В работе же [3] дается вывод, что в области
имеет место распад анионного комплекса на вольфрамат и тартратионы.В работе же [3] дается вывод, что в области ![]() в растворе доминирует комплексный анион
в растворе доминирует комплексный анион ![]() , а при
, а при ![]() в растворе преобладает комплекс состава
в растворе преобладает комплекс состава ![]() . На основании криоскопических измерений [8] было установлено, что в водных растворах вольфрамата натрия и винной кислоты образуется комплексное соединение с соотношением компонентов 1:1, диссоциирующее на анион с зарядом -2. Кроме того, только две работы [6-7] посвящены исследованию этой системы методами поляриметрии, к тому же в этих работах отсутствуют данные по зависимости величины вращения плоскости поляризации растворовD-(+)-винной кислоты и вольфрамата натрия от состава и об удельном вращении образуемого в системе тартратовольфраматного комплекса. Следует отметить, что в работе [7] приведены удельные вращения растворов вольфрамата натрия и винной кислоты, однако они вычислены относительно концентрации винной кислоты, а не образуемого в растворе комплекса.
. На основании криоскопических измерений [8] было установлено, что в водных растворах вольфрамата натрия и винной кислоты образуется комплексное соединение с соотношением компонентов 1:1, диссоциирующее на анион с зарядом -2. Кроме того, только две работы [6-7] посвящены исследованию этой системы методами поляриметрии, к тому же в этих работах отсутствуют данные по зависимости величины вращения плоскости поляризации растворовD-(+)-винной кислоты и вольфрамата натрия от состава и об удельном вращении образуемого в системе тартратовольфраматного комплекса. Следует отметить, что в работе [7] приведены удельные вращения растворов вольфрамата натрия и винной кислоты, однако они вычислены относительно концентрации винной кислоты, а не образуемого в растворе комплекса.
Полагаем, что продолжение работ по изучению водных растворов вольфрамата натрия и D-(+)-винной кислоты различными методами физико-химического анализа вполне обоснованно.
Экспериментальная часть
В случае поляриметрических и -метрических измерений готовили растворы одинаковых молярностей![]() вольфрамата натрия и D-(+)-винной кислоты, которые в дальнейшем смешивали в определенных соотношениях в широком интервале состава. Для приготовления растворов были использованы бидистиллированная вода, вольфрамат натрия и D-(+)-винная кислота марки «ч.д.а.», дополнительно очищенные перекристаллизацией из водных растворов. Растворы готовили в мерных колбах на 50 мл, объемы которых были предварительно определены с точностью до ±0,01 мл при температуре 293,15±0,02К. Измерения величины угла вращения плоскости поляризации изомолярных растворов
вольфрамата натрия и D-(+)-винной кислоты, которые в дальнейшем смешивали в определенных соотношениях в широком интервале состава. Для приготовления растворов были использованы бидистиллированная вода, вольфрамат натрия и D-(+)-винная кислота марки «ч.д.а.», дополнительно очищенные перекристаллизацией из водных растворов. Растворы готовили в мерных колбах на 50 мл, объемы которых были предварительно определены с точностью до ±0,01 мл при температуре 293,15±0,02К. Измерения величины угла вращения плоскости поляризации изомолярных растворов ![]() определяли на поляриметре СМ-2 с точностью ±0,020, а измерения
определяли на поляриметре СМ-2 с точностью ±0,020, а измерения ![]() растворов проводили на высокоомном потенциометре рН-673М, с точностью ±0,02 ед. рН. В случае криоскопических измерений готовили растворы отдельных компонентов одинаковых моляльностей
растворов проводили на высокоомном потенциометре рН-673М, с точностью ±0,02 ед. рН. В случае криоскопических измерений готовили растворы отдельных компонентов одинаковых моляльностей ![]() в мерных колбах объемом около 100 мл, объемы которых также были предварительно определены с точностью ±0,02 мл при температуре 293,15±0,02К. Изомоляльные растворы компонентов в широком интервале состава готовили в специальных пробирках для криоскопических измерений. Криоскопические измерения проводили на приборе Бекмана с точностью измерения температуры ±0,002К.
в мерных колбах объемом около 100 мл, объемы которых также были предварительно определены с точностью ±0,02 мл при температуре 293,15±0,02К. Изомоляльные растворы компонентов в широком интервале состава готовили в специальных пробирках для криоскопических измерений. Криоскопические измерения проводили на приборе Бекмана с точностью измерения температуры ±0,002К.
Результаты исследования и их обсуждение
Методами поляриметрии, криоскопии и -метрии в широком интервале состава нами были изучены изомолярные (в случае криоскопии - изомоляльные ) серии (0,1, 0,3, 0,5 и 0,7 моль/л) квазибинарной системы вольфрамат натрия - D-(+)-винная кислота. На рис.1 представлена оптическая активность изомолярных растворов ![]() .
.
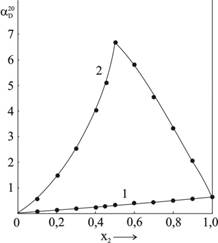
Рис.1. Оптическая активность изомолярных растворов ![]()
![]()
![]() (кривая 1),
(кривая 1), ![]() (кривая 2)
(кривая 2)
Как видно из рис.1, наблюдается значительное положительное отклонение опытных величин угла вращения плоскости поляризации растворов ![]() (кривая 2) от значений, рассчитанных в предположении отсутствия взаимодействия между компонентами
(кривая 2) от значений, рассчитанных в предположении отсутствия взаимодействия между компонентами ![]() (кривая 1), которые были вычислены с помощью соотношения зависимости величины вращения водных растворов от концентрации D-(+)-винной кислоты [1]:
(кривая 1), которые были вычислены с помощью соотношения зависимости величины вращения водных растворов от концентрации D-(+)-винной кислоты [1]:
![]() , (1)
, (1)
где ![]() - число граммов оптически активной винной кислоты в 100 мл раствора.
- число граммов оптически активной винной кислоты в 100 мл раствора.
На кривой зависимости величины угла вращения изомолярных растворов ![]() (кривая 2, рис.1) и кривой отклонения опытных величин угла вращения от расчетных
(кривая 2, рис.1) и кривой отклонения опытных величин угла вращения от расчетных ![]() (кривая 2, рис.2,
(кривая 2, рис.2, ![]() ) наблюдается четко выраженный максимум при соотношении компонентов 1:1. Диаграммы оптической активности других изомолярных серий аналогичны диаграмме, представленной на рис.1 для изомолярных растворов вольфрамата натрия и D-(+)-винной кислоты
) наблюдается четко выраженный максимум при соотношении компонентов 1:1. Диаграммы оптической активности других изомолярных серий аналогичны диаграмме, представленной на рис.1 для изомолярных растворов вольфрамата натрия и D-(+)-винной кислоты![]() . Таким образом, характер кривых
. Таким образом, характер кривых ![]() и
и ![]() (рис.2) для различных изомолярных серий вольфрамата натрия и D-(+)-винной кислоты не зависит от концентрации компонентов в растворе, что находится в согласии с результатами работы [4] для изомолярной серии с концентрацией
(рис.2) для различных изомолярных серий вольфрамата натрия и D-(+)-винной кислоты не зависит от концентрации компонентов в растворе, что находится в согласии с результатами работы [4] для изомолярной серии с концентрацией ![]() (кривая 5, рис.2).
(кривая 5, рис.2).
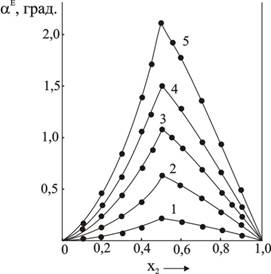
Рис.2. Отклонения величины вращения изомолярных растворов отрасчетных![]()
в квазибинарной системе![]() (растворитель-вода, Т=293,15К)
(растворитель-вода, Т=293,15К)
![]() (кривая 1),
(кривая 1),![]() (кривая 2),
(кривая 2), ![]() (кривая 3),
(кривая 3),
![]() (кривая 4),
(кривая 4), ![]() (кривая 5)
(кривая 5)
Максимальные значения относительного отклонения величин угла вращения раствороввольфрамата натрия и D-(+)-винная кислоты с соотношением компонентов 1:1 ![]() для различных изомолярных растворов близки друг к другу
для различных изомолярных растворов близки друг к другу ![]() .
.
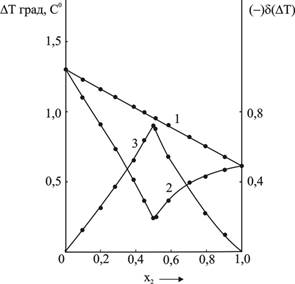
Рис.3. Криоскопическая диаграмма изомоляльных растворов вольфрамата натрия и
D-(+)-винной кислоты ![]()
На рис.3 представлена криоскопическая диаграмма изомоляльных растворов вольфрамата натрия и D-(+)-винной кислоты ![]() . Как видно из рис.3, наблюдается значительное уменьшение понижения температуры замерзания этих растворов (кривая 2) по сравнению со значениями, рассчитанными в предположении отсутствия взаимодействия между компонентами, но с учетом тех изменений, которые претерпевают каждый компонент в отдельности в водном растворе (кривая 1).Понижения температуры замерзания изомолярных растворов в предположении отсутствия взаимодействия между компонентами
. Как видно из рис.3, наблюдается значительное уменьшение понижения температуры замерзания этих растворов (кривая 2) по сравнению со значениями, рассчитанными в предположении отсутствия взаимодействия между компонентами, но с учетом тех изменений, которые претерпевают каждый компонент в отдельности в водном растворе (кривая 1).Понижения температуры замерзания изомолярных растворов в предположении отсутствия взаимодействия между компонентами![]() рассчитывались с помощью следующих соотношений [1]:
рассчитывались с помощью следующих соотношений [1]:
![]() , (2)
, (2)
где ![]() дается уравнением зависимости понижения температуры замерзания водных растворов от концентрации вольфрамата натрия
дается уравнением зависимости понижения температуры замерзания водных растворов от концентрации вольфрамата натрия ![]() .
.
![]() (3)
(3)
и ![]() соответствующим уравнением для водных растворов D-(+)-винной кислоты
соответствующим уравнением для водных растворов D-(+)-винной кислоты ![]()
![]() (4)
(4)
Максимум отклонения опытных данных по понижению температуры замерзания этих изомоляльных растворов от значений, рассчитанных в предположении отсутствия взаимодействия между компонентами (зависимость ![]() кривая 3, рис.3), также приходится на соотношение компонентов 1:1. Как и в случае оптической активности, криоскопические диаграммы других изомоляльных серий аналогичны диаграмме, представленной на рис.3.
кривая 3, рис.3), также приходится на соотношение компонентов 1:1. Как и в случае оптической активности, криоскопические диаграммы других изомоляльных серий аналогичны диаграмме, представленной на рис.3.
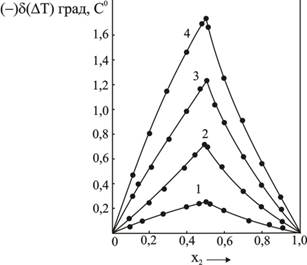
Рис.4.Отклонения опытных значений понижения температуры замерзания растворов от расчетных для изомоляльных растворов ![]() (растворитель-вода)
(растворитель-вода)
![]() (кривая 1),
(кривая 1), ![]() (кривая 2),
(кривая 2),
![]() (кривая 3) и
(кривая 3) и![]() (кривая 4)
(кривая 4)
Характер кривых ![]() и
и ![]() (рис.4) не меняется с концентрацией компонентов в растворе и указывает на то, что взаимодействие между компонентами идет до конца. Некоторая асимметрия кривых
(рис.4) не меняется с концентрацией компонентов в растворе и указывает на то, что взаимодействие между компонентами идет до конца. Некоторая асимметрия кривых ![]() и
и ![]() должна быть связана с иррациональностью системы. Значительные уменьшения понижения температуры замерзания изомоляльных растворов должны быть связаны с уменьшением числа частиц в растворе за счет реакции присоединения
должна быть связана с иррациональностью системы. Значительные уменьшения понижения температуры замерзания изомоляльных растворов должны быть связаны с уменьшением числа частиц в растворе за счет реакции присоединения
![]()
III III
Учитывая, что реакция практически идет до конца, можно рассчитать удельное вращение образуемого продукта присоединения, которое в отличие от удельного вращения D-(+)-винной кислоты в растворах слабо зависит от концентрации и может быть принято равным 99,8.
Не затрагивая здесь вопроса о зависимости заряда анионного комплекса от ![]() среды, отметим, что расчеты на основании полученных криоскопических данных позволяют с уверенностью сказать, что продукт присоединения III не диссоциирует на комплексный аниони ионы
среды, отметим, что расчеты на основании полученных криоскопических данных позволяют с уверенностью сказать, что продукт присоединения III не диссоциирует на комплексный аниони ионы ![]() . Зависимость понижения температуры замерзания водных растворов от концентрации продукта (III) дается следующим соотношением:
. Зависимость понижения температуры замерзания водных растворов от концентрации продукта (III) дается следующим соотношением:
![]() , (5)
, (5)
где ![]() - моляльность продукта присоединения. При
- моляльность продукта присоединения. При ![]() соотношение (5) переходит в известное уравнение криоскопии для водных растворов
соотношение (5) переходит в известное уравнение криоскопии для водных растворов ![]() , что свойственно для растворов неэлектролитов или соединений с очень слабой электролитической диссоциацией.
, что свойственно для растворов неэлектролитов или соединений с очень слабой электролитической диссоциацией.
Если принять, что продукт присоединения диссоциирует на комплексный анион ![]() и ионы
и ионы ![]() , что противоречит результатам криоскопии, то изомолярные растворы вольфрамата натрия и D-(+)-винной кислоты при соотношении компонентов 1:1
, что противоречит результатам криоскопии, то изомолярные растворы вольфрамата натрия и D-(+)-винной кислоты при соотношении компонентов 1:1 ![]() должны были бы иметь или щелочную реакцию, или же близкую к нейтральной.Изучение
должны были бы иметь или щелочную реакцию, или же близкую к нейтральной.Изучение ![]() изомолярных растворов вольфрамата натрия и D-(+)-винной кислоты показало, что образование растворов сопровождается уменьшением концентрации ионов водорода по сравнению со значениями, рассчитанными в предположении отсутствия взаимодействия между компонентами, и
изомолярных растворов вольфрамата натрия и D-(+)-винной кислоты показало, что образование растворов сопровождается уменьшением концентрации ионов водорода по сравнению со значениями, рассчитанными в предположении отсутствия взаимодействия между компонентами, и ![]() для изомолярных растворов с соотношением компонентов 1:1 изменяется в интервале 3,3-4,0. Концентрация ионов водорода в указанных растворах в предположении отсутствия взаимодействия между компонентами будет определяться содержанием D-(+)-винной кислоты и дается следующим соотношением:
для изомолярных растворов с соотношением компонентов 1:1 изменяется в интервале 3,3-4,0. Концентрация ионов водорода в указанных растворах в предположении отсутствия взаимодействия между компонентами будет определяться содержанием D-(+)-винной кислоты и дается следующим соотношением:
![]() ,(6)
,(6)
где ![]() - молярность D-(+)-винной кислоты в растворе (моль/л).
- молярность D-(+)-винной кислоты в растворе (моль/л).
Максимум отклонения концентрации ионов водорода от расчетных значений (кривые ![]() ,(рис.5) также приходится на соотношение компонентов 1:1.
,(рис.5) также приходится на соотношение компонентов 1:1.
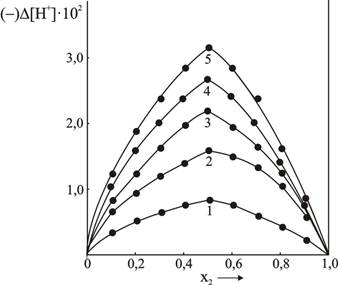
Рис.5.Отклонения концентрации водородных ионов изомолярных растворов от
расчетных значений в квазибинарной системе ![]()
Кривые ![]() для 0,1М (кривая 1), 0,3М (кривая 2), 0,5М (кривая 3), 0,7М (кривая 4) и
для 0,1М (кривая 1), 0,3М (кривая 2), 0,5М (кривая 3), 0,7М (кривая 4) и
1М (кривая 5) изомолярных растворов.
Изучена зависимость ![]() водных растворов от концентрации продукта присоединения III, которая хорошо описывается уравнением
водных растворов от концентрации продукта присоединения III, которая хорошо описывается уравнением
![]() ,(7)
,(7)
где ![]() - молярность продукта присоединения III в растворе (моль/л).
- молярность продукта присоединения III в растворе (моль/л).
Полученные результаты указывают на то, что продукт присоединения является слабой кислотой, оценка константы диссоциации которой дает значение![]() .
.
Образуемый продукт присоединения III устойчив в водных растворах и в присутствии сильной кислоты ![]() . Как было показано в работе [2], продукт присоединения распадается на вольфрамат натрия и тартрат натрия по мере добавления в систему щелочи
. Как было показано в работе [2], продукт присоединения распадается на вольфрамат натрия и тартрат натрия по мере добавления в систему щелочи ![]() .
.
Таким образом, на основании полученных данных показано, что в водных растворах вольфрамата натрия и D-(+)-винной кислоты имеет место образование оптически активного продукта присоединения с соотношением компонентов 1:1, удельным вращением ![]() являющегося очень слабой кислотой с константой диссоциации
являющегося очень слабой кислотой с константой диссоциации ![]() , для которого также установлено уравнение зависимости понижения температуры замерзания водных растворов от концентрации его в растворе.
, для которого также установлено уравнение зависимости понижения температуры замерзания водных растворов от концентрации его в растворе.
Рецензенты:
Масимов Э.А., д.ф-м.н., профессор, заведующий кафедрой «Строение вещества» физического факультета Бакинского государственного университета, г.Баку.
Бабанлы М.Б., д.х.н., профессор кафедры общей и неорганической химии химического факультета Бакинского государственного университета, г.Баку.



