Введение
Воспалительные заболевания пародонта являются одной из наиболее актуальных проблем современной стоматологии и занимают второе место по частоте и распространенности среди всех стоматологических заболеваний.
Согласно исследованиям ВОЗ за 1994 г., в 28 европейских странах выявлено, что среди лиц в возрасте 45-54 лет 68% имеют поражения пародонта. Масштабное исследование, проводимое на протяжении 2000 года в России, выявило, что распространенность заболеваний пародонта в возрастной группе старше 45 лет составляет 90,2% [1; 7].
Воспаления в полости рта и тканях пародонта чаще всего носят хронический характер и могут бессимптомно развиваться в течение многих лет при отсутствии надлежащего лечения. Современные данные о роли нелеченого пародонтита как фактора риска для общего состояния здоровья подтверждены целым рядом исследований, являются дополнительным основанием для того, чтобы уделять контролю и лечению воспалительных заболеваний пародонта повышенное внимание.
Лечение пародонтита основывается на индивидуальном подходе к каждому пациенту с учетом данных общего состояния здоровья и стоматологического статуса. В связи с этим лечение всегда носит комплексный характер, а именно использование местной и общей терапии. Таким образом, необходимо использовать лечение, воздействующие как на ткани пародонта, так и на общее состояние организма [1; 3].
При объективном рассмотрении данной проблемы становится очевидным, что большинство из методов лечения, наряду с положительными клиническими эффектами, обладают отрицательными свойствами. И с этой целью необходима разработка новых методов и лекарственных средств для восстановления поврежденной костной ткани.
Одним из наиболее перспективных методов восстановления поврежденной костной ткани является направленная регенерации. Она стала активно входить в практику как метод терапии с середины 50-х годов XX века [4-6].
Метод направленной регенерации костной ткани основан на принципе фактического отделения патологического участка для улучшения заживления костной ткани с использованием механического барьера. Применение барьерных мембран в данном методе позволяет организму использовать его естественный потенциал заживления и способствует регенерации тканей.
Существующий на сегодняшний день арсенал множества мембран, отличающихся по структуре и назначению, или не эффективны в инфицированных тканях, или технически сложны, или экономически малодоступны, или предполагают оперативные вмешательства по их извлечению.
В настоящее время существует необходимость в разработке резорбируемой мембраны, отвечающей всем требованиям, предъявляемым к средствам направленной тканевой регенерации, и, что немаловажно, экономически доступной для пациентов и лечебных учреждений.
Цель исследования
Экспериментально изучить возможность применения ксеноперикардиальной пластины «Кардиоплант» в качестве резорбируемой мембраны при использовании метода направленной регенерации костной ткани и оценить эффективность применения у пациентов с генерализованным пародонтитом.
Материалы и методы
Объектом экспериментального исследования послужили 45 половозрелых кроликов породы шиншилла. Всем кроликам воспроизводился пародонтит с использованием лигатурного метода. После развития пародонтита всех экспериментальных животных разделили на 3 группы по 15 кроликов, у которых в зоне смоделированного пародонтита, под общей анестезией (препараты: ксилан 0,2 мл в/м, золитил 0,1 мл в/м), проводились следующие вмешательства:
1 группа – отрицательный контроль - ведение костной раны под кровяным сгустком;
2 группа – использование мембраны «Кардиоплант» для изоляции костного дефекта;
3 группа – использование остеопластического материала «Бол-хитал» для заполнения костного дефекта в композиции с резорбируемой мембраной «Кардиоплант» для изоляции костного дефекта.
В дальнейшем из каждой группы выводились из эксперимента по 3 кролика на 14, 21, 28 и 56-е сутки.
Полученные фрагменты нижней челюсти, содержащие дефекты, фиксировали в 7%-ном формалине в течение 10 суток, а далее декальцинировали в 6,5%-ной азотной кислоте. После декальцинации образцы отмывали в дистиллированной воде, с последующей стандартной дегидратацией и заливкой в парафин. С полученных блоков делали парафиновые срезы толщиной 7 мкм, с последующей окраской гематоксилином и эозином, пикрофуксином по Ван-Гизону. Для микроморфометрии производили микросъёмку 10 репрезентативных полей зрения при увеличении х200 и х400 на микроскопе Leica DM-1000 при помощи фотокамеры Nikon разрешением 7 мегапикселей. Изучение микроскопического строения производили с помощью персонального компьютера с использованием специализированных программ: «Image Tool v.3.0», «Digimizer v2.2.0.1» и «WCIF ImageJ».
Результаты исследования и их обсуждение
При гистологическом исследовании фрагментов нижней челюсти экспериментальных животных, для лечения которых использовался метод ведения костной раны под кровяным сгустком, были выявлены следующие изменения.
На 14-е сутки в исследуемых препаратах отмечается уменьшение признаков дистрофии в области дефектов костной ткани. Также отмечается уменьшение лимфогистиоцитарной инфильтрации. Грубоволокнистая соединительная ткань формируется в большем объеме, при окраске по Ван-Гизону имеются фуксинофильные коллагеновые волокна. В более глубоких отделах начинает формироваться новообразованная костная ткань, причем зрелость костной ткани увеличивается по мере удаления от дефекта. В тканях пародонта отмечается уменьшение инфильтрации и, как следствие, уменьшение воспалительных процессов.
На 21-е сутки в области костного дефекта начинает формироваться первичная костная мозоль, состоящая из грубоволокнистой соединительной ткани и новообразованной костной ткани. Она состоит преимущественно из беспорядочно переплетенных коллагеновых волокон и большого количества фибробластов – коллаген продуцирующих клеток. В толще соединительнотканной мозоли можно обнаружить единичные хрящевые клетки - хондроциты, начинают образовываться изогенные группы, и появляется хрящевой матрикс. В тканях пародонта, так же как и в костной ткани, явления воспалительного процесса практически отсутствуют.
На 28-е сутки видно, что в области дефекта продолжает развиваться первичная костная мозоль, состоящая из грубоволокнистой соединительной ткани. В толще соединительнотканной мозоли обнаруживаются хрящевые клетки - хондроциты. Следует отметить, что образование соединительнотканной мозоли идет преимущественно эндостальным путем. Образующиеся костные пластинки имеют незрелый характер: беспорядочно ориентированы, на их поверхности находится большое количество фибробластов. В толще новообразованных костных трабекул содержится много остеобластов и некоторое количество остеоцитов. Между костными трабекулами в ячейках ретикулярной ткани располагаются кроветворные островки.
На 56-е сутки от начала эксперимента наблюдается дальнейшее созревание и формирование костной мозоли. Соединительнотканная мозоль превращается в костно-хрящевую, начинаются процессы ее ремоделирования. Однако в отдельных участках мозоли отмечаются поля гиалинового хряща. В новообразованных костных балках большое количество остеобластов и остеокластов, что говорит об активных процессах перестройки костной ткани.
В пространстве между костными балками большое количество ретикулярной ткани, а в ее ячейках – кроветворных клеток. В зоне бывшего дефекта выявляются молодые сосудистые элементы.
Таким образом, можно сказать, что к 56-м суткам эксперимента дефект кости в контрольной группе полностью закрывается. Однако процессы приспособления новой ткани к направлению и силе нагрузок только начинаются. Хотя сопутствующие элементы – сосуды и гемопоэтическая ткань уже сформированы и выполняют свою функцию.
При терапии с использованием резорбируемой мембраны «Кардиоплант» для изоляции костного дефекта было выявлено, что на 14-е сутки в исследуемых образцах отмечается уменьшение признаков дистрофии в области дефектов костной ткани. Также отмечается уменьшение лимфогистиоцитарной инфильтрации в ксеноперикарде и её биоинтеграция. Грубоволокнистая соединительная ткань формируется в большем объеме. В более глубоких отделах начинает формироваться новообразованная костная ткань, причем зрелость костной ткани увеличивается по мере удаления от дефекта. В тканях пародонта отмечается уменьшение инфильтрации и уменьшение воспалительных процессов.
На 21-е сутки более интенсивно идет развитие периостальной соединительнотканной мозоли. Новообразованная соединительная ткань прилежит к ксеноперикарду, и ее коллагеновые волокна и клеточные элементы постепенно врастают между волокнами ксеноперикардиальной пластины. Местами в соединительной ткани можно обнаружить изогенные группы хондроцитов и образованный ими хрящевой матрикс.
На 28-е сутки новообразованные костные пластины располагаются более упорядоченно. Общее направление их роста - вдоль ксеноперикардиальной пластины. Они также имеют на своей поверхности большое количество фибробластов и фиброцитов, а также единичные остеокласты. В толще их видны скопления остеобластов и остеоцитов. Часть трабекул представляет собой участки незавершенного остеогенеза – виден переход от хрящевой структуры к костной. Пространство между трабекулами также заполнено гемопоэтическим компонентом.
На 56-е сутки вблизи ксеноперикардиальной пластины и между ее волокнами наблюдается большое количество фибробластов. Они активно синтезируют коллагеновые и эластические волокна. Происходит прорастание соединительной ткани и сосудов надкостницы в ксеноперикард.
В самих костных пластинках можно обнаружить участки, имеющие строение гиалинового хряща. Кроме того, в костных балках содержится большое количество остеобластов и остеокластов. Все это говорит о том, что процесс образования кости продолжается.
Также наблюдается активное заселение костных лакун кроветворными элементами и усиленный рост молодых сосудов, питающих надкостницу и кость (рис. 1).
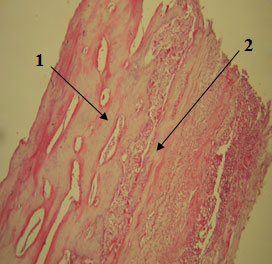
Рисунок 1. 56-е сутки. Упорядоченное расположение костных балок (1) под пластиной ксеноперикарда (2). Окраска гематоксилином и эозином, х100.
Таким образом, отличительным признаком закрытия дефекта ксеноперикардиальной пластиной является более упорядоченное расположение новообразованных костных балок. Это говорит о том, что приспособление к нагрузке здесь идет более быстрыми темпами.
При использовании остеопластического материала «Бол-хитал» для заполнения костного дефекта в композиции с использованием резорбируемой мембраны «Кардиоплант» для изоляции костного дефекта на 14-е сутки в исследуемых образцах отмечается уменьшение лимфогистиоцитарной инфильтрации в ксеноперикарде и её активная интеграция. Грубоволокнистая соединительная ткань формируется в большем объеме, при окраске по Ван-Гизону имеются фуксинофильные коллагеновые волокна. В более глубоких отделах начинает формироваться новообразованная костная ткань, причем зрелость костной ткани увеличивается по мере удаления от дефекта. В тканях пародонта отмечается уменьшение инфильтрации и, как следствие, уменьшение воспалительных процессов.
На 21-е сутки происходит интенсивное образование костной мозоли всех трех вариантов – эндостальной, периостальной и интермедиальной. Новообразованная соединительная ткань активно проникает между волокнами ксеноперикардиальной пластины, плотно срастаясь с ней.
Также бурно происходит замещение образовавшейся хрящевой ткани на костную. Видно, как происходит постепенная минерализация хрящевого матрикса и заселение пластинки костными клетками - остеобластами и остеоцитами. Только в центре трабекулы можно еще обнаружить изогенную группу хондроцитов. Отмечается высокая степень зрелости костной ткани, однако кроме высокой степени зрелости она еще и более упорядоченно расположена - параллельно длиннику кости. Таким образом, образующиеся на разных сторонах дефекта трабекулы стремятся друг к другу.
На 28-е сутки процессы остеогенеза также активны, отмечается высокая степень дифференцировки костной ткани.
На 56-е сутки наблюдается хорошее развитие костной ткани, в которой практически отсутствуют элементы хряща. Костные пластинки еще подвергаются процессам ремоделирования. Остеобласты и остеокласты, выполняющие функции антагонистов в процессах перестройки костной структуры, содержатся в количестве, незначительно превышающем их содержание в материнской кости (рис. 2).
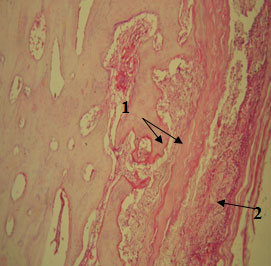
Рисунок 2. 56-е сутки. Костная ткань, покрытая ксеноперикардом (1) и собственной соединительной тканью (2). Окраска гематоксилином и эозином, х100.
Соединительная ткань надкостницы активно прорастает в ксеноперикардиальную пластину, покрывающую полость дефекта. Этому способствует большое количество фибробластов, активно продуцирующих коллагеновые и эластические волокна.
Кроветворные элементы полностью заселяют образовавшиеся костные лакуны. Развитие молодых сосудистых элементов также идет высокими темпами. Наличие тонкостенных сосудов обнаруживается уже не только вблизи ксеноперикардиальной пластины, но и в ее толще.
Заключение
Таким образом, нами было отмечено, что во всех 3 экспериментальных группах к 56-м суткам происходит заполнение костного дефекта. Но наиболее важным аспектом является степень зрелости костной ткани, заполнившей данный дефект. Наилучшие результаты были получены при совместном применении остеопластического материала «Бол-хитал» и ксеноперикардиальной пластины «Кардиоплант», при применении которых отмечалось полное закрытие дефекта костной тканью высокой степенью зрелости. При применении только ксеноперикардиальной пластины в качестве резорбируемой мембраны результат был несколько хуже, в отличие от комплексного лечения. Но тем не менее здесь наблюдается более упорядоченное расположение костных балок, свидетельствующее о большей зрелости костной ткани в отличие от ведения костного дефекта под кровяным сгустком. Полученные нами результаты исследования позволяют нам утверждать, что ксеноперикардиальные пластины «Кардиоплант» по своей эффективности вплотную приближаются к такому материалу «золотого стандарта» лечения, как Bio-Gide. Существенными преимуществами ксеноперикардиальной пластины «Кардиоплант» являются её экономическая доступность и хорошая клиническая эффективность применения, что позволяет широко применять её в практической медицине.
Рецензенты:
Ефимов Ю.В., д.м.н., доцент кафедры хирургической стоматологии и челюстно-лицевой хирургии ГБОУ ВПО «Волгоградский государственный медицинский университет», г. Волгоград.
Коннов В.В., д.м.н., заведующий кафедрой ортопедической стоматологии СГМУ им. Разумовского Минздрава России, г. Саратов.



