ВВЕДЕНИЕ
Оксисульфиды лантанидов имеют практическое значение как кристаллические матрицы люминофоров [1]. Так же, в практике нашли применение твердые растворы оксисульфидов. В частности, люминофоры на основе оксисульфида гадолиния, активированного ионами трехвалентного тербия, широко используются для различного типа люминесцентных трубок и рентгеновских экранов [2], а для оксисульфидов лантана и гадолиния, активированного ионами неодима, показана возможность использования вещества для оптической керамики [3]. Твердый раствор представляет собой матричную среду (Ln'2O2S) с равномерно распределенным в ней оксисульфидом, содержащим ион-активатор Ln3+. В простейшем приближении такой твердый раствор можно представить как систему Ln'2O2S – Ln''O2S. Заданные оптические свойства в таких твердых растворах определяются, именно наличием в них такого соединения, как Ln'Ln''O2S. В литературе имеются лишь незначительные сведения по синтезу соединений состава Ln'Ln''O2S, что является достаточно нелогичным, так как чтобы получить тот или иной материал, естественно, необходимо обратиться к приемам, которыми осуществляется синтез этого материала, или соединений, его составляющих.
Целью настоящей работы является изучение процесса водородного восстановления соосажденных сульфатов лантана – неодима и разработка нового высокоэффективного метода синтеза соединения (LaNd)O2S.
МАТЕРИАЛ И МЕТОДЫ
Соосажденные сульфаты лантана-неодима получали действием концентрированной серной кислоты на раствор, содержащий нитраты обоих элементов. Нитраты получали растворением рассчитанной навески смеси оксидов лантана и неодима, в стехиометрическом соотношении 1:1 в азотной кислоте. Установка для обработки веществ в атмосфере водорода подробно описана в [4]. Навеску соосажденных сульфатов растирали в ступке и помещали с вертикальный реактор, через который пропускали постоянный ток водорода со скоростью 1мл/с. Затем реактор помещали в предварительно нагретую вертикальную трубчатую печь. Обработка проводилась при температуре 750°С с продолжительностью 2 и 5 часов. Температурно-временной режим выбран на основе анализа диаграмм фазовых превращений систем La2(SO4)3 – H2; Nd2(SO4)3 – H2 [2]. На определенных этапах синтеза реактор вынимали из печи, охлаждали и отбирали пробу для анализа. Рентгенофазовый анализ проводили на дифрактометре ДРОН – 7 в CuKα – излучении с Ni-фильтром. Дифрактограммы идентифицировали по данным картотеки PDF-2. Для оценки полноты протекания процесса восстановления использовался химический анализ проб образцов. Анализ проводился на содержание сульфидной серы по стандартной методике [5]. Содержание воды в сульфатах и общее количество сульфатов устанавливали гравиметрически. Определение размеров и форм частиц проводилось на сканирующем зондовом атомно-силовом микроскопе Ntegra Aura. Определение проводилось в полуконтактном режиме работы с использованием тонкопленочного V-образного кантиливера из Si3N4. Частота генератора составляла 153±4 кГц. Сканирование проводилось перемещением образца, максимальное поле использованного столика ≈ 13×13 мкм.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Экспериментально установлено, что в процессе соосаждения сульфатов лантана-неодима из нитратного раствора образуется осадок, состоящий из смеси их кристаллогидратов. Для освобождения от кристаллизационной воды осадок высушен и отожжен при температуре 600°С до постоянного веса. Рентгенофазовый анализ показал, что полученный в результате всех вышеописанных операций порошок является смесью безводных сульфатов (рис.1а). Осадок соосажденных сульфатов преимущественно сформирован наноразмерными частицами 50 – 150 нм (91%), более крупные частицы имеют размеры порядка 150 – 300 нм (9%) (рис.1б,в).
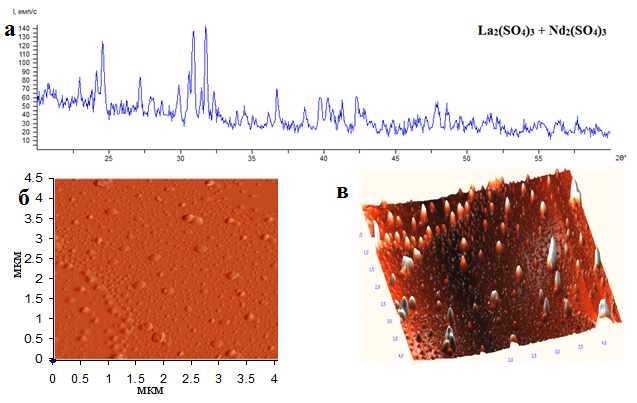
Рис.1. а) Дифрактограмма сульфатов лантана–неодима, полученных соосаждением из нитратного раствора; б) топография частиц соосажденных сульфатов лантана–неодима; в) 3D-изображение частиц соосажденных сульфатов лантана неодима
Порошок, полученный при выпаривании раствора, содержащего сульфаты лантана-неодима так же, является смесью кристаллогидратов, а его отжиг, как и в первом случае, приводит к получению безводных сульфатов. Однако, состав полученного порошка более разнообразен по размеру частиц от 20 нм до 1 мкм (рис.2). Данный разброс частиц по размеру позволяет предположить, что при выпаривании раствора формируются наночастицы, которые впоследствии объединяются в агломераты.
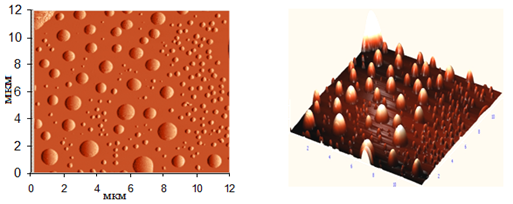
Рис.2. Топография поверхности и 3D-изображение частиц полученных при выпаривании раствора содержащего сульфаты лантана, неодима
Анализ данных о размерном составе соосажденных сульфатов лантана-неодима показывает, что для синтеза наиболее оптимальным является использование осадка, полученного при осаждении, нежели при кристаллизации, так как он сформирован преимущественно наночастицами, что обеспечивает наилучший контакт обрабатываемого вещества с водородом.
На основе анализа диаграмм фазовых превращений систем La2(SO4)3 – H2; Nd2(SO4)3 – H2 была определена оптимальная температура синтеза двойного оксисульфида – 750°С. Обработка соосажденных сульфатов лантана-неодима в атмосфере водорода при данной температуре в течении двух часов приводит к образованию смеси оксисульфидов указанных элементов (рис.3).
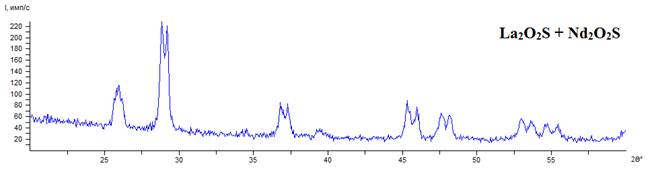
Рис.3. Дифрактограмма порошка, полученного при температурной обработке (750 °С) сульфатов лантана-неодима в атмосфере водорода в течение 2 часов
Увеличение времени обработки до 5 часов приводит к получению химически
однородного порошка соединения (LaNd)O2S (рис.4), изоструктурного соединениям Ln2O2S, кристаллизующимся в гексагональной сингонии (пространственная группа P3ml). Методами рентгеноструктурного анализа определены параметры элементарной ячейки для соединения LaNdO2S: a=4.000Å; c=6,890Å; c/a=1,723. Частицы в процессе синтеза укрупняются и изменяют свою форму (рис.4). Преимущественное формирование осадков сульфатов из наноразмерных частиц определяет относительно высокую скорость их превращения в двойной оксисульфид.
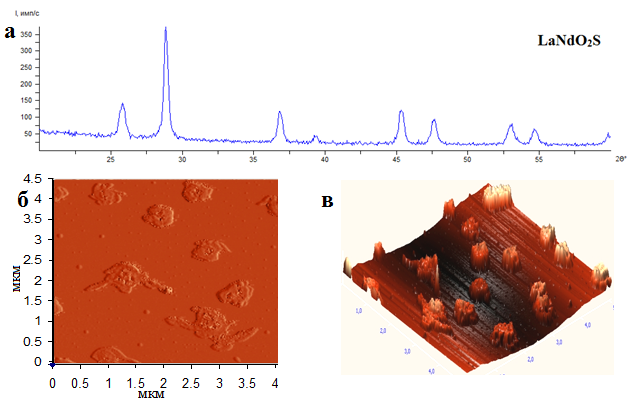
Рис.4. а) Дифрактограмма соединения LaNdO2S; б), в) топография поверхности и 3D-изображение частиц оксисульфида лантана-неодима
ВЫВОДЫ
На основе анализа диаграмм фазовых превращений в системах La2(SO4)3 – H2; Nd2(SO4)3 – H2 [4] и результатов проведенного исследования представляется возможным составление уравнений химических реакций и схемы фазовых превращений для процессов, имеющих место в ходе синтеза:
|
I этап: La2(SO4)3 + 2H2 → La2O2SO4 + 2SO2 + 2H2O Nd2(SO4)3 + 2H2 → Nd2O2SO4 + 2SO2 + 2H2O |
II этап: La2O2SO4 + 4H2 → La2O2S + 4H2O Nd2O2SO4 + 4H2 → Nd2O2S + 4H2O |
|
III этап: La2O2S + Nd2O2S → 2LaNdO2S |
|
Схема фазовых превращений при этом будет иметь вид:
La2(SO4)3 + Nd2(SO4)3 → La2O2SO4 + Nd2O2SO4 → La2O2S + Nd2O2S → LaNdO2S
Таким образом, метод температурной обработки соосажденных сульфатов лантанидов в атмосфере водорода применим для синтеза сложных оксисульфидов. При температурной обработке соосажденных сульфатов лантана-неодима в атмосфере водорода двойной оксисульфид (LaNd)O2S при температуре 750°С образуется за 5 часов. Относительно быстрое время синтеза и его невысокая температура достигаются за счет формирования наноразмерных частиц при соосаждении сульфатов лантана-неодима.
Рецензенты:
Жихарева Ирина Георгиевна, д.х.н., профессор, кафедра Общей и физической химии, Тюменский государственный нефтегазовый университет, г.Тюмень.
Морев Александр Валентинович, д.ф.м.н., профессор, кафедра физики, Тюменский государственный архитектурно-строительный университет, г.Тюмень.



