Формиат натрия широко используется в качестве противоморозной и пластифицирующей добавки в производстве строительных конструкций, в кожевенной промышленности как агент в преддубильных операциях, как сырье в производстве муравьиной кислоты и как составная часть антигололедных композиций. Растворы формиата натрия получают в качестве побочных продуктов на ряде производств. Эти растворы без дополнительной переработки находят спрос, как правило, только в зимнее время. Получение кристаллического формиата натрия, который пользуется более устойчивым спросом на рынке, значительно удорожает продукт и делает его менее конкурентоспособным. В связи с вышесказанным представляет интерес переработка растворов формиата натрия в другие продукты, которые пользуются постоянным спросом, например формиат калия.
Формиат калия используется как антиморозная и повышающая прочность присадка в бетон, компонент хладоносителей на основе органических солей, которые обладают отличными теплофизическими свойствами и коррозионно неактивны, антигололедный реагент безопасен как для автомобилей, так и для обуви пешеходов [5]. Максимальная температура замерзания водного раствора формиата калия -55 °С при концентрации соли 50 мас.%, а формиата натрия - -15 °С при концентрации соли 21 мас.% [3].
Формиат калия можно получать по реакции обменного разложения в водных растворах:
KAn + HCOONa ↔ HCOOK + NaAn (1)
В качестве второго сырьевого компонента может быть использована водорастворимая соль калия, например хлорид, нитрат, сульфат, карбонат или бикарбонат калия. Для определения температурно-концентрационных параметров процесса получения формиата калия и соли натрия необходимо, прежде всего, исследовать растворимость в трехкомпонентных водно-солевых системах из формиата натрия и солей калия и подобрать такую соль, введение которой в растворы формиата натрия приведет к протеканию реакции обменного разложения с получением формиата калия и соли натрия.
Объекты и методы исследования
В работе использованы:
- нитрат, сульфат, карбонат, бикарбонат, хлорид калия и формиат натрия марки «ч.д.а.» и «х.ч.»;
- формиат калия, синтезированный в лабораторных условиях (содержание основного вещества 97,94%);
- дистиллированная вода nD25° = 1,3325.
Перечисленные выше реактивы полностью удовлетворяют условиям проведения эксперимента и точности используемого метода исследования.
Растворимость при 25 °C определена изотермическим методом сечений [2; 4]. Термостатирование растворов производилось при помощи ультратермостата UT-7 с водным теплоносителем. Точность поддержания температуры составляла ±0,2 °C. Показатель преломления измерялся при 25 °C на рефрактометре ИРФ 454Б-2М с точностью ±0.0002. Растворимость индивидуальных солей и их смесей в воде определена с точностью 0,5 мас.%.
Результаты и их обсуждение
Вероятность протекания реакции (1) вправо можно предсказать, рассчитав произведение растворимости солей [1]. Необходимым условием существования раствора, насыщенного солями, которые образуют две взаимно растворимые пары, согласно правилу Вант-Гоффа, является равенство произведений растворимости солей, образующих каждую пару. Из двух взаимных пар солей та из них, которая обладает большим произведением растворимости отдельных солей, является неустойчивой. В результате она перейдет из осадка в раствор и превратится в другую пару. Исходя из цели работы пары формиат калия - соль натрия должны быть устойчивыми. При расчете произведения растворимости концентрацию солей выражают в молях на 1000 г воды. Из табл. 1 видно, что произведения растворимости пар солей с формиатом калия в основном больше, чем пар с формиатом натрия. Следовательно, большинство пар солей формиат калия - натриевая соль являются неустойчивыми и не могут одновременно существовать в твердой фазе в растворе при данных температурах. Устойчивыми парами солей с формиатом калия являются пары с бикарбонатом, карбонатом и сульфатом натрия при разных температурах.
Таблица 1 - Произведения растворимости пар солей
|
Температура, °С |
50 |
25 |
0 |
-10 |
|
|
Пара № 1 |
НСООNа·К2SО4 |
6,93·104 |
1,04·104 |
120,40 |
0,22 |
|
Пара № 2 |
НСООК·Nа2SО4 |
2,17·108 |
2,26·107 |
6,50·104 |
83,59 |
|
Пара № 3 |
НСООNа·КНСО3 |
87,62 |
48,18 |
14,75 |
5,33 |
|
Пара № 4 |
НСООК·NаНСО3 |
85,62 |
51,44 |
29,64 |
2,06 |
|
Пара № 5 |
НСООNа·К2СО3 |
5,47·107 |
1,68·107 |
7,61·105 |
539,98 |
|
Пара № 6 |
НСООК·Nа2СО3 |
4,68·108 |
6,09·107 |
4,72·105 |
0,79 |
|
Пара № 7 |
НСООNа·КСl |
96,89 |
64,02 |
24,28 |
10,07 |
|
Пара № 8 |
НСООК·NаСl |
312,12 |
254,69 |
217,47 |
16,99 |
|
Пара № 9 |
НСООNа·КNО3 |
139,35 |
44,72 |
8,89 |
7,65 |
|
Пара № 10 |
НСООК·NаNО3 |
665,56 |
447,57 |
307,82 |
23,36 |
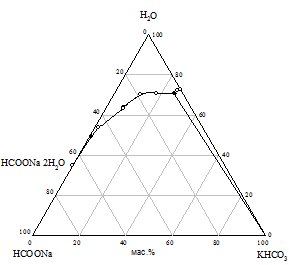
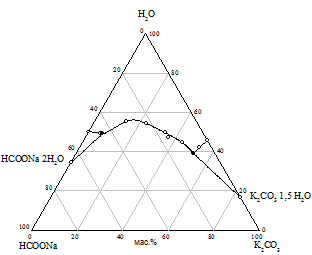
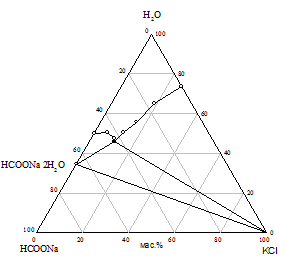
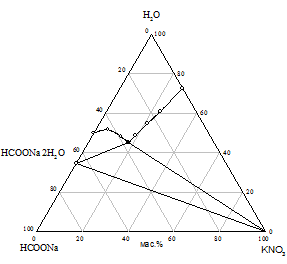
Практически предварительный расчет произведения растворимости солей не всегда отражает истинное положение вещей, поэтому нами исследована растворимость при 25 °С в пяти трехкомпонентных системах HCOONa - KАn - H2O. Изотермы растворимости систем представлены на рис. 1, составы насыщенных растворов и равновесных твердых фаз приведены в табл. 2.
На диаграммах состояния систем с бикарбонатом, карбонатом и сульфатом натрия нужно ожидать возникновение трех полей кристаллизации, ограниченных соответствующими кривыми насыщенных растворов. Из полученного экспериментального материала видно, что реакция обменного разложения протекает с образованием формиата калия и соли натрия только при использовании сульфата, бикарбоната и карбоната калия. В системах с этими солями наблюдается появление области кристаллизации нового компонента - сульфата, бикарбоната или карбоната натрия; в системе с сульфатом калия происходит кристаллизация твердых растворов на основе сульфатов натрия и калия (рис. 1 а, б, в). Таким образом, экспериментально доказано, что эти системы являются нестабильными диагональными разрезами соответствующих четырехкомпонентных взаимных систем. В системах с хлоридом и нитратом калия области кристаллизации соответствуют образующим систему солям (рис. 1 г, д).
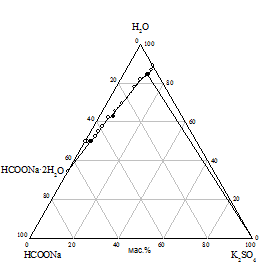
|
|
|
а |
б |
|
|
|
|
в |
г |
|
|
Рис. 1. Изотермы 25 °C растворимости систем: а) HCOONa - K2SO4 - H2O; б) HCOONa - KHCO3 - H2O; в) HCOONa - K2CO3 - H2O; г) HCOONa - KCl - H2O; д) HCOONa - KNO3 - H2O |
|
д |
Таблица 2 - Состав насыщенных растворов в системах KAn - HCOONa - H2O при 25 °C
|
|
Состав раствора, мас. % |
Солевой состав, мас. % |
nD25° |
Равновесная твердая фаза |
|||||||||||||
|
|
KAn |
НСООNа |
Н2О |
KAn |
НСООNа |
||||||||||||
|
|
Система вода - формиат натрия - сульфат калия |
||||||||||||||||
|
|
10,80 |
0,00 |
89,20 |
100,00 |
0,00 |
1,3449 |
K2SO4 |
||||||||||
|
|
11,50 |
1,77 |
86,73 |
86,66 |
13,34 |
1,3475 |
-"- |
||||||||||
|
|
11,00 |
4,45 |
84,55 |
71,20 |
28,80 |
1,3510 |
-"- |
||||||||||
|
|
10,86 |
4,84 |
84,30 |
69,17 |
30,83 |
1,3515 |
K2SO4+NaK3(SO4)2 |
||||||||||
|
|
9,00 |
9,10 |
81,90 |
49,72 |
50,28 |
1,3540 |
NaK3(SO4)2 |
||||||||||
|
|
8,30 |
13,75 |
77,95 |
37,64 |
62,36 |
1,3590 |
-"- |
||||||||||
|
|
6,80 |
23,77 |
69,43 |
22,24 |
77,76 |
1,3687 |
-"- |
||||||||||
|
|
5,60 |
28,79 |
65,61 |
16,28 |
83,72 |
1,3741 |
-"- |
||||||||||
|
|
6,10 |
30,90 |
63,00 |
16,50 |
83,50 |
1,3740 |
NaK3(SO4)2+Nа2SO4 |
||||||||||
|
|
4,50 |
33,42 |
62,08 |
11,87 |
88,13 |
1,3790 |
Nа2SO4 |
||||||||||
|
|
3,80 |
38,48 |
57,72 |
8,99 |
91,01 |
1,3840 |
-"- |
||||||||||
|
|
3,50 |
41,50 |
55,00 |
7,78 |
92,22 |
1,3885 |
-"- |
||||||||||
|
|
3,50 |
43,91 |
52,59 |
7,38 |
92,62 |
1,3900 |
-"- |
||||||||||
|
|
2,50 |
47,50 |
50,00 |
5,00 |
95,00 |
1,3975 |
Nа2SO4 + НСООNа·2Н2О |
||||||||||
|
|
2,64 |
47,30 |
50,06 |
5,29 |
94,71 |
1,3935 |
НСООNа·2Н2О |
||||||||||
|
|
1,27 |
49,00 |
49,73 |
2,53 |
97,47 |
1,3940 |
-"- |
||||||||||
|
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
||||||||||
|
|
Система вода - формиат натрия - бикарбонат калия |
||||||||||||||||
|
|
27,40 |
0,00 |
72,60 |
100,00 |
0,00 |
1,3629 |
КНСО3 |
||||||||||
|
|
26,50 |
1,47 |
72,03 |
94,74 |
5,26 |
1,3638 |
-"- |
||||||||||
|
|
25,96 |
3,54 |
70,50 |
88,00 |
12,00 |
1,3655 |
KHCO3+NaHCO3 |
||||||||||
|
|
25,50 |
3,73 |
70,77 |
87,24 |
12,76 |
1,3653 |
NaHCO3 |
||||||||||
|
|
17,74 |
11,30 |
70,96 |
61,09 |
38,91 |
1,3674 |
-"- |
||||||||||
|
|
11,50 |
18,32 |
70,18 |
38,56 |
61,44 |
1,3672 |
-"- |
||||||||||
|
|
7,10 |
29,00 |
63,90 |
19,67 |
80,33 |
1,3770 |
NaHCO3 |
||||||||||
|
|
7,50 |
29,14 |
63,36 |
20,47 |
79,53 |
1,3758 |
-"- |
||||||||||
|
|
1,50 |
44,82 |
53,68 |
3,24 |
96,76 |
1,3891 |
-"- |
||||||||||
|
|
0,40 |
50,10 |
49,50 |
0,79 |
99,21 |
1,3915 |
NaHCO3+ НСООNа·2Н2О |
||||||||||
|
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
НСООNа |
||||||||||
|
|
Система вода - формиат натрия - карбонат калия |
||||||||||||||||
|
54,40 |
0,00 |
45,60 |
100,00 |
0,00 |
1,4198 |
К2СО3·1,5Н2О |
|||||||||||
|
52,50 |
5,23 |
42,27 |
90,94 |
9,06 |
1,4200 |
-"- |
|||||||||||
|
51,73 |
9,27 |
39,00 |
84,80 |
15,20 |
1,4200 |
К2СО3·1,5Н2О + Nа2СО3 |
|||||||||||
|
44,00 |
11,48 |
44,52 |
79,31 |
20,69 |
1,4160 |
Nа2СО3 |
|||||||||||
|
36,50 |
16,19 |
47,31 |
69,27 |
30,73 |
1,4110 |
-"- |
|||||||||||
|
33,82 |
16,50 |
49,68 |
67,21 |
32,79 |
1,4070 |
-"- |
|||||||||||
|
23,25 |
22,50 |
54,25 |
50,82 |
49,18 |
1,3985 |
-"- |
|||||||||||
|
13,88 |
30,60 |
55,52 |
31,21 |
68,79 |
1,3923 |
-"- |
|||||||||||
|
6,63 |
44,37 |
49,00 |
13,00 |
87,00 |
1,3975 |
Nа2СО3+ НСООNа·2Н2О |
|||||||||||
|
5,48 |
45,20 |
49,32 |
10,81 |
89,19 |
1,3960 |
НСООNа·2Н2О |
|||||||||||
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
|||||||||||
|
Система вода - формиат натрия - хлорид калия |
|||||||||||||||||
|
26,44 |
0,00 |
73,56 |
100,00 |
0,00 |
|
КCl |
|||||||||||
|
18,80 |
16,24 |
64,96 |
53,65 |
46,35 |
1,3795 |
-"- |
|||||||||||
|
15,50 |
28,73 |
55,77 |
35,04 |
64,96 |
1,3860 |
-"- |
|||||||||||
|
12,50 |
37,19 |
50,31 |
25,16 |
74,84 |
1,3935 |
-"- |
|||||||||||
|
11,07 |
42,93 |
46,00 |
20,50 |
79,50 |
1,3985 |
КCl + НСООNа·2Н2О |
|||||||||||
|
10,06 |
42,50 |
47,44 |
19,14 |
80,86 |
1,3975 |
НСООNа·2Н2О |
|||||||||||
|
5,60 |
44,00 |
50,40 |
11,29 |
88,71 |
1,3955 |
-"- |
|||||||||||
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
|||||||||||
|
Система вода - формиат натрия - нитрат калия |
|||||||||||||||||
|
27,50 |
0,00 |
72,50 |
100,00 |
0,00 |
|
КNO3 |
|||||||||||
|
23,60 |
15,66 |
60,74 |
60,11 |
39,89 |
1,3750 |
-"- |
|||||||||||
|
21,00 |
24,10 |
54,90 |
46,56 |
53,44 |
1,3835 |
-"- |
|||||||||||
|
18,80 |
32,48 |
48,72 |
36,66 |
63,34 |
1,3920 |
-"- |
|||||||||||
|
17,60 |
37,40 |
45,00 |
32,00 |
68,00 |
1,3965 |
КNO3 + НСООNа·2Н2О |
|||||||||||
|
12,81 |
39,00 |
48,19 |
24,72 |
75,28 |
1,3930 |
НСООNа·2Н2О |
|||||||||||
|
5,41 |
43,00 |
51,59 |
11,18 |
88,82 |
1,3915 |
-"- |
|||||||||||
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
|||||||||||
Расчет и оптимизацию процессов обменного разложения солей проводят на основе диаграммы растворимости четырехкомпонентной взаимной системы KAn + HCOONa ↔ HCOOK + NaAn - H2O. Исходя из полученных экспериментальных данных в дальнейшем представляет интерес исследование растворимости в системах, состоящих из формиатов, бикарбонатов или карбонатов, или сульфатов натрия и калия.
Рецензенты
Леснов Андрей Евгеньевич, д.х.н., с.н.с. института технической химии УрО РАН, г. Пермь.
Мазунин Сергей Александрович, д.х.н., зав. кафедрой неорганической химии Пермского государственного национального исследовательского университета, г. Пермь.