Формиат натрия широко используется в качестве противоморозной и пластифицирующей добавки в производстве строительных конструкций, в кожевенной промышленности как агент в преддубильных операциях, как сырье в производстве муравьиной кислоты и как составная часть антигололедных композиций. Растворы формиата натрия получают в качестве побочных продуктов на ряде производств. Эти растворы без дополнительной переработки находят спрос, как правило, только в зимнее время. Получение кристаллического формиата натрия, который пользуется более устойчивым спросом на рынке, значительно удорожает продукт и делает его менее конкурентоспособным. В связи с вышесказанным представляет интерес переработка растворов формиата натрия в другие продукты, которые пользуются постоянным спросом, например формиат калия.
Формиат калия используется как антиморозная и повышающая прочность присадка в бетон, компонент хладоносителей на основе органических солей, которые обладают отличными теплофизическими свойствами и коррозионно неактивны, антигололедный реагент безопасен как для автомобилей, так и для обуви пешеходов [5]. Максимальная температура замерзания водного раствора формиата калия -55 °С при концентрации соли 50 мас.%, а формиата натрия - -15 °С при концентрации соли 21 мас.% [3].
Формиат калия можно получать по реакции обменного разложения в водных растворах:
KAn + HCOONa ↔ HCOOK + NaAn (1)
В качестве второго сырьевого компонента может быть использована водорастворимая соль калия, например хлорид, нитрат, сульфат, карбонат или бикарбонат калия. Для определения температурно-концентрационных параметров процесса получения формиата калия и соли натрия необходимо, прежде всего, исследовать растворимость в трехкомпонентных водно-солевых системах из формиата натрия и солей калия и подобрать такую соль, введение которой в растворы формиата натрия приведет к протеканию реакции обменного разложения с получением формиата калия и соли натрия.
Объекты и методы исследования
В работе использованы:
- нитрат, сульфат, карбонат, бикарбонат, хлорид калия и формиат натрия марки «ч.д.а.» и «х.ч.»;
- формиат калия, синтезированный в лабораторных условиях (содержание основного вещества 97,94%);
- дистиллированная вода nD25° = 1,3325.
Перечисленные выше реактивы полностью удовлетворяют условиям проведения эксперимента и точности используемого метода исследования.
Растворимость при 25 °C определена изотермическим методом сечений [2; 4]. Термостатирование растворов производилось при помощи ультратермостата UT-7 с водным теплоносителем. Точность поддержания температуры составляла ±0,2 °C. Показатель преломления измерялся при 25 °C на рефрактометре ИРФ 454Б-2М с точностью ±0.0002. Растворимость индивидуальных солей и их смесей в воде определена с точностью 0,5 мас.%.
Результаты и их обсуждение
Вероятность протекания реакции (1) вправо можно предсказать, рассчитав произведение растворимости солей [1]. Необходимым условием существования раствора, насыщенного солями, которые образуют две взаимно растворимые пары, согласно правилу Вант-Гоффа, является равенство произведений растворимости солей, образующих каждую пару. Из двух взаимных пар солей та из них, которая обладает большим произведением растворимости отдельных солей, является неустойчивой. В результате она перейдет из осадка в раствор и превратится в другую пару. Исходя из цели работы пары формиат калия - соль натрия должны быть устойчивыми. При расчете произведения растворимости концентрацию солей выражают в молях на 1000 г воды. Из табл. 1 видно, что произведения растворимости пар солей с формиатом калия в основном больше, чем пар с формиатом натрия. Следовательно, большинство пар солей формиат калия - натриевая соль являются неустойчивыми и не могут одновременно существовать в твердой фазе в растворе при данных температурах. Устойчивыми парами солей с формиатом калия являются пары с бикарбонатом, карбонатом и сульфатом натрия при разных температурах.
Таблица 1 - Произведения растворимости пар солей
|
Температура, °С |
50 |
25 |
0 |
-10 |
|
|
Пара № 1 |
НСООNа·К2SО4 |
6,93·104 |
1,04·104 |
120,40 |
0,22 |
|
Пара № 2 |
НСООК·Nа2SО4 |
2,17·108 |
2,26·107 |
6,50·104 |
83,59 |
|
Пара № 3 |
НСООNа·КНСО3 |
87,62 |
48,18 |
14,75 |
5,33 |
|
Пара № 4 |
НСООК·NаНСО3 |
85,62 |
51,44 |
29,64 |
2,06 |
|
Пара № 5 |
НСООNа·К2СО3 |
5,47·107 |
1,68·107 |
7,61·105 |
539,98 |
|
Пара № 6 |
НСООК·Nа2СО3 |
4,68·108 |
6,09·107 |
4,72·105 |
0,79 |
|
Пара № 7 |
НСООNа·КСl |
96,89 |
64,02 |
24,28 |
10,07 |
|
Пара № 8 |
НСООК·NаСl |
312,12 |
254,69 |
217,47 |
16,99 |
|
Пара № 9 |
НСООNа·КNО3 |
139,35 |
44,72 |
8,89 |
7,65 |
|
Пара № 10 |
НСООК·NаNО3 |
665,56 |
447,57 |
307,82 |
23,36 |
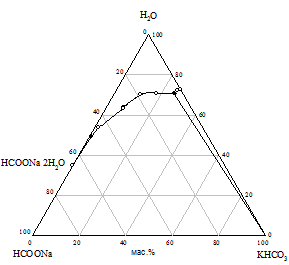
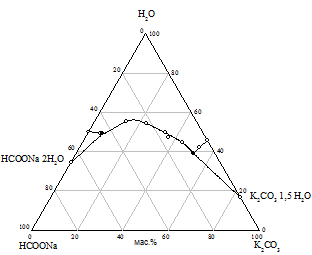
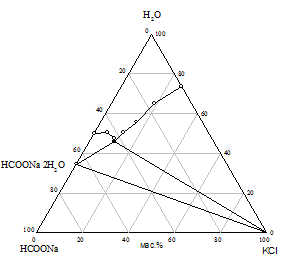
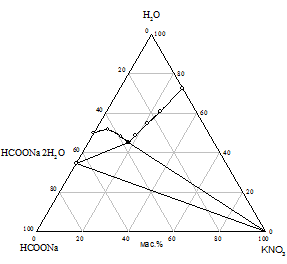
Практически предварительный расчет произведения растворимости солей не всегда отражает истинное положение вещей, поэтому нами исследована растворимость при 25 °С в пяти трехкомпонентных системах HCOONa - KАn - H2O. Изотермы растворимости систем представлены на рис. 1, составы насыщенных растворов и равновесных твердых фаз приведены в табл. 2.
На диаграммах состояния систем с бикарбонатом, карбонатом и сульфатом натрия нужно ожидать возникновение трех полей кристаллизации, ограниченных соответствующими кривыми насыщенных растворов. Из полученного экспериментального материала видно, что реакция обменного разложения протекает с образованием формиата калия и соли натрия только при использовании сульфата, бикарбоната и карбоната калия. В системах с этими солями наблюдается появление области кристаллизации нового компонента - сульфата, бикарбоната или карбоната натрия; в системе с сульфатом калия происходит кристаллизация твердых растворов на основе сульфатов натрия и калия (рис. 1 а, б, в). Таким образом, экспериментально доказано, что эти системы являются нестабильными диагональными разрезами соответствующих четырехкомпонентных взаимных систем. В системах с хлоридом и нитратом калия области кристаллизации соответствуют образующим систему солям (рис. 1 г, д).
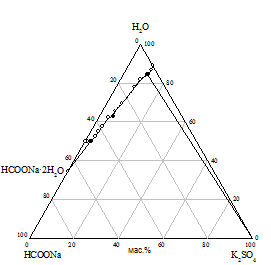
|
|
|
а |
б |
|
|
|
|
в |
г |
|
|
Рис. 1. Изотермы 25 °C растворимости систем: а) HCOONa - K2SO4 - H2O; б) HCOONa - KHCO3 - H2O; в) HCOONa - K2CO3 - H2O; г) HCOONa - KCl - H2O; д) HCOONa - KNO3 - H2O |
|
д |
Таблица 2 - Состав насыщенных растворов в системах KAn - HCOONa - H2O при 25 °C
|
|
Состав раствора, мас. % |
Солевой состав, мас. % |
nD25° |
Равновесная твердая фаза |
|||||||||||||
|
|
KAn |
НСООNа |
Н2О |
KAn |
НСООNа |
||||||||||||
|
|
Система вода - формиат натрия - сульфат калия |
||||||||||||||||
|
|
10,80 |
0,00 |
89,20 |
100,00 |
0,00 |
1,3449 |
K2SO4 |
||||||||||
|
|
11,50 |
1,77 |
86,73 |
86,66 |
13,34 |
1,3475 |
-"- |
||||||||||
|
|
11,00 |
4,45 |
84,55 |
71,20 |
28,80 |
1,3510 |
-"- |
||||||||||
|
|
10,86 |
4,84 |
84,30 |
69,17 |
30,83 |
1,3515 |
K2SO4+NaK3(SO4)2 |
||||||||||
|
|
9,00 |
9,10 |
81,90 |
49,72 |
50,28 |
1,3540 |
NaK3(SO4)2 |
||||||||||
|
|
8,30 |
13,75 |
77,95 |
37,64 |
62,36 |
1,3590 |
-"- |
||||||||||
|
|
6,80 |
23,77 |
69,43 |
22,24 |
77,76 |
1,3687 |
-"- |
||||||||||
|
|
5,60 |
28,79 |
65,61 |
16,28 |
83,72 |
1,3741 |
-"- |
||||||||||
|
|
6,10 |
30,90 |
63,00 |
16,50 |
83,50 |
1,3740 |
NaK3(SO4)2+Nа2SO4 |
||||||||||
|
|
4,50 |
33,42 |
62,08 |
11,87 |
88,13 |
1,3790 |
Nа2SO4 |
||||||||||
|
|
3,80 |
38,48 |
57,72 |
8,99 |
91,01 |
1,3840 |
-"- |
||||||||||
|
|
3,50 |
41,50 |
55,00 |
7,78 |
92,22 |
1,3885 |
-"- |
||||||||||
|
|
3,50 |
43,91 |
52,59 |
7,38 |
92,62 |
1,3900 |
-"- |
||||||||||
|
|
2,50 |
47,50 |
50,00 |
5,00 |
95,00 |
1,3975 |
Nа2SO4 + НСООNа·2Н2О |
||||||||||
|
|
2,64 |
47,30 |
50,06 |
5,29 |
94,71 |
1,3935 |
НСООNа·2Н2О |
||||||||||
|
|
1,27 |
49,00 |
49,73 |
2,53 |
97,47 |
1,3940 |
-"- |
||||||||||
|
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
||||||||||
|
|
Система вода - формиат натрия - бикарбонат калия |
||||||||||||||||
|
|
27,40 |
0,00 |
72,60 |
100,00 |
0,00 |
1,3629 |
КНСО3 |
||||||||||
|
|
26,50 |
1,47 |
72,03 |
94,74 |
5,26 |
1,3638 |
-"- |
||||||||||
|
|
25,96 |
3,54 |
70,50 |
88,00 |
12,00 |
1,3655 |
KHCO3+NaHCO3 |
||||||||||
|
|
25,50 |
3,73 |
70,77 |
87,24 |
12,76 |
1,3653 |
NaHCO3 |
||||||||||
|
|
17,74 |
11,30 |
70,96 |
61,09 |
38,91 |
1,3674 |
-"- |
||||||||||
|
|
11,50 |
18,32 |
70,18 |
38,56 |
61,44 |
1,3672 |
-"- |
||||||||||
|
|
7,10 |
29,00 |
63,90 |
19,67 |
80,33 |
1,3770 |
NaHCO3 |
||||||||||
|
|
7,50 |
29,14 |
63,36 |
20,47 |
79,53 |
1,3758 |
-"- |
||||||||||
|
|
1,50 |
44,82 |
53,68 |
3,24 |
96,76 |
1,3891 |
-"- |
||||||||||
|
|
0,40 |
50,10 |
49,50 |
0,79 |
99,21 |
1,3915 |
NaHCO3+ НСООNа·2Н2О |
||||||||||
|
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
НСООNа |
||||||||||
|
|
Система вода - формиат натрия - карбонат калия |
||||||||||||||||
|
54,40 |
0,00 |
45,60 |
100,00 |
0,00 |
1,4198 |
К2СО3·1,5Н2О |
|||||||||||
|
52,50 |
5,23 |
42,27 |
90,94 |
9,06 |
1,4200 |
-"- |
|||||||||||
|
51,73 |
9,27 |
39,00 |
84,80 |
15,20 |
1,4200 |
К2СО3·1,5Н2О + Nа2СО3 |
|||||||||||
|
44,00 |
11,48 |
44,52 |
79,31 |
20,69 |
1,4160 |
Nа2СО3 |
|||||||||||
|
36,50 |
16,19 |
47,31 |
69,27 |
30,73 |
1,4110 |
-"- |
|||||||||||
|
33,82 |
16,50 |
49,68 |
67,21 |
32,79 |
1,4070 |
-"- |
|||||||||||
|
23,25 |
22,50 |
54,25 |
50,82 |
49,18 |
1,3985 |
-"- |
|||||||||||
|
13,88 |
30,60 |
55,52 |
31,21 |
68,79 |
1,3923 |
-"- |
|||||||||||
|
6,63 |
44,37 |
49,00 |
13,00 |
87,00 |
1,3975 |
Nа2СО3+ НСООNа·2Н2О |
|||||||||||
|
5,48 |
45,20 |
49,32 |
10,81 |
89,19 |
1,3960 |
НСООNа·2Н2О |
|||||||||||
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
|||||||||||
|
Система вода - формиат натрия - хлорид калия |
|||||||||||||||||
|
26,44 |
0,00 |
73,56 |
100,00 |
0,00 |
|
КCl |
|||||||||||
|
18,80 |
16,24 |
64,96 |
53,65 |
46,35 |
1,3795 |
-"- |
|||||||||||
|
15,50 |
28,73 |
55,77 |
35,04 |
64,96 |
1,3860 |
-"- |
|||||||||||
|
12,50 |
37,19 |
50,31 |
25,16 |
74,84 |
1,3935 |
-"- |
|||||||||||
|
11,07 |
42,93 |
46,00 |
20,50 |
79,50 |
1,3985 |
КCl + НСООNа·2Н2О |
|||||||||||
|
10,06 |
42,50 |
47,44 |
19,14 |
80,86 |
1,3975 |
НСООNа·2Н2О |
|||||||||||
|
5,60 |
44,00 |
50,40 |
11,29 |
88,71 |
1,3955 |
-"- |
|||||||||||
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
|||||||||||
|
Система вода - формиат натрия - нитрат калия |
|||||||||||||||||
|
27,50 |
0,00 |
72,50 |
100,00 |
0,00 |
|
КNO3 |
|||||||||||
|
23,60 |
15,66 |
60,74 |
60,11 |
39,89 |
1,3750 |
-"- |
|||||||||||
|
21,00 |
24,10 |
54,90 |
46,56 |
53,44 |
1,3835 |
-"- |
|||||||||||
|
18,80 |
32,48 |
48,72 |
36,66 |
63,34 |
1,3920 |
-"- |
|||||||||||
|
17,60 |
37,40 |
45,00 |
32,00 |
68,00 |
1,3965 |
КNO3 + НСООNа·2Н2О |
|||||||||||
|
12,81 |
39,00 |
48,19 |
24,72 |
75,28 |
1,3930 |
НСООNа·2Н2О |
|||||||||||
|
5,41 |
43,00 |
51,59 |
11,18 |
88,82 |
1,3915 |
-"- |
|||||||||||
|
0,00 |
50,00 |
50,00 |
0,00 |
100,00 |
1,3884 |
-"- |
|||||||||||
Расчет и оптимизацию процессов обменного разложения солей проводят на основе диаграммы растворимости четырехкомпонентной взаимной системы KAn + HCOONa ↔ HCOOK + NaAn - H2O. Исходя из полученных экспериментальных данных в дальнейшем представляет интерес исследование растворимости в системах, состоящих из формиатов, бикарбонатов или карбонатов, или сульфатов натрия и калия.
Рецензенты
Леснов Андрей Евгеньевич, д.х.н., с.н.с. института технической химии УрО РАН, г. Пермь.
Мазунин Сергей Александрович, д.х.н., зав. кафедрой неорганической химии Пермского государственного национального исследовательского университета, г. Пермь.
Библиографическая ссылка
Кудряшова О.С., Матвеева К.Р., Бабченко Н.А. РАСТВОРИМОСТЬ В ТРЕХКОМПОНЕНТНЫХ СИСТЕМАХ KAN – HCOONA – H2O // Современные проблемы науки и образования. 2012. № 5. ;URL: https://science-education.ru/ru/article/view?id=7301 (дата обращения: 16.02.2026).