Регуляция фотосинтетической функции в онтогенезе связано как с процессами роста и развития растения, так и формированием системы донорно-акцепторных отношений в растении. Однако еще недостаточно изучена регуляция путей электронного транспорта в онтогенезе, особенно в связи с их альтернативностью. Как известно, фотосинтез - сложный процесс, зависимый от многих факторов, таких как фотохимические и ферментативные реакции, состояние фотосинтетического аппарата и других [2]. Значения Fv/Fm отражают потенциальный квантовый выход ФС II и используются в качестве чувствительного индикатора состояния фотосинтеза. В общем, флуоресценция хлорофилла предоставляет информацию о том, как световая энергия, поглощенная хлорофиллом, влияет на ФС II, т.е. степень использования энергии ФС II и степень повреждения ФС II избытком света. Поток электронов через ФС II свидетельствует об общей интенсивности фотосинтеза, и это облегчает быстрое оценивание эффективности фотосинтеза в условиях, когда другие методы не применимы [9]. Исходя из этого, целью данной работы являлось исследование фотохимической эффективности ФС II генотипов пшеницы, выращенных при почвенной засухе в течение всего онтогенеза.
Материалы и методы
В опытах использовали генотипы пшеницы, различающиеся по засухоустойчивости - Triticum durum L.: Баракатли-95 (засухоустойчивый) и Гарагылчыг-2 (не устойчивый к засухе); и Triticum aestivum L.: Азаматли-95 (засухоустойчивый) и Гийматли-2/17 (не устойчивый к засухе). Растения были взяты из экспериментальной базы Научно-исследовательского Института Земледелия (Баку, Азербайджан). На основе урожая зерна в течение нескольких лет была определена чувствительность этих генотипов к засухе в различных областях Азербайджана [1,4]. Генотипы были выращены в полевых условиях на большой площади при нормальном водообеспечении и в условиях почвенной засухи. Обезвоживание достигалось предотвращением полива. Опыты проводились во всех фазах онтогенеза.
Листья были измельчены с помощью гомогенезатора типа Waring blender (Объединенное Королевство) при полной скорости четыре раза в течение 20 секунд в охлажденной среде для выделения хлоропластов, содержащей 0,4 М сахарозу, 20 мМ Трис, 10 мМ NaCl, 1 мМ EDTA-Na, 5 мМ аскорбат натрия и 0,1 % ПЭГ, pH 7,8, как описано в работе [6]. Гомогенат был дважды отфильтрован через четыре слоя марли. Фильтрат центрифугировали 5 мин при 200 g и затем в течение 10 мин при 1000 g. Полученный осадок хлоропластов суспендировали в течение 30 минут в гипотоническом буфере, состоящем из 5 мМ Трис-HCl (pH 7,8) и 1 мМ MgCl2, и центрифугировали в течение 20 мин при 5000 g. Осажденные тилакоидные мембраны были ресуспендированы 5 мМ Трис-HCl (pH 8,0). Все процедуры были выполнены при 4ºC. Концентрация хлорофилла была определена спектрофотометрическим методом в 80 %-ном ацетоновом экстракте.
Измерения фотоиндуцированных изменений выхода флуоресценции от начального (Fo) до максимального уровня (Fmax) проводили при комнатной температуре на установке, описанной в работе [7]. Потенциальный квантовый выход ФС II рассчитывали по формуле: Фр = Fv/Fm = (Fm-Fo)/Fm, где Fv- вариабельная флуоресценция, Fm - максимальная флуоресценция, Fo - начальная флуоресценция, Фр - потенциальный квантовый выход ФС II.
Результаты и обсуждение
В данной работе рассмотрено изменение величины Fv/Fm в течение онтогенеза, как при нормальном водообеспечении, так и при дефиците воды. У генотипа Баракатли-95 в контрольном варианте максимальное значение для Fv/Fm наблюдалось в конце фазы цветения (Fv/Fm=0,81), а минимальное значение в конце онтогенеза - во время восковой спелости (Fv/Fm=0,75) (Рис.1). При водном дефиците в фазе выхода в трубку потенциальный квантовый выход ФС II у Баракатли-95 был на уровне контроля. В начале фазы колошения наблюдается снижение квантового выхода, как в контрольном варианте, так и в стрессовом. Однако, при стрессе наблюдаемое снижение намного больше, чем в контроле. В конце этой фазы значение Fv/Fm сильно повышается. Самое максимальное значение для потенциального квантового выхода ФСII у Баракатли-95 наблюдается в конце фазы колошения, к тому же у стрессового варианта (Fv/Fm=0,82). В начале фазы цветения особенных изменений не наблюдается. В конце цветения в контрольном варианте продолжается
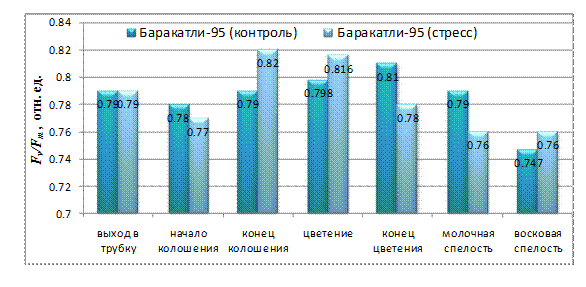
Рис. 1. Потенциальный квантовый выход ФСII у генотипа Баракатли-95 в онтогенезе при нормальном водообеспечении и при водном дефиците
повышение Fv/Fm, тогда как в стрессовом варианте оно существенно снижается. В фазе молочной спелости в обоих вариантах наблюдается снижение этого параметра. Во время восковой спелости значение Fv/Fm стабилизируется в стрессовом варианте и снижается до минимума в контрольном.
У генотипа Гарагылчыг-2 разница в значении Fv/Fm возникла уже в самом начале стресса (рис. 2), так как в фазе выхода в трубку в контрольном варианте значение составляло Fv/Fm=0,77, в стрессовом варианте - Fv/Fm=0,84. У контрольных растений Гарагылчыг-2 квантовый выход ФС II по ходу онтогенеза постепенно повышается, в конце фазы колошения и на всем протяжении фазы цветения остается стабильным (Fv/Fm~0,81), затем постепенно снижается до фазы восковой спелости (Fv/Fm=0,77). У подвергнутых засухе растений Гарагылчыг-2, как упоминалось выше, максимальное значение для Fv/Fm наблюдалось в фазе выхода в трубку и уже в начале колошения оно существенно снижалось (Fv/Fm=0,8), но оставалось выше контроля. В конце фаз колошения и цветения разницы между контролем и засухой не наблюдалось. В конечных фазах онтогенеза, когда засуха более суровая, потенциальный квантовый выход ФС II у неустойчивого к засухе генотипа Гарагылчыг-2 снижается по сравнению с контролем.
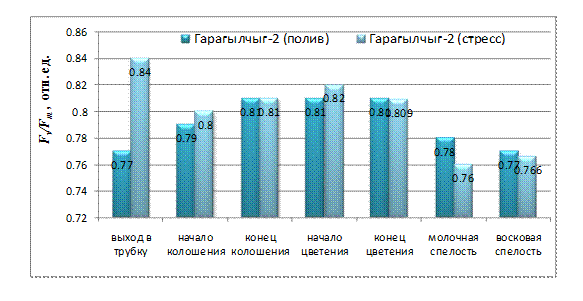
Рис. 2. Потенциальный квантовый выход ФС II у генотипа Гарагылчыг-2 в онтогенезе при нормальном водообеспечении и при водном дефиците
У генотипа Азаматли-95 как при нормальном водообеспечении, так и при стрессе самые максимальные значения квантового выхода ФС II наблюдаются в фазе выхода в трубку: в контрольном варианте Fv/Fm=0,85, в стрессовом варианте Fv/Fm= 0,87 (рис. 3). Следует отметить, что это самые высокие показатели для Fv/Fm среди всех генотипов. В начале колошения наблюдается снижение этого параметра. С начала фазы колошения до конца фазы цветения отношение Fv/Fm было ниже, чем у контроля.
В стрессовом варианте Азаматли-95 значение Fv/Fm повышается по сравнению с контролем в фазе молочной спелости и незначительно снижается в фазе восковой спелости.
У генотипа Гийматли-2/17 в отличие от Азаматли-95 самые низкие значения для Fv/Fm наблюдаются в начале онтогенеза - в фазе выхода в трубку: в контрольном варианте Fv/Fm=0,77, в стрессовом варианте Fv/Fm=0,75 (рис. 4). В начале фазы колошения отношение Fv/Fm повышается в обоих вариантах, но в стрессовом варианте остается ниже контрольного значения. Наблюдаемое
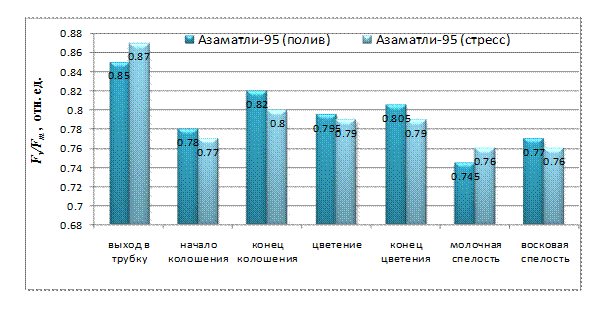
Рис. 3. Потенциальный квантовый выход ФСII у генотипа Азаматли-95 в процессе онтогенеза при нормальном водообеспечении и при водном дефиците
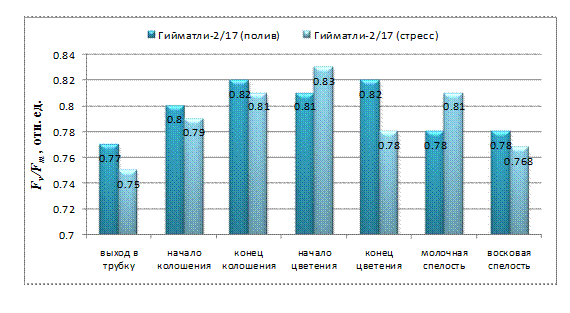
Рис. 4. Потенциальный квантовый выход ФСII у генотипа Гийматли-2/17 в онтогенезе при нормальном водообеспечении и при водном дефиците
повышение продолжается до конца этой фазы и для контрольных растений достигает максимального значения. В отличие от контрольных растений, для растений, подверженных засухе, самое высокое значение Fv/Fm наблюдается в начале фазы цветения (Fv/Fm=0,83). Для сравнения в этой фазе отношение Fv/Fm у контрольных растений составляет 0,81. В конце цветения у контрольных растений особых изменений не наблюдаются, но у неорошаемых растений величина Fv/Fm резко снижается (Fv/Fm=0,78). В фазе молочной спелости, наоборот, у контрольных растений наблюдается снижение этого параметра, а у стрессовых оно повышается выше контроля. Во время следующей фазы восковой спелости у контрольных растений значение Fv/Fm почти не меняется, у подверженных засухе растений Гийматли-2/17 существенно снижается (Fv/Fm=0,77) и падает ниже контрольного значения.
В вариабельную флуоресценцию Fv вносят вклад как QВ-восстанавливающие, так и QВ-невосстанавливающие комплексы ФС II. В QВ-невосстанавливающих комплексах ФС II осуществляется разделение зарядов, но электроны не переносятся на пул пластохинонов. В активном состоянии QВ-восстанавливающие комплексы ФС II способны осуществлять перенос электронов между QА и QВ. При повреждении белка D1 они утрачивают эту способность и превращаются в QВ-невосстанавливающие комплексы [3]. В оптимальных условиях, благодаря реакциям цикла репарации, поддерживается постоянное соотношение между этими типами комплексов ФС II. Вероятно, обезвоживание вызывает нарушение реакций на акцепторной стороне ФС II, заключающееся в повышении количества QВ-невосстанавливающих центров.
Снижение величины Fv/Fm - хорошая характеристика фотосинтетического фотоингибирования и обычно рассматривается как показатель, характеризующий появление фотоингибирования [2]. Увеличивание Fv/Fm при засухе по сравнению с контролем указывает на снижение фотоингибирования, стимуляцию фотосинтеза и защиту ФС при водном дефиците. Известно, что ФС II является частью фотосинтетического аппарата наиболее уязвимой для индуцированного светом повреждения, и такое повреждение является первым проявлением стресса в листе. Хотя такие исследования флуоресценции хлорофилла требуют весьма тщательной разработки и, как правило, сочетаются с другими методами, такими как измерение газообмена, это обеспечивает быстрое, но точное оценивание фотосинтетической эффективности даже на начальных этапах стресса. Самое главное, флуоресценция хлорофилла позволяет понять способность растения выносить действие окружающего стресса, а также, в какой степени такой стресс повреждает фотосинтетический аппарат [8].
Работа выполнена при поддержке гранта EİF-2010-1(1)-40/24-M-20 Фонда развития науки при Президенте Азербайджанской Республики
Статья подготовлена в рамках проведения VI Съезда Российского фотобиологического общества в рамках госконтракта № 14.741.12.0157 Министерства образования и науки Российской Федерации.
Рецензенты:
- Саркаров С.В., д.х.н., профессор, главный научный сотрудник Института ботаники НАНА, г. Баку.
- Гулиев Н.М., д.б.н., главный научный сотрудник лаборатории энзимологии фотосинтетической ассимиляции углерода Института ботаники НАНА, г. Баку.
Работа получена 11.11.2011.



