Введение
Протеинкиназы, являясь ключевыми компонентами клеточных сигнальных путей, участвуют в регуляции гомеостаза (рост, пролиферация, апоптоз) и тесно связаны с процессами онкогенеза, что делает их перспективными мишенями для таргетной терапии онкологических заболеваний [1-3]. В частности, низкомолекулярные ингибиторы тирозинкиназы (ИТК) рецептора эпидермального фактора роста (EGFR), характеризующегося гиперэкспрессией или активирующими мутациями при различных типах опухолей, успешно применяются в клинической практике на протяжении нескольких десятилетий [4]. К таким препаратам относятся гефитиниб (ZD1839), эрлотиниб (CID176870), осимертиниб (AZD9291) и другие соединения, демонстрирующие высокую эффективность в терапии немелкоклеточного рака лёгкого (НМРЛ) [5; 6].
На российском фармацевтическом рынке представлены зарубежные оригинальные ИТК EGFR и их дженерики. В то же время разработка отечественных оригинальных таргетных препаратов является приоритетной частью стратегии развития фармацевтической отрасли РФ, направленной на обеспечение лекарственной независимости [7]. К настоящему времени зарегистрирована одна оригинальная российская фармацевтическая субстанция – алофаниб (RPT835), прошедшая первую фазу клинических испытаний и представляющая собой аллостерический низкомолекулярный ингибитор рецептора фактора роста фибробластов 2 типа (FGFR 2) [8].
Актуальность разработки новых ИТК EGFR также обусловлена проблемой резистентности. У большинства пациентов первоначальный ответ на ИТК EGFR сменяется развитием устойчивости, что приводит к прогрессированию заболевания [9]. Установленные механизмы резистентности к ИТК EGFR можно подразделить на две категории. К первой относится непосредственное изменение в целевом белке, например в результате потери сенсибилизирующей мутации (T790M) или возникновения вторичных мутаций EGFR (C797S, L718Q, G724S и др.), ко второй – альтернативная активация внутриклеточных сигнальных путей, вызванная, например, хромосомными аберрациями (амплификация Met/HER2) или мутациями (KRAS/BRAF/PIK3CA), а также фенотипическая трансформация опухоли [10; 11].
Поиск и создание новых противоопухолевых препаратов сопряжены с годами работы, высокими затратами, а также с высоким риском неудачи [12]. Однако методы компьютерного моделирования позволяют оптимизировать выявление перспективных молекул-кандидатов среди различных классов соединений [13-15]. Для разработки новых ИТК EGFR особый интерес представляет скрининг гетероциклических соединений, в частности пиримидина и его производных [16-18]. В сотрудничестве с Пятигорским медико-фармацевтическим институтом был проведён in silico скрининг 17 соединений. На основании экспериментальных значений константы ингибирования (Ki) киназного центра EGFR отобрано новое производное пиримидина: 4-{2-[2-(2-гидрокси-3-метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамид (далее PMSoVn). Предварительные расчёты с использованием методов молекулярного докинга (Auto Dock GPU) и молекулярной динамики (GROMACS, BioEurica) выявили структурные особенности PMSoVn, обеспечивающие высокое сродство к внутриклеточному домену EGFR. В подтверждение in silico данных необходимо исследование противоопухолевой активности соединения в опытах in vitro.
Цель исследования – оценка противоопухолевой активности соединения PMSoVn в отношении клеточных линий НМРЛ человека А549 и NCI-H1299.
Материалы и методы исследования
Соединение PMSoVn (рис. 1) стабилизировали 1-этенилпирролидин-2-оном (поливинилпирролидон (ПВП), (ГОСТ ФС 42-1194-98)); полученная мелкодисперсная коллоидная смесь была прозрачной, слабо-жёлтого цвета, не имела запаха и растворялась в воде.
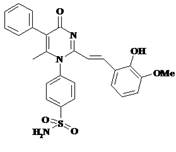
Рис. 1. Структурная формула 4-{2-[2-(2-гидрокси-3-метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамида (PMSoVn)
Клеточные линии и условия культивирования
В эксперименте использовали клеточные линии НМРЛ человека А549 (EGFR дикий тип, KRAS G12S) и NCI-Н1299 (EGFR дикий тип, p53-null). Культивирование проводили в полной питательной среде на основе DMEM (Service Bio, Китай) с добавлением 10% фетальной бычьей сыворотки (Hy Clone, США), 1% неосновных аминокислот (Gibco, США), 1% глутамина («Биолот», Россия) и 1% гентамицина («Биолот», Россия) во влажной атмосфере с 5,0% СО2 при температуре 37°С. После достижения логарифмической фазы роста клетки высевали в 96-луночные планшеты (5х103клеток на лунку) и культивировали в течение 24 часов для адгезии.
Оценка жизнеспособности клеток (МТТ-тест)
Цитотоксическое действие PMSoVn оценивали с использованием колориметрического МТТ-теста (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ) в соответствии с методологией, описанной Kumar et al. [19]. После 24 часов культивирования среду в опытных лунках заменяли на свежую, содержащую PMSoVn в концентрациях: 22,47; 11,23; 5,62; 2,81; 1,40; 0,70; 0,35; 0,18; 0,088; 0,044 и 0,022 µМ. В контрольные лунки добавляли среду, содержащую ПВП в концентрации, эквивалентной его содержанию в опытных лунках. Планшеты инкубировали в течение 24, 48 и 72 часов. После указанной обработки в каждую лунку вносили 20 мкл рабочего раствора МТТ (5 мг/мл в фосфатном буфере) и инкубировали 2 часа для образования формазана. Затем среду в лунках удаляли и добавляли 100 мкл диметилсульфоксида для солюбилизации кристаллов формазана. Оптическую плотность измеряли на планшетном ридере Infinite® M NanoPlus (Tecan, Швейцария) при длине волны 540 нм. Каждый вариант эксперимента включил 16 повторов, выполненных в трёх независимых сериях.
Жизнеспособность клеток в каждой лунке рассчитывали по формуле: жизнеспособность (%)=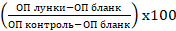 , где ОП лунки – оптическая плотность лунок, ОП контроль – среднее значение оптической плотности в контрольных лунках, ОП бланк – оптическая плотность лунок без клеток. Нормализованные значения выражали в процентах относительно контроля. Усреднённые результаты представлены как среднее арифметическое ± стандартное отклонение (M±SD) для трёх независимых серий опыта (n=3).
, где ОП лунки – оптическая плотность лунок, ОП контроль – среднее значение оптической плотности в контрольных лунках, ОП бланк – оптическая плотность лунок без клеток. Нормализованные значения выражали в процентах относительно контроля. Усреднённые результаты представлены как среднее арифметическое ± стандартное отклонение (M±SD) для трёх независимых серий опыта (n=3).
Значения IC50 (концентрация полумаксимального ингибирования) вычисляли с использованием логистической регрессионной модели в онлайн-калькуляторе QuestGraph™IC50 Calculator (AAT bioquest, Inc., США) [20]. Результаты представлены как среднее арифметическое ± стандартное отклонение (M±SD) для трёх независимых серий опыта (n=3).
Оценка апоптоза/некроза
Для анализа форм клеточной гибели применяли двойное окрашивание клеток аннексином V-PE и DAPI. Клетки Н1299 обрабатывали PMSoVn (12,5 µМ) в течение 24 и 72 часов. В контрольные лунки добавляли среду, содержащую ПВП в концентрации, эквивалентной его содержанию в опытных лунках. Клеточную суспензию готовили согласно инструкции к набору реагентов для детекции апоптоза (Кат. № ALAP-100, Nano Entek, Корея). Окрашенные аннексином V-PE/DAPI образцы в объёме 25 мкл помещали на слайд ADAMII и анализировали на флуоресцентном анализаторе ADAMII LS (Nano Entek, Корея). Результаты представлены как среднеарифметическое значение и стандартное отклонение (M±SD) для трёх независимых серий опыта (n=3).
Статистическую обработку полученных данных проводили с использованием пакета программ Microsoft Excel 2016 (Microsoft, США) и Statistiсa 6.0 (StatSoft, Inc). Нормальность распределения оценивали с помощью критерия Шапиро-Уилка. Для множественных сравнений применяли однофакторный ANOVA с апостериорным тестом Даннета относительно контроля, для парных сравнений применяли двусторонний t-критерий Стьюдента. Различия считали статистически значимыми при уровне достоверности 95% (p<0,05).
Результаты исследования и их обсуждение
Соединение PMSoVn не проявляло значимого цитотоксического действия в отношении клеток линии А549 при всех трёх вариантах инкубации. Так, выживаемость клеток после 48 часов культивирования с PMSoVn в концентрациях 11,23 и 22,47 µМ сохранялась на уровне 87,32±15,79% и 87,87±10,74% соответственно. При экспозиции в течение 72 часов максимальное ингибирование роста А549 не превышало 22%. Соответственно значение IC50 не установлено (рис. 2).
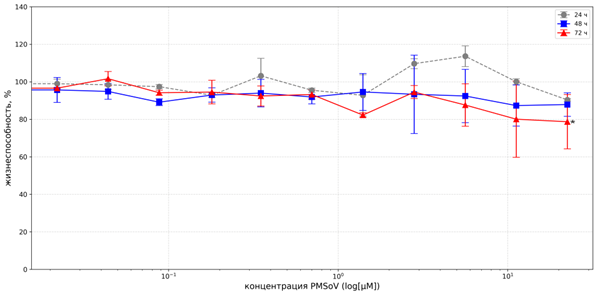
Рис. 2. Цитотоксическое действие PMSoVn на клетки линии А549 в MTT-тесте после инкубации в течение 24, 48 и 72 часов
Примечание: * уровень статистической значимости различий по сравнению с контролем p<0,05. Каждая точка данных представлена как среднеарифметическое значение (M) и стандартное отклонение (±SD).
Источник: составлено авторами на основе полученных данных в ходе исследования.
В отношении линии NCI-H1299 соединение проявляло время- и дозозависимый цитотоксический эффект. Результаты МТТ-теста при 24 часах инкубации продемонстрировали отсутствие 50% торможения роста клеток (рис. 3). Кроме того, на графике наблюдалось увеличение показателя жизнеспособности клеток (в диапазоне доз 0,35-5,62 µМ), что, однако, не имело статистически значимых различий относительно контроля.
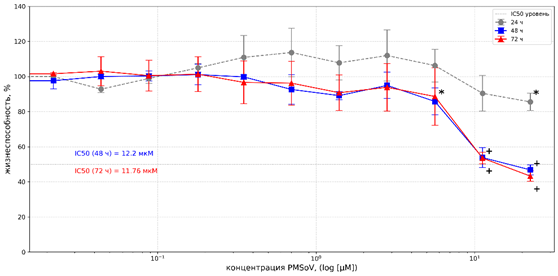
Рис. 3. Цитотоксическое действие PMSoVn на клетки линии NCI-H1299 в MTT-тесте после инкубации в течение 24, 48 и 72 часов
Примечание: * и + уровень статистической значимости различий по сравнению с контролем при p<0,05 и p<0,0001 соответственно. Каждая точка данных представлена как среднеарифметическое значение (M) и стандартное отклонение (±SD).
Источник: составлено авторами на основе полученных данных в ходе исследования.
После 48 часов инкубации жизнеспособность клеток снижалась до 53,81±5,6% и 46,82±2,82% при концентрациях 11,23 и 22,47 µМ соответственно, со значением IC50 в пределах 12,2±3,74 µМ. Увеличение времени экспозиции до 72 часов незначительно повышало эффективность воздействия, снизив значение IC50 до 11,76±2,2 µМ (рис. 3). Отсутствие эффекта при 24 часах экспозиции и значимое снижение жизнеспособности к 48–72 часам свидетельствует о накопительном эффекте действия PMSoVn.
Для оценки гибели клеток культуру H1299 инкубировали с PMSoVn в дозе, близкой к IC50 (12,5 µМ). Эффект PMSoVn через 24 часа инкубации характеризовался снижением количества живых клеток с 92,60% до 77,41% (p<0,01), увеличением в 3 раза уровня некроза (с 4,92% до 14,76%, p<0,01) и раннего апоптоза (с 2,08% до 6,14%, p<0,01), повышением уровня позднего апоптоза более чем в 4 раза (с 0,39% до 1,69%, p<0,01) (табл. 1, рис. 4).
Влияние PMSoVn на гибель клеток линии NCI-Н1299 (M±SD)
|
Параметр |
24 часа |
72 часа |
||
|
Живые (%) |
контроль |
PMSoVn |
контроль |
PMSoVn |
|
92,61±2,27 |
77,41±2,86* |
92,8±11,23 |
49,93±0,92** †† |
|
|
Ранний апоптоз (%) |
2,08±0,88 |
6,14±1,16* |
3,09±1,22 |
11,37±1,13** † |
|
Поздний апоптоз (%) |
0,39±0,36 |
1,69±0,22* |
0,28±0,09 |
3,94±0,87*† |
|
Некроз (%) |
4,92±1,95 |
14,76±1,87* |
3,83±0,88 |
35,37±1,19** †† |
Примечание: данные в таблице представлены как среднеарифметическое значение (M) и стандартное отклонение (±SD). Уровень статистической значимости различий: по сравнению с контролем в те же сроки *p<0,01 и **p<0,001; по сравнению с эффектом PMSoVn через 24 часа † p<0,01 и †† p<0,001.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Через 72 часа доля живых клеток снижалась на 46,2% (р<0,001) по сравнению с контролем (92,8±11,23) и на 35,5% по сравнению с показателем через 24 часа (p<0,01). При этом доля клеток в некрозе увеличивалась в 9 раз (р<0,001) по сравнению с контролем и более чем в два раза относительно показателя при инкубации 24 часа (р<0,01). Ранний апоптоз повышался относительно контроля в 3,7 раза (р<0,001) и инкубации 24 часа (на 85,5%; p<0,01). Поздний апоптоз вырос вдвое по сравнению с 24 часами (р<0,01) и в 14 раз по сравнению с контролем (р<0,001).
Из представленных данных видно, что PMSoVn через24 часа стимулирует все формы клеточной гибели NCI-Н1299. Увеличение продолжительности инкубации до 72 часов усиливает цитотоксическое действие соединения, сокращая долю живых клеток вдвое. При всех вариантах инкубации гибель клеток происходит преимущественно путём некроза, с дополнительной индукцией раннего и позднего апоптоза.
Таким образом, данные МТТ-теста свидетельствуют о различной чувствительности А549 (рис. 2) и NCI-H1299 (рис. 3) к цитотоксическому действию PMSoVn. Для клеток линии NCI-H1299 была установлена умеренная кумулятивная цитотоксичность со значениями IC50 в пределах 12,2±3,74 µМ (48 часов) и 11,76±2,2 µМ (72 часа). Результаты, полученные авторами, согласуются с данными о цитотоксической активности осимертиниба (производное пиримидина) в отношении NCI-H1299 (IC50~10 µМ) [21] и аналогичны результатам оценки цитотоксичности потенциальных ингибиторов EGFR дикого типа на основе пиридо[2,3-d]пиримидин-4(3H)-она, отобранных из ряда соединений, в отношении А549 (IC50 в диапазоне 7,23-16,2 µМ) [22]. Для А549 50% ингибирования роста клеточной популяции в тестируемом диапазоне доз получено не было. Однако для этой линии клеток показатели IC50 стандартных ИТК EGFR могут иметь высокие значения, в частности IC50 гефитиниба может достигать 18,9-32,0 µМ [23-25].
Низкая, по сравнению с NCI-H1299, чувствительность клеток линии А549 к исследуемому соединению может быть обусловлена особенностями её генетического профиля (KRAS G12S), поскольку известно, что наличие мутаций KRAS может влиять на устойчивость к ИТК EGFR [26; 27]. В частности, сообщалось, что у больных аденокарциномой лёгких мутации KRAS (G12X, G13С) ассоциировались с устойчивостью к ИТК EGFR хиназолинового ряда (гефитиниб/эрлотиниб) [28]. В клеточных же линиях НМРЛ (PC-9 и NCI-H1975), чувствительных к осимертинибу, развивалась резистентность к препарату после возникновения мутации KRAS G12V [29]. У мышей линии Balb/c nude ксенографт А549 использовался для моделирования опухоли, устойчивой к гефитинибу [30].
Результаты, полученные на клеточных линиях НМРЛ с различными механизмами резистентности к ИТК EGFR, обосновывают возможность дальнейшего изучения PMSoVn как потенциального ингибитора тирозинкиназы EGFR, на чувствительных к ИТК EGFR иммортализованных клеточных линиях НМРЛ человека, в частности PC-9 (Ex19del E746-A750), H820 (Ex19del E746-E749/T790M), NCI-H1975 (L858R/T790M) и др., а также исследований на первичных культурах клеток рака лёгкого [31].
Заключение
Предварительная оценка нового производного пиримидина-4(1H)-она (PMSoVn) выявила избирательную противоопухолевую активность в отношении клеточной линии НМРЛ NCI-H1299. Клетки линии А549 оказались малочувствительными к соединению. Умеренный цитотоксический эффект PMSoVn проявлялся в дозо- и времязависимом режиме с IC50~12 µМ, сопровождаясь индукцией как некроза, так и апоптоза. Отсутствие значимой активности в отношении А549, вероятно, связано с наличием мутации KRAS, ассоциированной с резистентностью к ингибиторам EGFR. Для установления точных механизмов действия, селективности и выявления направлений структурной оптимизации PMSoVn с целью повышения его эффективности требуются дополнительные исследования.



