Введение. Дисгидротическая экзема (ДЭ), или острая рецидивирующая везикулярная экзема ладоней и подошв – распространенный клинический подтип экземы, характеризующийся появлением на коже ладоней и подошв, латеральной и тыльной поверхности пальцев кистей и стоп везикулярных или буллезных элементов, эритемы, точечных эрозий, серозных корочек и экскориаций, и склонный к длительному и рецидивирующему течению, резистентности к проводимой терапии с риском развития инфекционных осложнений [1, 2]. В последние годы идет дискуссия о необходимости единых подходов к терминологии ДЭ. Большинство авторов предлагают термин «рецидивирующий везикулярный ладонно-подошвенный дерматит (RVPD)», более точно отражающий клинические особенности дерматоза [3–5]. Данные исследований, посвященных распространенности ДЭ в структуре экзематозных поражений кистей и стоп, неоднородны: в них распространенность варьирует от 6,0 до 53,1% [4, 6]. Отсутствуют единые подходы к трактовке этиопатогенеза ДЭ. К провоцирующим факторам, ассоциированным с развитием клинических проявлений ДЭ, относят генетическую предрасположенность, отягощенный личный и семейный анамнез атопических заболеваний, контактную аллергию (преимущественно на металлы), инфекцию, вызванную дерматофитными грибами, прием некоторых лекарственных препаратов [7–9]. Кроме того, значимую роль в патогенезе ДЭ играют воздействие раздражающих кожу веществ, курение, гипергидроз и ультрафиолетовое облучение [2, 7]. Длительные и частые контакты с водой также ассоциированы с возникновением экземы [10, 11]. Немаловажную роль играет нарушение целостности эпидермального барьера [12, 13].
Клинические проявления острой ДЭ характеризуются глубоко расположенными микровезикулами диаметром 1–2 мм, которые в течение 2–3 недель эволюционируют, завершаясь интенсивной десквамацией. В хронической стадии у пациентов можно наблюдать шелушение и трещины [4, 14]. В 80% случаев ДЭ отмечается поражение кожи ладонной поверхности и (или) латеральных поверхностей пальцев кистей [15]. Сочетанное поражение ДЭ кистей и стоп, как правило, связано с более тяжелым течением и длительной историей заболевания [2, 16]. В тяжелых случаях ДЭ может поражать всю ладонную или подошвенную поверхность кистей или стоп [17].
Течение заболевания может приобретать непрерывно рецидивирующий характер, при котором как острая, так и хроническая стадии ДЭ способны существовать одновременно. Везикулярные высыпания сопровождаются зудом различной интенсивности, что приводит к нарушению качества жизни больных ДЭ [6]. При расчесывании повышается риск вторичного инфицирования очагов ДЭ с присоединением бактериальной или микотической инфекции [7, 15]. Воспалительный экссудат, зуд, расчесы и применение топических глюкокортикостероидов (ТГКС) приводят к изменению pH кожи и создают благоприятные условия для колонизации патогенными микроорганизмами и дисбаланса микробной флоры, которые проявляются снижением ее разнообразия [18, 19]. Колонизация кожи патогенными микроорганизмами сопровождается выработкой экзогенных протеаз, усиливающих пролиферацию кератиноцитов с последующим нарушением барьерных свойств кожи и формированием ксероза [20]. В исследованиях продемонстрировано, что длительное применение ТГКС при экземе приводит к нарушению синтеза липидов рогового слоя, препятствуя восстановлению эпидермального барьера, и повышает риск инфекционных осложнений. Так, после двухнедельного применения ТГКС в местах его нанесения обнаруживается повышенная колонизация Staphylococcus aureus [18, 19, 21]. S. aureus диагностируется более чем у 50% всех пациентов с хронической экземой кистей, и его колонизация тесно связана с тяжестью заболевания, однако причинно-следственная связь до сих пор не установлена [22]. S. Mernelius и соавт. (2016) отмечали, что степень колонизации S. аureus кожи у пациентов с экземой кистей выше, чем у здоровых добровольцев. Авторы наблюдали у 60–85% пациентов в очагах экземы одновременное сочетание различных штаммов S. aureus, а плотность колоний статистически значимо коррелировала со степенью тяжести течения заболевания [23]. Суперантигены S. aureus способны усиливать пролиферацию и активность Т-лимфоцитов, что значительно осложняет течение экзематозного процесса и приводит к формированию резистентных к терапии форм [24]. S. aureus относится к группе значимых факторов, вызывающих воспаление и, как следствие, хронизацию экзематозного процесса [21].
При исследовании микробиома кожи пациентов с экземой кистей L.B. Nørreslet и соавт. (2022) выявили преобладание Staphylococcus spp., Corynebacterium.spp., Streptococcus spp. и Micrococcus spp. [25]. Таким образом, микробная сенсибилизация пациентов с экземой в целом может рассматриваться как триггерный и поддерживающий фактор тяжести и длительности течения ДЭ [4, 26].
Цель исследования – выявить особенности колонизации бактериальной микрофлоры в очагах ДЭ у взрослых пациентов
Материалы и методы исследования. Проведено проспективное одноцентровое одномоментное неконтролируемое исследование. В исследование были включены 132 пациента с ДЭ в возрасте от 19 до 78 лет (средний возраст – 33,7±10,3 года): 55 (41,7%) мужчин и 77 (58,3%) женщин, находившихся на амбулаторном лечении и наблюдении в ГБУЗ «Московский Центр дерматовенерологии и косметологии» в период с марта 2022 г. по август 2023 г. Контрольная группа не формировалась. Средняя продолжительность заболевания составляла 3,7±5,3 года.
Клиническое обследование включало сбор анамнестических данных и осмотр кожных покровов с определением степени тяжести, распространенности процесса и наличия клинических признаков вторичной инфекции.
Для бактериологического исследования аэробной и факультативно-анаэробной микрофлоры использовали материал из очагов ДЭ. Посев биоматериала осуществляли на твердые питательные среды в чашках Петри методом «тампон-петля». Чашки Петри инкубировали в течение 5 суток при температуре 35°С. Чистую культуру получали с помощью метода рассева по Гольду. Видовую идентификацию бактерий осуществляли с помощью масс-спектрометрии на анализаторе «Vitek MS» (ВioMerieux, Франция). Степень микробной обсемененности выражали в колониеобразующих единицах (КОЕ)/миллилитр (мл). Всем пациентам было проведено микологическое исследование (микроскопическое и бактериологическое) на патогенные грибы. При положительном результате пациенты в исследование не включались.
Для оценки тяжести течения ДЭ использовали индекс площади поражения и степени тяжести дисгидротической экземы (Dyshidrotic Eczema Areа аnd Severity Index, DАSI). При расчете индекса DАSI учитывали сумму баллов, отражающую степень выраженности и тяжесть клинических проявлений экземы (везикулы, эритема, шелушение, зуд и площадь поражения). Максимальная сумма баллов – 60, где 0–15 – слабая, 16–30 – умеренная и 31–60 – тяжелая степень [27].
Анализ данных проводили с помощью программы Microsoft Excel (версия 2016), для расчетов и построения графиков использовали программу StаtTech версии 4.6.3 (разработчик – ООО «Статтех», Россия). Описательная статистика представлялась в виде анализа структуры выборки по отдельным критериям (в% от общего количества), анализа средних значений полученных результатов ± стандартного отклонения (SD). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна–Уитни, сравнение процентных долей при анализе четырехпольных таблиц сопряженности – с помощью критерия Пирсона (χ2). В качестве количественной меры эффекта при сравнении относительных показателей авторы использовали показатель отношения шансов с 95,0%-ным доверительным интервалом (ОШ; 95% ДИ). Различия считали статистически значимыми при p<0,05.
Проведение исследования согласовано с Комитетом по этике РУДН, Протокол № 2/3 от 11 февраля 2022 г.
Результаты исследования и их обсуждение. Среднее значение индекса DАSI в целом по выборке составило 12,6±7,4 балла. Легкая степень тяжести регистрировалась у 90 (68,2%) пациентов, средняя – у 41 (31,0%), тяжелая степень – у 1 (0,8%) больного ДЭ (табл. 1).
Распределение пациентов с ДЭ по степени тяжести процесса (абсолютные значения, %)
|
Показатель |
Мужчины (n=55) |
Женщины (n=77) |
Всего (n=132) |
|
Легкая степень тяжести |
36 (65,5%) |
54 (70,1%) |
90 (68,2%) |
|
Средняя степень тяжести |
18 (32,7%) |
23 (29,9%) |
41 (31,0%) |
|
Тяжелая степень тяжести |
1 (1,8%) |
– |
1 (0,8%) |
|
Средний балл DАSI (M±m) |
14,1±8,7 |
11,5±6,1 |
12,6±7,4 |
С клиническими проявлениями острого течения ДЭ обратились 60 (45,5%) пациентов. Подострое течение заболевания было диагностировано у 72 (54,5%) пациентов. При сравнительном анализе клинической картины заболевания выявлены статистически значимые различия в числе случаев роста бактериальной микрофлоры при остром и подостром течении ДЭ. При подостром течении ДЭ у пациентов чаще обнаруживалась повышенная колонизация патогенными бактериями (χ2=4,612, p=0,029). Течение заболевания, осложненное вторичным инфицированием, регистрировалось в 2,7 раза чаще при подостром процессе, чем при остром (95% ДИ: 1,087–6,591) (рис. 1).
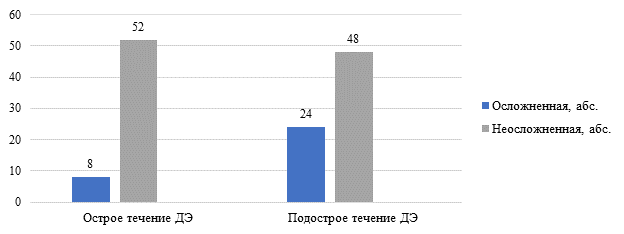
Рис. 1. Распределение частоты случаев клинических проявлений вторичной инфекции в очагах ДЭ при остром и подостром течении
Клиническая картина ДЭ, осложненной вторичной инфекцией, наблюдалась у 32 (24,2%) пациентов. У 100 (75,8%) пациентов заболевание протекало без клинических признаков вторичного инфицирования.
Произведена сравнительная оценка различий в частоте развития бактериальных осложнений у мужчин и женщин с ДЭ. Вероятность развития вторичной инфекции у мужчин была в 1,5 раза выше, чем у женщин (95% ДИ: 1,150–5,871). Выявлены статистически значимые различия в частоте развития осложнений среди мужчин и женщин с ДЭ (χ2=5,450, p=0,020) (рис. 2). При анализе частоты вторичного инфицирования в очагах ДЭ в зависимости от возраста статистически значимых различий не обнаружено (p=0,373, U-критерий Манна–Уитни).
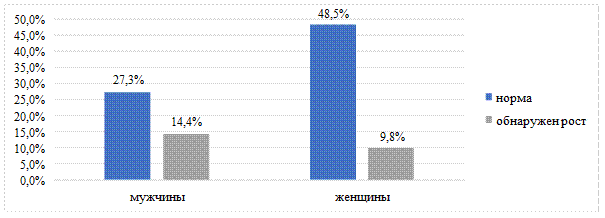
Рис. 2. Частота роста патогенной микрофлоры у больных ДЭ мужского и женского пола (%)
В таблице 2 продемонстрирован анализ связи значения индекса DАSI и частоты лабораторно подтвержденной патогенной бактериальной инфекции в очагах ДЭ (число парных наблюдений n=29, p=0,001 (U-критерий Манна–Уитни)).
Таблица 2
Анализ значений индекса DАSI и частоты выявления вторичной бактериальной инфекции в очагах ДЭ
|
Показатель |
Категории |
DASI |
p |
||
|
Me |
Q₁–Q₃ |
n |
|||
|
Результаты бактериологического исследования |
Обнаружено |
16,00 |
8,00–20,00 |
29 |
<0,001 |
|
Не обнаружено |
10,00 |
7,00–15,00 |
103 |
||
* – различия показателей статистически значимы (p<0,05)
В группе пациентов с характерными проявлениями ДЭ, осложненной вторичным инфицированием (n=32), положительный результат бактериологического исследования был получен у 19 (59,3%) пациентов. В группе больных ДЭ без клинических признаков вторичного (n=100) инфицирования при бактериологическом исследовании рост патогенной микрофлоры отмечался у 10 (10,0%) больных; у остальных пациентов результаты исследования были отрицательными. Различия в анализируемых группах являются достоверными (χ2=6,714, p=0,01).
Рост патогенных микроорганизмов был получен из очагов дисгидротической экземы на коже кистей у 20 (69,0%) пациентов, на коже стоп – у 7 (24,1%) и при сочетанной локализации – у 2 (6,9%). У 9 (31,0%) пациентов с очагов ДЭ был получен рост двух и более культур.
Рост культуры S. аureus был получен у 17 (58,6%) из 29 пациентов, преимущественно с очагов на коже кистей (количество колоний варьировало от 102 до 107 КОЕ/мл). S. aureus обнаруживался в монокультуре у 13 (44,8%) пациентов, в ассоциации с Acinetobаcter spp., Pseudomonas spp. и Streptococcus agаlаctаe – у 5 (17,2%). В очагах ДЭ получен рост колоний S. hаemolyticus, A. ursingii, A. junii, P. putidа, P. oryzihаbitаns у 10 (34,5%) пациентов. Рост колоний S. agаlаctae, A. lwoffi, A. pittii, А. vаriаbilis, M. luteus, M. osloensis, P. histidinolovorans, P. aeruginosа был выявлен у 8 (27,6%) больных ДЭ (табл. 3).
Таблица 3
Результаты бактериологического исследования в очагах дисгидротической экземы
|
Наименование культуры |
ДЭ кистей |
ДЭ |
ДЭ |
Итого |
КОЭ/мл |
|
Staphylococcus aureus |
12 (9,1%) |
4 (3%) |
1 (0,8%) |
17 (12,8%) |
102–107 |
|
Staphylococcus haemolyticus |
1 (0,8%) |
1 (0,8%) |
0 |
2 (1,5%) |
103–106 |
|
Streptococcus agalactae |
0 |
1 (0,8%) |
0 |
1 (0,8%) |
104 |
|
Acinetobacter ursingii |
1 (0,8%) |
1 (0,8%) |
0 |
2 (1,5%) |
103–105 |
|
Acinetobacter junii |
2 (1,5%) |
0 |
0 |
2 (1,5%) |
105 |
|
Acinetobacter lwoffi |
1 (0,8%) |
0 |
0 |
1 (0,8%) |
106 |
|
Acinetobacter pittii |
0 |
1 (0,8%) |
0 |
1 (0,8%) |
106 |
|
Acinetobacter variabilis |
0 |
0 |
1 (0,8%) |
1 (0,8%) |
106 |
|
Micrococcus luteus |
1 (0,8%) |
0 |
0 |
1 (0,8%) |
102 |
|
Moraxella osloensis |
1 (0,8%) |
0 |
0 |
1 (0,8%) |
107 |
|
Paenarthrobacter histidinolovorans |
1 (0,8%) |
0 |
0 |
1 (0,8%) |
103 |
|
Pseudomonas putida |
1 (0,8%) |
1 (0,8%) |
0 |
2 (1,5%) |
104 |
|
Pseudomonas oryzihabitans |
1 (0,8%) |
1 (0,8%) |
0 |
2 (1,5%) |
105–107 |
|
Pseudomonas aeruginosa |
0 |
1 (0,8%) |
0 |
1 (0,8%) |
106 |
По данным исследования, течение ДЭ осложнялось присоединением вторичной бактериальной инфекции в 24,2% случаев (т.е. почти у каждого пятого пациента). В зарубежных руководствах по лечению экземы уделяется большое внимание микробному фактору не только как усугубляющему течение, но и как провоцирующему развитие патологического процесса [5, 22]. Следовательно, бактериологический контроль у больных ДЭ с локализацией в области кистей и стоп является особенно актуальным.
В исследовании продемонстрировано, что от характера течения ДЭ зависит микробный пейзаж очагов. При подостром течении ДЭ у пациентов чаще обнаруживалась повышенная колонизация патогенными бактериями (p=0,029). Выявлена прямая связь значения индекса степени тяжести дисгидротической экземы (DАSI) и частоты лабораторно подтвержденной патогенной бактериальной инфекции в очагах ДЭ (p=0,001).
Результаты анализа показали, что у мужчин с ДЭ риск развития вторичной инфекции в 1,5 раза выше, чем у женщин (p=0,020). Исследование китайских авторов X. Wаng и соавторов продемонстрировало схожие результаты [28].
Положительные результаты бактериологического исследования получали из очагов ДЭ на коже кистей в 2,9 раза чаще, чем из очагов на коже стоп. Среди патогенов наиболее часто диагностировался S. aureus (58,6%). По данным результатов зарубежных исследований, S. aureus также преобладал в очагах экземы, в связи с чем обсуждалась его роль в развитии тяжелого течения экземы [22, 23]. Помимо S. aureus, в очагах ДЭ у обследованных пациентов отмечалось широкое видовое разнообразие бактериальной грамположительной и грамотрицательной флоры.
Ограничением данного исследования можно считать недостаточную выборку групп пациентов с тяжелыми формами ДЭ и клинической картиной хронически протекающей ДЭ ввиду сложности клинической диагностики хронической стадии ДЭ, при которой наряду с длительно существующими очагами с десквамацией может наблюдаться возникновение новых везикул.
Заключение
Изучение клинико-лабораторных особенностей необходимо для углубленного понимания сущности патогенеза и разработки тактики лечения ДЭ. Существует необходимость дальнейшего изучения провоцирующих факторов, в том числе инфекционных, в рецидивирующем течении заболевания. В данном исследовании продемонстрирована статистически значимая связь частоты бактериальной колонизации и тяжести кожного процесса, что еще раз подчеркивает важность разработки алгоритма противовоспалительной и персонифицированной терапии данного хронического заболевания.



