Рак яичников (РЯ) занимает 7-е место по уровню заболеваемости и 8-е место по уровню смертности среди онкологических заболеваний женского населения в мире. Ежегодно регистрируется 225 500 новых случаев РЯ и 140 200 случаев смерти от данного онкологического заболевания [1]. В структуре онкологических заболеваний среди женского населения Российской Федерации РЯ занимает 9-е место, что соответствовало 4,2% в 2021 году. Показатель заболеваемости РЯ в России в 2021 году составил 17,05 на 100 тыс. женского населения. Прирост показателя заболеваемости за предшествующие 10 лет составил 2,9% [2, с. 4–16].
Ранняя диагностика и последующее своевременно оказанное лечение являются одной из самых сложных и при этом чрезвычайно актуальной задачей российской и мировой онкогинекологии. РЯ включает в себя гетерогенные группы заболеваний с несколькими различными подтипами. Среди них серозная карцинома представляется наиболее распространенным подтипом и составляет более 45% случаев злокачественных опухолей яичников. Выявление однородных групп в общей популяции является одним из возможных подходов к установлению причин, которые служат препятствием для разработки методов диагностики и лечения [3].
Диагностика РЯ включает в себя проведение клинического осмотра, применение лучевых методов визуализации и использование иммунологических методов определения уровня опухолевых маркеров. УЗИ является ведущим методом диагностики новообразований в малом тазу. Этот метод обладает высокой разрешающей способностью и позволяет установить локализацию, размеры и характер новообразования. Информативность УЗИ составляет 87%. Наряду с УЗИ одним из ведущих методов лучевой диагностики является рентгеновская компьютерная и магнитно-резонансная томография [4].
Как правило, рекомендуется выполнить исследование уровня опухолевого антигена (СА-125) и секреторного белка 4 эпидидимиса человека (НЕ-4). Однако F. Jacob et al. показали, что чувствительность диагностики при совместном применении двух тестов составляет 80%, а специфичность – 85,4% [5].
Прижизненное патологоанатомическое исследование является решающим методом в установлении диагноза заболевания, выборе тактики лечения, а также диагностике возможного рецидива. Однако получение биологического материала для выполнения гистологического исследования как наиболее точного метода морфологической верификации часто требует проведения хирургического вмешательства (лапароскопии, лапаротомии, биопсии) [6].
Негативный прогноз течения заболевания и, как следствие, низкий уровень выживаемости стимулируют интерес к использованию современных методических подходов молекулярной биологии. Современные биомедицинские исследования характеризуются использованием технологических платформ, описывающих свойства биологического объекта на уровне генома, транскриптома, протеома и метаболома. Метаболом представляет собой совокупность низкомолекулярных метаболитов (<1500 Да) биологического образца, являясь уникальным биохимическим «отпечатком», отражающим протекающие в организме биохимические процессы [7].
Метаболомика позволяет выявить единичные специфические молекулы или их комбинации, которые в дальнейшем можно применять в диагностике заболевания. Для диагностики онкологических заболеваний такими соединениями являются онкометаболиты – соединения, концентрация которых заметно увеличивается в опухолях или биологических жидкостях. Ключевой особенностью данной группы веществ является существование четкого механизма, связывающего специфические характеристики опухоли с накоплением метаболита и его участием в развитии злокачественных новообразований. Онкометаболиты играют ключевую роль в неопластической трансформации, опухолевом метаболизме, агрессивности и терапевтической резистентности [7].
Таким образом, крайне актуальным в настоящее время является поиск онкомаркера или комбинации онкомаркеров с высокой чувствительностью, специфичностью и прогностической значимостью, определяемых в легкодоступном биологическом материале (плазме, сыворотке крови или моче). В связи с этим цель исследования заключалась в выявлении и идентификации в плазме крови пациенток с серозной карциномой яичников диагностически значимых для этого заболевания изменений метаболитов.
Материалы и методы исследования
Для выполнения метаболомного анализа были отобраны 30 проб плазмы крови пациентов с гистологически верифицированным РЯ (серозная карцинома яичников), средний возраст составил 46,1±7,6 года, и 15 проб здоровых добровольцев со средним возрастом 45,1±7,9 года. В каждом случае было получено добровольное информированное согласие. Мета/синхронный рак, мутация в BRCA1/2, коморбидная патология, беременность, возраст более 65 лет являлись критериями исключения из исследования.
Кровь отбирали в 8:00 натощак в пробирки с K2EDTA в качестве антикоагулянта (BD Vacutainer, США). Не позднее чем через 20 мин после выполнения процедуры забора кровь центрифугировали при комнатной температуре в течение 10 мин 1800 g. Для удаления остаточных форменных элементов крови проводили дополнительное центрифугирование 10 мин 16000 g при 4°C. Полученную плазму крови аликвотировали по 1 мл в криопробирки. Хранение образцов до проведения анализа осуществляли при температуре –75°С.
Для проведения депротеинизации 300 мкл плазмы крови смешивали с 900 мкл ацетонитрила LC-MS (Merck, Германия) и метанола LC-MS (Merck, Германия) в соотношении 3:1. Далее перемешивали с использованием вортекса и инкубировали 12 ч при температуре –20°С. Затем проводили центрифугирование при 16000 g 4°C (5430R, Eppendorf, Германия) в течение 15 мин. Надосадочную жидкость переносили в пластиковые пробирки объемом 1,5 мл типа эппендорф и выпаривали их содержимое с применением SpeedVac (Eppendorf, Германия). Сухой осадок растворяли в смеси ацетонитрила LC-MS (Merck, Германия) и воды 1:3 с 0,1%-ной муравьиной кислотой (Merck, Германия).
Хроматографическое разделение проводили на VanquishFlex UHPLC System (ThermoScientific, Германия). Масс-спектрометрический анализ выполняли на Orbitrap Exploris 480 (ThermoScientific, Германия).
Хроматографическое разделение проводили на колонке Hypersil GOLD™ C18 (1,9 мкм, 10х2,1 мм), используя следующие элюенты: А – 0,1%-ная муравьиная кислота, B – ацетонитрил, содержащий 0,1% муравьиной кислоты. Температура автосэмплера составляла 4°C. Использовали следующий градиент элюции: 0–1 мин – 5% В, 1–5 мин – линейный градиент B с 5 до 25%, 5–7 мин –25–55% B, 7–13 мин –55–95% B, 13–14 мин – 95% B, 0,5 мин – смена состава до 5% B, 1 мин – 5% B. Температура колонки поддерживалась равной 40°C. Поток элюентов составлял 250 мкл/мин. Масс-спектры получали в диапазоне отношения массы к заряду 80–800. Для идентификации метаболитов использовали МС/МС данные пулированного образца плазмы крови. Анализ данных проводили с использованием программного обеспечения Compound Discoverer Software (ThermoFisher Scientific, США). Статистический анализ данных проводили с использованием Prism 10 - GraphPad (США).
Результаты исследования и их обсуждение
Известно, что изменения уровня метаболитов способствуют прогрессии опухоли путем реализации различных механизмов, таких как гликолиз, снижение окислительного фосфорилирования и повышенное образование промежуточных продуктов обмена веществ [7]. Обнаружение механизма метаболической трансформации может дать возможность диагностировать опухоль или даже остановить ее прогрессирование путем блокирования модифицированных биохимических путей.
В настоящем исследовании показана возможность идентификации различий метаболома плазмы крови пациентов с серозной карциномой яичников и здоровых волонтеров с помощью метода УВЭЖХ-МС. Суммарно было идентифицировано 1049 метаболитов различных классов. Показано, что у пациентов с серозной карциномой яичников 8 метаболитов имели значимо более низкую концентрацию по сравнению с условно здоровыми добровольцами, содержание 19 соединений, наоборот, повышалось. Были выявлены изменения в метаболизме липидов (эйкозадиеновая кислота, лизофосфатидилхолин (20:4), лизофосфатидилхолин (18:2), лизофосфатидилхолин (15:0), лизофосфатидилхолин (20:3), лизофосфатидилэтаноламин (18:3), лизофосфатидилхолин (22:5/0:0), фосфатидилхолин (18:2/0:0), фосфатидилхолин (14:0/22:4),3-гидроксиоктаноилкарнитин, L-октаноилкарнитин, 2-гидроксилауроилкарнитин, О-деканоил-L-карнитин); желчных кислот (3-гидрокси-5-холеновая кислота, гликурдезоксихолевая кислота); аминокислот и их производных (L-гомоцистеин, L-триптофан, 3-индолпропионовая кислота, кинуренин), L-тироксин, L-фенилаланин, гиппуровая кислота,глутамил-треонин, L-гомоцитруллин, b-аминоизомасляная кислота); азотистых оснований и их производных (гипоксантин, 3-метилуридин) (табл., рис.).
Изменение метаболома плазмы крови пациентов с серозной карциномой яичников относительно здоровых добровольцев
|
Соединение |
Log10P-value |
Log2FoldChange |
|
эйкозадиеновая кислота |
2,6882 |
0,9325 |
|
лизофосфатидилхолин (20:4) |
2,0162 |
1,0369 |
|
лизофосфатидилхолин (18:2) |
2,5034 |
1,1065 |
|
лизофосфатидилхолин (15:0) |
2,9066 |
0,8542 |
|
лизофосфатидилхолин (20:3) |
2,4866 |
0,8107 |
|
лизофосфатидилэтаноламин (18:3) |
2,0498 |
0,7846 |
|
лизофосфатидилхолин (22:5/0:0) |
2,0498 |
0,628 |
|
фосфатидилхолин (18:2/0:0) |
2,0666 |
-0,5291 |
|
фосфатидилхолин (14:0/22:4) |
2,0666 |
0,6454 |
|
3-гидроксиоктаноилкарнитин |
2,0834 |
-0,851 |
|
3-гидрокси-5-холеновая кислота |
2,1002 |
1,1065 |
|
гликурдезоксихолевая кислота |
2,033 |
-0,938 |
|
L-гомоцистеин |
2,033 |
0,8977 |
|
3-индолпропионовая кислота |
2,915 |
1,15 |
|
кинуренин |
2,0498 |
0,9586 |
|
L-триптофан |
2,4698 |
-1,1033 |
|
L-тироксин |
2,0666 |
0,7063 |
|
L-фенилаланин |
2,0834 |
1,0369 |
|
гиппуровая кислота |
2,3186 |
-0,9119 |
|
глутамил-треонин |
2,1506 |
0,6715 |
|
L-гомоцитруллин |
2,2682 |
0,9847 |
|
b-аминоизомасляная кислота |
2,537 |
0,8281 |
|
гипоксантин |
2,033 |
0,7498 |
|
3-метилуридин |
2,2178 |
0,9499 |
|
L-октаноилкарнитин, |
2,6042 |
-1,3817 |
|
2-гидроксилауроилкарнитин |
2,1674 |
-1,2338 |
|
О-деканоил-L-карнитин |
3,0746 |
-1,0337 |
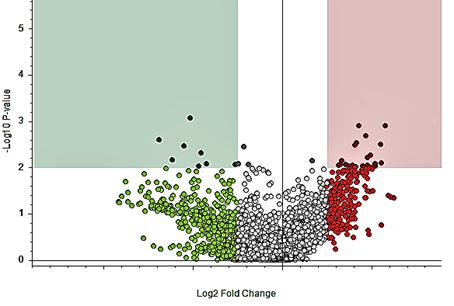 |
Изменение метаболома плазмы крови пациентов с серозной карциномой яичников относительно здоровых добровольцев. 8 соединений (зеленый цвет) имели значимо более низкую концентрацию по сравнению со здоровыми добровольцами, содержание 19 (красный цвет) соединений повышалось
Триптофан и его метаболиты играют ключевую роль в различных физиологических процессах. Концентрация нескольких метаболитов, участвующих в метаболизме L-триптофана, отличалась у пациентов с серозной карциномой яичников по сравнению с контрольной группой. В частности, выявленное снижение содержания L-триптофана у пациентов с серозной карциномой яичников, вероятно, связано с его деградацией, катализируемой индоламин-(2,3)-диоксигеназой, о чем свидетельствует увеличение уровня кинуренина. Возможно, измененный метаболизм L-триптофана обеспечивает метаболическую микросреду, благоприятную для роста опухоли [8].
У пациентов с серозной карциномой яичников наблюдались сниженный уровень гиппуровой кислоты (бактериальный продукт метаболизма фенилаланина) и повышенный – фенилаланина. Возрастание концентрации фенилаланина в крови характерно для больных ВИЧ-инфекцией, при травмах, сепсисе, а также у больных раком. Zhang и коллеги продемонстрировали, что у пациентов с раком пищевода повышен уровень фенилаланина в сыворотке крови по сравнению с контрольной группой [9].
В настоящей работе показано повышение содержания лизофосфатидилхолина (20:4), лизофосфатидилхолина (18:2), лизофосфатидилхолина (15:0), лизофосфатидилхолина (20:3), лизофосфатидилэтаноламина (18:3), лизофосфатидилхолина (22:5/0:0), фосфатидилхолина (14:0/22:4) в плазме крови пациенток с серозной карциномой яичников относительно значений контрольной группы. Уровень фосфатидилхолина (18:2/0:0), наоборот, снижался. Содержание лизофосфатидилхолинов в крови больных варьирует в зависимости от типа рака, при этом их концентрация снижена при раке молочной железы и повышена при гепатоцеллюлярной карциноме. Ранее было показано, что уровень лизофосфатидилхолина (16:0) коррелирует со стадией опухолевого процесса у пациентов с РЯ [10].
Другой широко представленной группой липидов, изменение содержания которых было обнаружено в настоящей работе, были ацилкарнитины. У пациентов с серозной карциномой яичников в плазме крови было выявлено снижение содержания гидроксиоктаноилкарнитина, L-октаноилкарнитина, 2-гидроксилауроилкарнитина и О-деканоил-L-карнитина. Эти результаты согласуются с исследованием, предполагающим, что карнитиновая система играет ключевую роль в метаболической гибкости раковых клеток. Ранее было показано, что уровень L-октаноилкарнитина в плазме был значительно ниже у пациентов с раком молочной железы по сравнению с контрольной группой, что свидетельствует о высокой потребности в карнитине для метаболизма опухоли [11].
Также следует отметить повышение содержания эйкозадиеновой кислоты в плазме крови пациентов с серозной карциномой яичников по сравнению со здоровыми волонтерами. Эйкозадиеновая кислота снижает продукцию оксида азота, увеличивает образование простагландина Е2 и фактора некроза опухоли альфа. Изменение содержания эйкозадиеновой кислоты ассоциировано с развитием злокачественного процесса. В частности, ее повышение характерно для глиальных опухолей низкой степени злокачественности [12].
В настоящей работе были выявлены повышение содержания 3-бета-гидрокси-5-холеновой кислоты и снижение гликурсодезоксихолевой кислоты в плазме кров пациентов с серозной карциномой яичников по сравнению с контрольными значениями. 3-бета-гидрокси-5-холеновая кислота относится к моногидроксижелчным кислотам, содержащим гидроксильную группу. Гликурсодезоксихолевая кислота представляет собой ацилглицин, конъюгат желчной кислоты с глицином. Это вторичная желчная кислота, вырабатываемая под действием ферментов, источником которых является микробная флора толстой кишки. Первичные и вторичные желчные кислоты являются известными участниками канцерогенеза. Изменения в пуле желчных кислот настолько характерны, что Guan с коллегами предложили [13] набор из 12 желчных кислот для использования в качестве маркеров, позволяющих отделить здоровых добровольцев от больных РЯ.
При анализе изменения содержания нуклеотидов следует отметить повышение уровня гипоксантина у пациентов с серозной карциномой яичников. Результаты, полученные авторами, согласуются с данными J.H. Lee et al., которые показали, что уровень гипоксантина возрастал в злокачественных опухолях яичников относительно образцов доброкачественных опухолей и физиологически не измененной ткани. Результаты подтверждают предположение о том, что высокие уровни гипоксантина в сыворотке могут свидетельствовать о РЯ [14].
Следует отметить, что среди идентифицированных соединений гликурсодезоксихолевая и гиппуровая кислоты являются метаболитами, связанными с кишечными бактериями [15]. Возможно, изменение содержания данных метаболитов связано с нарушениями микробиома кишечника у пациентов с серозной карциномой яичников.
Заключение
Таким образом, в плазме крови пациентов с серозной карциномой яичников установлено изменение содержания липидов (эйкозадиеновая кислота, лизофосфатидилхолин (20:4), лизофосфатидилхолин (18:2), лизофосфатидилхолин (15:0), лизофосфатидилхолин (20:3), лизофосфатидилэтаноламин (18:3), лизофосфатидилхолин (22:5/0:0), фосфатидилхолин (18:2/0:0), фосфатидилхолин (14:0/22:4), 3-гидроксиоктаноилкарнитин, L-октаноилкарнитин, 2-гидроксилауроилкарнитин, О-деканоил-L-карнитин), желчных кислот (3-гидрокси-5-холеновая кислота, гликурдезоксихолевая кислота), аминокислот и их производных (L-гомоцистеин, L-триптофан, 3-индолпропионовая кислота, кинуренин, L-тироксин, L-фенилаланин, гиппуровая кислота, глутамил-треонин, L-гомоцитруллин, b-аминоизомасляная кислота), азотистых оснований и их производных (гипоксантин, 3-метилуридин). Выявленные изменения метаболома могут предоставить информацию для устранения пробелов в понимании механизмов, участвующих в прогрессировании серозной карциномы яичников, и стать основой для совершенствования подходов диагностики.



