Оксид азота II (NO) является участником широкого спектра физиологических и патофизиологических процессов. NO регулирует тонус и проницаемость сосудов, тонус гладких мышц внутренних органов, процессы воспаления и иммунной защиты. Являясь активным участником свободно-радикальных процессов, приводит к генерации высокоагрессивных соединений, таких как пероксинитрит, гидроксильные радикалы, инициирует ПОЛ и др. Оксид азота вовлечен в патогенез большинства социально значимых воспалительных заболеваний легких, а также может служить биологическим маркером течения воспаления в респираторном тракте [1-3].
NO синтезируются NO-синтазами (NOSs), представляющими собой цитохром Р-450 подобные гемопротеины, которые окисляют L-аргинин (Arg) в двухстадийном процессе, требующем целого ряда кофакторов: никотинамидадениндинуклеотидфосфат (NADPH), флавинадениндинуклеотид (FAD), флавинмононуклеотид (FMN), тетрагидроптерин, кальмодулин и т.д. Промежуточной фазой синтеза является продукция L-гидроксиаргинина (NOHA) [4; 5].
Принято выделять три изоформы NO-синтаз, которые кодируются разными генами и отличаются субклеточной локализацией, особенностями активации и ингибирования, уровнем синтеза оксида азота [6]. Но, несмотря на многочисленные различия, можно выделить общие для всех NO-синтаз домены, кофакторы и субстратсвязывающие центры [7; 8]. Это делает возможным создание универсальной имитационной модели функционирования NO-синтаз, которую затем можно будет адаптировать к различным изоформам.
Подобное моделирование необходимо для лучшего понимания активности NOSs, как сложных систем с довольно большим набором значимых параметров, многоуровневыми причинно-следственными связями между ними и нетривиальными алгоритмами функционирования.
Целью настоящей работы является формирование базовой структурной схемы универсальной модели каталитического цикла NOS, применимой ко всем основным изоформам NOS.
Материалы и методы исследования
Для моделирования была использована структурная схема функционирования NO-синтаз в установившемся режиме, составленная на основе литературных данных.
Все три изомера NO-синтаз являются димерными двухдоменными ферментами, которые содержат протопорфирин железа IX, FAD, (FMN) и тетрагидробиоптерин (BH4) в качестве простетических связывающих групп [6].
Изоформы NOS кодируются разными генами и отличаются распределением в клетках, особенностями активации и ингибирования, уровнем синтеза оксида азота [6].
NOS-1 - нейрональная (nNOS) или мозговая (bNOS), кальций-зависимая;
NOS-3 - эндотелиальная (eNOS), кальций-зависимая;
NOS-2 - индуцибельная (iNOS) или макрофагальная (mNOS), кальций-независимая.
NOS-1 и NOS-3 являются конститутивными (cNOS), постоянно находятся в цитоплазме (то есть являются ингредиентными), зависят от концентрации кальция и кальмодулина, а также способствуют выделению небольшого количества NO на короткий период в ответ на рецепторную физиологическую стимуляцию. cNOS существенно инактивируется при низких концентрациях свободного кальция и максимально активен при его содержании около 1 мМ. NO, образующийся под влиянием cNOS, действует как переносчик в ряде физиологических ответов [9].
NOS-2 впервые была выделена из макрофагов и относится к индуцибельной изоформе NO-синтазы (iNOS). Этот фермент, в противоположность конститутивным ферментам, менее зависим от ионов Са2+ или кальмодулина [9].
По особенностям активации, уровню генерации NO описанные изоформы подразделяют на две группы:
- конститутивные (cNOS - nNOS и eNOS);
- индуцибельные (iNOS – iNOS).
сNOS (nNOS и eNOS) являются кальций-зависимыми, способствуют выделению небольшого количества NO (пикомоли) в ответ на рецепторную стимуляцию.
eNOS - мембранно-связанная, локализуется в больших количествах в эндотелии, и в частности в тромбоцитах, интерглобулярной, афферентной и эфферентной артериолах, а также в гломерулах, мезангиальных клетках и др. [9].
nNOS – цитозольная, находится в нейронах, эндотелиальных клетках, в том числе эндотелии эфферентной артериолы почек, в тромбоцитах, в мозговом слое надпочечников, скелетных мышцах и т.д. [9].
iNOS обычно не определяется в клетках, находящихся в покое, но ее экспрессия индуцируется в ответ на стимуляцию провоспалительными цитокинами, оксидативным стрессом и др. iNOS может генерировать большие количества NO в течение длительного времени, если субстрат и кофакторы не ограниченны [9].
Исходные данные для структурной схемы модели
Для всех изоформ NO-синтаз характерна следующая схема доменов и связывающих центров, показанная на рис. 1 [8].
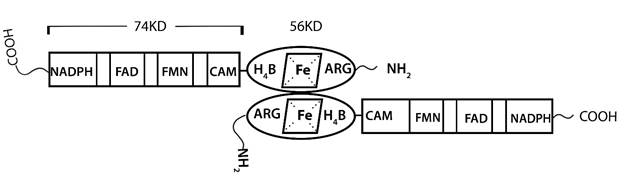
Рис. 1. Структурная модель NOS [8]
Редуктазный домен молекулярной массой 74 кДа присоединен к димеру оксигеназного домена массой 112 кДа в сердцевине. Оксигеназный домен содержит связывающие центры для L-аргинина (Arg), тетрагидробиоптерина (BH4) и гема (Fe). Редуктазные домены пептида содержат FAD, FMN, NADPH. Кальмодулин-связывающая последовательность (CAM) находится между FMN и CAM.
Общие структурные элементы, изученные к настоящему моменту, включают белковый линкер, соединяющий домены FAD и FMN, поверхностно заряженные остатки на доменах FAD, FMN и NOSoxy и петлю рядом со связанным FMN, которая помогает его стабилизировать [4].
Уникальные регуляторные элементы, присутствующие в NO-синтазах, включают С-концевой хвост (CT), характерный для всех изоформ NOS млекопитающих, аутоингибиторную вставку (AI), расположенную в FMN-доменах eNOS и nNOS, но отсутствующую в iNOS [4]. По указанным регуляторным элементам пока недостаточно исследований, позволяющих формализовать алгоритмы их функционирования, поэтому для целей нашего моделирования они не включаются в структурную схему.
Роль кальмодулина и Ca2+ в синтезе NO
NO-синтазы представляют собой редкий пример, когда перенос электронов в окислительно-восстановительном ферменте контролируется Ca2+-связывающим белком кальмодулином (СаМ). Связывание CaM, управляемое Ca2+, играет ключевую роль, снимая репрессию на трех критических этапах переноса электронов в каталитическом пути NO-синтазы, а именно переносы электронов между NADPH и FAD, FAD и FMN, а также FMN и гемом.
На сегодняшний момент известно, что взаимодействие CaM с NOS представляет собой поэтапный процесс: два иона Ca2+ сначала связываются с центрами кальмодулина с более высокой аффинностью. Это позволяет CaM связываться с NOS и ослаблять репрессию на этапах переноса электрона NOS в редуктазном домене (от NADPH в FAD, от FAD в FMN), а также инициировать промежуточные конформационные изменения. Но этого недостаточно для запуска переноса электронов от FMN в гем. Для указанного шага требуется, чтобы еще два дополнительных иона Ca2+ связались с СаМ и заполнили все четыре центра CaM [4].
Имеющиеся данные свидетельствуют о том, что редуктазный домен существует как динамическая система открытых и закрытых конформаций во всех ее физиологически значимых состояниях (т.е. от одно- до четырехэлектронного восстановленного). Связывание CaM не изменяет относительную термодинамику реакций переноса электронов между FMN и FAD, или между FMN и гемом, а также не преобразует закрытое конформационное состояние в открытое. При этом выявлены по крайней мере четыре способа, посредством которых связывание CaM обеспечивает перенос электрона в NOS и катализ [4]:
- СаМ сдвигает конформационное равновесие редуктазного домена в сторону более открытых конформаций, которые должны связаться с Са2+, чтобы FMN мог перенести электрон на оксидазный домен NOS;
- CaM сокращает время жизни любой конформации, ускоряя переходы между ними и поток электронов через редуктазный домен;
- CaM сужает стереометрическое распределение конформаций;
- CaM помогает ограничивать и направлять перемещения домена FMN в пространстве. Это, вероятно, связано с тем, что CaM формирует временные ионные и гидрофобные взаимодействия с поверхностью оксидазного домена NOS, которые в конечном итоге помогают направить стыковку домена FMN. Также предполагается, что CaM устраняет физический блок стыковки FMN с помощью регуляторного элемента AI.
Таким образом, связывание кальмодулином ионов Са2+ является триггером переноса электронов в гем, а также увеличивает и ускоряет электронный поток. При этом iNOS, в отличие от двух других изоформ, является Са2+ независимой. Соответственно, для целей нашего моделирования целесообразно рассматривать комплекс СаМ – ионы Са2+ целиком, в контексте наличия или отсутствия дефицита Са2+, то есть вводить его в модель как долю насыщения кальмодулина ионами Ca2+, не описывая по отдельности оба этапа связывания.
Особенности формирования конечных продуктов катализа NOS
Согласно актуальным данным, непосредственным продуктом катализа NOS является комплекс гем – FeIII-NO, а не свободный NO. Дело в том, что все изоформы NOS связывают свой собственный NO, прежде чем высвобождать его. Гем NOS связан внутри защищенного кармана фермента, который ограничивает проникновение и выход соединений с низкой молекулярной массой. Это приводит к тому, что новообразованный NO задерживается в кармане гема, связываясь и высвобождаясь много раз, прежде чем выйти из фермента в раствор. Чем дольше комплекс гем – FeIII-NO сохраняется в NOS, тем более вероятно, что он будет восстановлен электроном из редуктазного домена, с образованием комплекса гем – FeII-NO, который высвобождает NO очень медленно и фактически является «отравленной» NO формой NOS [4]. Как только во время катализа NOS образуется комплекс гем-FeIII-NO, он или восстанавливается, или высвобождает NO. Коэффициент распределения между этими двумя путями определяется соотношением скоростей выхода NO из ферментного кармана гема и восстановления гема редуктазным доменом. Путь, когда NO высвобождается из фермента, - продуктивный, потому что NOS возвращается в свою трехвалентную форму и готова начать новый цикл катализа. Напротив, путь, в котором комплекс гем-FeIII-NO восстанавливается до гем-FeII-NO, является в некотором роде бесполезным, поскольку прямое высвобождение NO из комплекса гем-FeII-NO протекает крайне медленно и в результате подавляющая часть гем-FeII-NO дополнительно окисляется до нитрата с целью регенерировать NOS в трехвалентной форме [4].
Продуктивный и непродуктивный пути в каталитическом цикле NOS
В каталитическом цикле NOS можно выделить два пути, условно названные «продуктивный» и «непродуктивный». Если NO успевает высвободиться из комплекса гем-FeIII-NO и выйти из кармана фермента, то цель цикла достигается, а NOS готова к следующему циклу. Если же NO не успевает выйти из кармана фермента и повторно связывается с гем-FeIII до прихода следующего электрона, то гем-FeIII-NO восстанавливается до гем-FeII-NO, который может реагировать с O2, образуя нитрат и гем-FeIII, или крайне медленно напрямую высвобождать NO, как показано на рис. 2 [5].
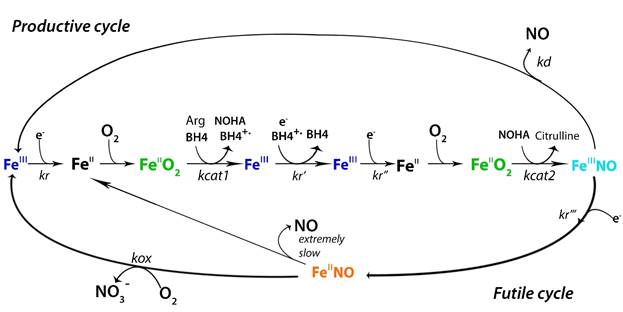
Рис. 2. Продуктивная и непродуктивная ветви каталитического цикла NOS [5]
Восстановление гема трехвалентного железа является лимитирующей стадией реакций биосинтеза NO (центральная линейная часть). Этот перенос электрона необходим для восстановления гем-FeIII перед каждой каталитической стадией, а также для восстановления радикала BH4 между реакциями окисления Arg и NOHA. Комплекс гем-FeIII-NO может либо высвобождать NO в рамках продуктивного цикла, либо восстанавливаться редуктазным доменом до комплекса гем-FeII-NO, который реагирует с O2, как часть непродуктивного цикла для образования нитрата и гема трехвалентного железа.
В непродуктивном цикле кислород непосредственно взаимодействует с комплексом гем-FeII-NO. Необходимо отметить, что величина и характер зависимости скорости этой реакции от концентрации О2 сильно отличаются между изоформами NOS. Мало того, они сильно отличаются от величины и характера зависимости скорости взаимодействия О2 с гем-FeII в основной цепочке синтеза NO [4]. Поэтому зависимость активности NOS от концентрации O2 носит сложный характер, поскольку является фактически композицией двух разных типов зависимости.
Роль тетрагидробиоптерина (BH4) в каталитическом цикле NOS
Для того чтобы NOS могла провести второй цикл активации кислорода, необходимый для окисления NOHA, необходимо быстрое восстановление радикала BH4 после гидроксилирования аргинина. Было показано, что источником электрона в данном случае является редуктазный домен NOS, а стадия восстановления BH4 зависит от СаМ [4; 5].
В последующих исследованиях было сделано предположение, что флавопротеиновый домен NOS пропускает электрон через гем для достижения связанного с ним радикала BH4 (рис. 3). Это, на первый взгляд, разрешало физическое противоречие, состоящее в том, что кофактор BH4 расположен слишком далеко от поверхности оксигеназного домена NOS, чтобы обеспечить прямой перенос электронов из FMN в редуктазный домен, даже когда FMN стыкуется с оксигеназным доменом. Предполагается, что гем может обрабатывать электрон, полученный от редуктазного домена, двумя способами: для связывания кислорода с гемом и образования комплекса гем-FeII-O2, и для восстановления связанного радикала BH4 [4].
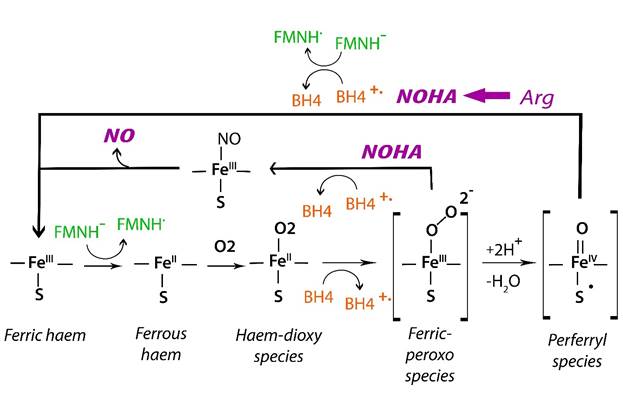
Рис. 3. Роль BH4 в активации комплекса гем-FeII-O2 [4]
Катализ начинается с восстановления гем-FeIII электроном из редуктазного домена (FMNH). Это позволяет гему связывать O2 и образовывать гем-FeII-O2, который затем восстанавливается с помощью BH4 с образованием реактивных гем-оксигрупп, реагирующих либо с Arg, либо с NOHA. После того как Arg окисляется до NOHA, редуктазный домен обеспечивает электрон для восстановления радикала BH4 и, таким образом, восстанавливает гем-FeIII для катализа окисления NOHA. Во время окисления NOHA образующийся радикал BH4 получает электрон от продуктов реакции внутри NOS, и это позволяет генерировать гем-FeIII-NO с высвобождением NO.
Было показано, что радикал BH4, который образуется на стадии окисления NOHA, быстро восстанавливается, получая электрон от продуктов, образующихся в процессе окисления NOHA, например комплекса гем-FeII-NO или даже от нитроксила [5]. То есть BH4 сначала действует как одноэлектронный донор для гем-FeII-O2, чтобы обеспечить активацию кислорода, а затем - как одноэлектронный окислитель, получая электрон от гем-FeII-NO и т.д. Считается, что ключевой ролью BH4 является именно это действие в качестве последовательного одноэлектронного восстановителя и окислителя на стадии реакции окисления NOHA, поскольку это позволяет NOS генерировать свободный NO, как конечный продукт [4; 5].
Формирование структурной схемы модели
Основываясь на новых данных о роли кофермента BH4 в каталитическом цикле NOS, а также учитывая кинетическую предпочтительность восстановления комплекса гем-FeII-O2 именно коферментом BH4 (скорость этой реакции на порядок превышает скорость переноса электрона от редуктазного домена на гем), мы сделали предположение об иной схеме работы кофермента BH4. А именно, что вместо «пропускания гемом NOS через себя электрона от редуктазного домена для восстановления BH4» [4] кофермент BH4 работает по схеме: гем в форме комплекса гем-FeII-O2 восстанавливает, а гем в формах комплексов гем-FeII и гем-FeII-NO окисляет. Такое допущение дает непротиворечивую картину роли BH4 с его циклами аутоокисления и восстановления.
Последовательность этапов каталитического цикла
Алгоритм протекания каталитического цикла NOS при физиологических условиях показан на рис. 4. Продуктивная цепочка синтеза выделена на рисунке цветом, патологические цепочки – серым.
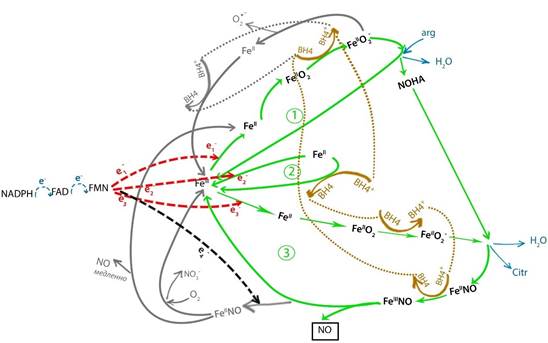
Рис. 4. Трехтактный цикл катализа NOS
1. Редуктазный домен:
1.1. NADPH связывает молекулу, содержащую флавины (FAD, FMN),
1.2. NADPH посредством гидридного переноса восстанавливает FAD,
1.3. Происходит последующее распределение одиночных электронов (диспропорционирование) между FAD и FMN,
1.4. Связывание кальмодулином ионов кальция вызывает структурные конформационные изменения, обеспечивающие передачу электрона № 1 от восстановленного FMN к гему трехвалентного железа (гем-FeIII).
2. Первый такт цикла ((1) на схеме):
2.1. Электрон № 1 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
2.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
2.3. Кофермент BH4 восстанавливает гем-FeII-О2 до гем-FeII-О2-, активируя его для дальнейшей реакции с аргинином, при этом сам превращается в радикал BH4+,
2.4. Аргинин реагирует с гем-FeII-О2- с образованием NOHA, молекулы H2O и гем-FeIII (первый такт закончился, подцикл замкнулся).
3. Второй такт (промежуточный):
3.1. Электрон № 2 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
3.2. Радикал BH4+, образованный в первом подцикле, окисляет гем-FeII до гем-FeIII, восстанавливаясь для третьего подцикла.
4. Третий подцикл:
4.1. Электрон № 3 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
4.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
4.3. Кофермент BH4 (восстановленный во втором такте) восстанавливает гем-FeII-О2 до гем-FeII-О2-, активируя его для дальнейшей реакции с NOHA, при этом сам окисляясь до радикала BH4+,
4.4. NOHA (образованный в первом такте) реагирует с гем-FeII-О2- с образованием цитруллина, H2O и комплекса гем-FeII-NO,
4.5. Радикал BH4+, образованный на предыдущем шаге (п. 4.3), окисляет комплекс гем-FeII-NO до гем-FeIII-NO, сам восстанавливаясь до BH4 (готов к новому циклу),
4.6. Комплекс гем-FeIII-NO распадается на свободный NO (конечный продукт продуктивного цикла) и гем-FeIII (третий такт закончился, цикл замкнулся).
Функционирование цикла при распространенных патологических состояниях
Схемы цикла при распространенных патологических состояниях, которые оказывают существенное влияние на картину работы NOS, показаны на рис. 5 и 6:
1. Выраженная гипоксия.
2. Дефицит субстрата (аргинина).
3. Включение непродуктивной ветви цикла, когда NO, высвободившийся из комплекса гем-FeIII-NO, не успевает выйти из фермента.
При гипоксии цикл катализа NOS блокируется уже на втором шаге первого подцикла, гем-FeII не окисляется до гем-FeII-O2.
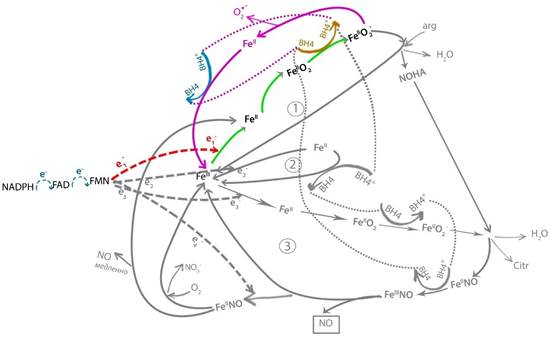
Рис. 5. Дефицит субстрата (аргинина): последовательность этапов цикла NOS (выделены цветом)
1. Редуктазный домен:
1.1. NADPH связывает молекулу, содержащую флавины (FAD, FMN),
1.2. NADPH посредством гидридного переноса восстанавливает FAD,
1.3. Происходит последующее распределение одиночных электронов (диспропорционирование) между FAD и FMN,
1.4. Связывание кальмодулином ионов кальция вызывает структурные конформационные изменения, обеспечивающие передачу электрона № 1 от восстановленного FMN к гему трехвалентного железа (гем-FeIII).
2. Цикл NOS:
2.1. Электрон № 1 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
2.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
2.3. Кофермент BH4 восстанавливает гем-FeII-О2 до гем-FeII-О2-, активируя его, при этом сам превращается в радикал BH4+,
2.4. В силу своей нестабильности [7] комплекс гем-FeII-О2- распадается на О2- и гем-FeII,
2.5. Комплекс гем-FeII окисляется радикалом BH4+ (получившимся в результате п. 2.3) до гем-FeIII (замкнули цикл катализа), при этом радикал BH4+ восстанавливается до BH4 (готов к следующему циклу).
Необходимо отметить, что такой патологический цикл значительно короче продуктивного и требует на один цикл всего один электрон от редуктазного домена вместо трех для продуктивного цикла. Поскольку в каталитическом цикле лимитирующей фазой (из-за наиболее низкой скорости) является перенос электрона от редуктазного домена на гем, то патологический цикл NOS при дефиците субстрата должен быть почти в 3 раза более производительным, чем нормальный цикл, генерируя O2- в значимых количествах («разобщение» NOS [10]).
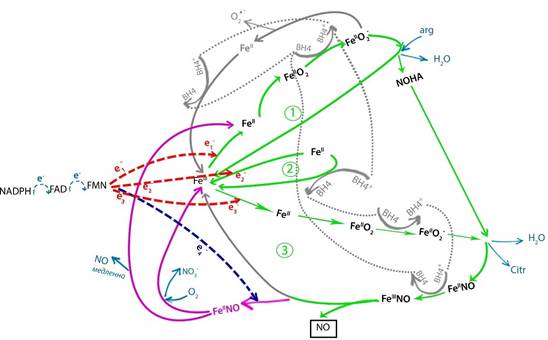
Рис. 6. Последовательность этапов каталитического цикла NOS при включении непродуктивной ветви цикла
Коэффициент распределения циклов катализа на продуктивные и непродуктивные определяется соотношением скоростей выхода NO из кармана гема фермента и скоростью восстановления гема редуктазным доменом [4]. Если NO, образовавшийся при распаде комплекса гем-FeIII-NO, не успевает выйти из «кармана» фермента и опять связывается с гем-FeIII, то редуктазный домен успевает перенести электрон № 4 на комплекс гем-FeIII-NO, восстанавливая его до гем-FeII-NO, а кофермент BH4 к этому моменту цикла уже восстановлен и не может окислить гем-FeII-NO.
До третьего такта цикла последовательность этапов полностью совпадает с нормальным продуктивным циклом, поэтому ниже приводятся этапы, начиная с третьего такта.
1. Третий такт:
1.1. Электрон № 3 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
1.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
1.3. Кофермент BH4 (восстановленный во втором такте) восстанавливает гем-FeII-О2 до до гем-FeII-О2-, активируя его для дальнейшей реакции с NOHA, при этом сам окисляясь до радикала BH4+,
1.4. NOHA (образованный в первом такте цикла) реагирует с гем-FeII-О2- с продукцией цитруллина, H2O и комплекса гем-FeII-NO,
1.5. Радикал BH4+, образованный на предыдущем шаге (п. 1.3), окисляет комплекс гем-FeII-NO до гем-FeIII-NO, сам восстанавливаясь до BH4 (готов к новому циклу),
1.6. NO не успевает выйти из кармана гема, снова связываясь с гем-FeIII и комплекс гем-FeIII-NO восстанавливается до гем-FeII-NO электроном № 4 из редуктазного домена, далее подцикл распадается на два возможных пути:
1.6.1. При достаточности кислорода гем-FeII-NO реагирует с ним, образуя NO3- и гем-FeIII (такт № 3 закончился, непродуктивный цикл замкнулся),
1.6.2. Путь, возможный при гипоксии: гем-FeII-NO распадается на NO и гем-FeII (цикл замкнулся сразу на второй шаг первого такта).
Заключение
Таким образом, сформированная трехтактная структурная схема каталитического цикла NOS позволяет увязать имеющуюся информацию о взаимодействии и схеме работы доменов и связывающих центров как при нормальной работе фермента, так и в ситуациях гипоксии, нехватки субстрата или снижения скорости высвобождения NO из кармана NOS, что приводит к запуску патологических вариантов цикла.
Принятое допущение о свойствах BH4 (восстановитель для комплекса гем-FeII-O2 и окислитель для гем-FeII, гем-FeII-NO) позволило выделить замкнутый цикл реакций BH4 внутри каталитического цикла NOS (выделен точечным пунктиром на рис. 4-6), дающий возможность BH4 без расходования обеспечивать и ускорять протекание цикла.
Предложенная трехтактная структурная схема позволит сформировать имитационную модель ферментативной части цикла NO, что будет полезно для прогнозирования поведения NOS при распространенных патологических состояниях.



