Оксид азота II (NO) является участником широкого спектра физиологических и патофизиологических процессов. NO регулирует тонус и проницаемость сосудов, тонус гладких мышц внутренних органов, процессы воспаления и иммунной защиты. Являясь активным участником свободно-радикальных процессов, приводит к генерации высокоагрессивных соединений, таких как пероксинитрит, гидроксильные радикалы, инициирует ПОЛ и др. Оксид азота вовлечен в патогенез большинства социально значимых воспалительных заболеваний легких, а также может служить биологическим маркером течения воспаления в респираторном тракте [1-3].
NO синтезируются NO-синтазами (NOSs), представляющими собой цитохром Р-450 подобные гемопротеины, которые окисляют L-аргинин (Arg) в двухстадийном процессе, требующем целого ряда кофакторов: никотинамидадениндинуклеотидфосфат (NADPH), флавинадениндинуклеотид (FAD), флавинмононуклеотид (FMN), тетрагидроптерин, кальмодулин и т.д. Промежуточной фазой синтеза является продукция L-гидроксиаргинина (NOHA) [4; 5].
Принято выделять три изоформы NO-синтаз, которые кодируются разными генами и отличаются субклеточной локализацией, особенностями активации и ингибирования, уровнем синтеза оксида азота [6]. Но, несмотря на многочисленные различия, можно выделить общие для всех NO-синтаз домены, кофакторы и субстратсвязывающие центры [7; 8]. Это делает возможным создание универсальной имитационной модели функционирования NO-синтаз, которую затем можно будет адаптировать к различным изоформам.
Подобное моделирование необходимо для лучшего понимания активности NOSs, как сложных систем с довольно большим набором значимых параметров, многоуровневыми причинно-следственными связями между ними и нетривиальными алгоритмами функционирования.
Целью настоящей работы является формирование базовой структурной схемы универсальной модели каталитического цикла NOS, применимой ко всем основным изоформам NOS.
Материалы и методы исследования
Для моделирования была использована структурная схема функционирования NO-синтаз в установившемся режиме, составленная на основе литературных данных.
Все три изомера NO-синтаз являются димерными двухдоменными ферментами, которые содержат протопорфирин железа IX, FAD, (FMN) и тетрагидробиоптерин (BH4) в качестве простетических связывающих групп [6].
Изоформы NOS кодируются разными генами и отличаются распределением в клетках, особенностями активации и ингибирования, уровнем синтеза оксида азота [6].
NOS-1 - нейрональная (nNOS) или мозговая (bNOS), кальций-зависимая;
NOS-3 - эндотелиальная (eNOS), кальций-зависимая;
NOS-2 - индуцибельная (iNOS) или макрофагальная (mNOS), кальций-независимая.
NOS-1 и NOS-3 являются конститутивными (cNOS), постоянно находятся в цитоплазме (то есть являются ингредиентными), зависят от концентрации кальция и кальмодулина, а также способствуют выделению небольшого количества NO на короткий период в ответ на рецепторную физиологическую стимуляцию. cNOS существенно инактивируется при низких концентрациях свободного кальция и максимально активен при его содержании около 1 мМ. NO, образующийся под влиянием cNOS, действует как переносчик в ряде физиологических ответов [9].
NOS-2 впервые была выделена из макрофагов и относится к индуцибельной изоформе NO-синтазы (iNOS). Этот фермент, в противоположность конститутивным ферментам, менее зависим от ионов Са2+ или кальмодулина [9].
По особенностям активации, уровню генерации NO описанные изоформы подразделяют на две группы:
- конститутивные (cNOS - nNOS и eNOS);
- индуцибельные (iNOS – iNOS).
сNOS (nNOS и eNOS) являются кальций-зависимыми, способствуют выделению небольшого количества NO (пикомоли) в ответ на рецепторную стимуляцию.
eNOS - мембранно-связанная, локализуется в больших количествах в эндотелии, и в частности в тромбоцитах, интерглобулярной, афферентной и эфферентной артериолах, а также в гломерулах, мезангиальных клетках и др. [9].
nNOS – цитозольная, находится в нейронах, эндотелиальных клетках, в том числе эндотелии эфферентной артериолы почек, в тромбоцитах, в мозговом слое надпочечников, скелетных мышцах и т.д. [9].
iNOS обычно не определяется в клетках, находящихся в покое, но ее экспрессия индуцируется в ответ на стимуляцию провоспалительными цитокинами, оксидативным стрессом и др. iNOS может генерировать большие количества NO в течение длительного времени, если субстрат и кофакторы не ограниченны [9].
Исходные данные для структурной схемы модели
Для всех изоформ NO-синтаз характерна следующая схема доменов и связывающих центров, показанная на рис. 1 [8].
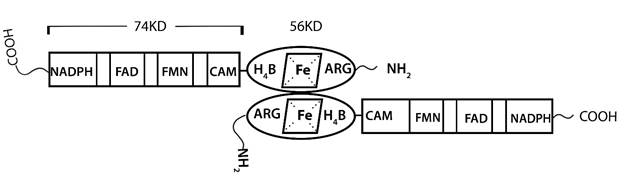
Рис. 1. Структурная модель NOS [8]
Редуктазный домен молекулярной массой 74 кДа присоединен к димеру оксигеназного домена массой 112 кДа в сердцевине. Оксигеназный домен содержит связывающие центры для L-аргинина (Arg), тетрагидробиоптерина (BH4) и гема (Fe). Редуктазные домены пептида содержат FAD, FMN, NADPH. Кальмодулин-связывающая последовательность (CAM) находится между FMN и CAM.
Общие структурные элементы, изученные к настоящему моменту, включают белковый линкер, соединяющий домены FAD и FMN, поверхностно заряженные остатки на доменах FAD, FMN и NOSoxy и петлю рядом со связанным FMN, которая помогает его стабилизировать [4].
Уникальные регуляторные элементы, присутствующие в NO-синтазах, включают С-концевой хвост (CT), характерный для всех изоформ NOS млекопитающих, аутоингибиторную вставку (AI), расположенную в FMN-доменах eNOS и nNOS, но отсутствующую в iNOS [4]. По указанным регуляторным элементам пока недостаточно исследований, позволяющих формализовать алгоритмы их функционирования, поэтому для целей нашего моделирования они не включаются в структурную схему.
Роль кальмодулина и Ca2+ в синтезе NO
NO-синтазы представляют собой редкий пример, когда перенос электронов в окислительно-восстановительном ферменте контролируется Ca2+-связывающим белком кальмодулином (СаМ). Связывание CaM, управляемое Ca2+, играет ключевую роль, снимая репрессию на трех критических этапах переноса электронов в каталитическом пути NO-синтазы, а именно переносы электронов между NADPH и FAD, FAD и FMN, а также FMN и гемом.
На сегодняшний момент известно, что взаимодействие CaM с NOS представляет собой поэтапный процесс: два иона Ca2+ сначала связываются с центрами кальмодулина с более высокой аффинностью. Это позволяет CaM связываться с NOS и ослаблять репрессию на этапах переноса электрона NOS в редуктазном домене (от NADPH в FAD, от FAD в FMN), а также инициировать промежуточные конформационные изменения. Но этого недостаточно для запуска переноса электронов от FMN в гем. Для указанного шага требуется, чтобы еще два дополнительных иона Ca2+ связались с СаМ и заполнили все четыре центра CaM [4].
Имеющиеся данные свидетельствуют о том, что редуктазный домен существует как динамическая система открытых и закрытых конформаций во всех ее физиологически значимых состояниях (т.е. от одно- до четырехэлектронного восстановленного). Связывание CaM не изменяет относительную термодинамику реакций переноса электронов между FMN и FAD, или между FMN и гемом, а также не преобразует закрытое конформационное состояние в открытое. При этом выявлены по крайней мере четыре способа, посредством которых связывание CaM обеспечивает перенос электрона в NOS и катализ [4]:
- СаМ сдвигает конформационное равновесие редуктазного домена в сторону более открытых конформаций, которые должны связаться с Са2+, чтобы FMN мог перенести электрон на оксидазный домен NOS;
- CaM сокращает время жизни любой конформации, ускоряя переходы между ними и поток электронов через редуктазный домен;
- CaM сужает стереометрическое распределение конформаций;
- CaM помогает ограничивать и направлять перемещения домена FMN в пространстве. Это, вероятно, связано с тем, что CaM формирует временные ионные и гидрофобные взаимодействия с поверхностью оксидазного домена NOS, которые в конечном итоге помогают направить стыковку домена FMN. Также предполагается, что CaM устраняет физический блок стыковки FMN с помощью регуляторного элемента AI.
Таким образом, связывание кальмодулином ионов Са2+ является триггером переноса электронов в гем, а также увеличивает и ускоряет электронный поток. При этом iNOS, в отличие от двух других изоформ, является Са2+ независимой. Соответственно, для целей нашего моделирования целесообразно рассматривать комплекс СаМ – ионы Са2+ целиком, в контексте наличия или отсутствия дефицита Са2+, то есть вводить его в модель как долю насыщения кальмодулина ионами Ca2+, не описывая по отдельности оба этапа связывания.
Особенности формирования конечных продуктов катализа NOS
Согласно актуальным данным, непосредственным продуктом катализа NOS является комплекс гем – FeIII-NO, а не свободный NO. Дело в том, что все изоформы NOS связывают свой собственный NO, прежде чем высвобождать его. Гем NOS связан внутри защищенного кармана фермента, который ограничивает проникновение и выход соединений с низкой молекулярной массой. Это приводит к тому, что новообразованный NO задерживается в кармане гема, связываясь и высвобождаясь много раз, прежде чем выйти из фермента в раствор. Чем дольше комплекс гем – FeIII-NO сохраняется в NOS, тем более вероятно, что он будет восстановлен электроном из редуктазного домена, с образованием комплекса гем – FeII-NO, который высвобождает NO очень медленно и фактически является «отравленной» NO формой NOS [4]. Как только во время катализа NOS образуется комплекс гем-FeIII-NO, он или восстанавливается, или высвобождает NO. Коэффициент распределения между этими двумя путями определяется соотношением скоростей выхода NO из ферментного кармана гема и восстановления гема редуктазным доменом. Путь, когда NO высвобождается из фермента, - продуктивный, потому что NOS возвращается в свою трехвалентную форму и готова начать новый цикл катализа. Напротив, путь, в котором комплекс гем-FeIII-NO восстанавливается до гем-FeII-NO, является в некотором роде бесполезным, поскольку прямое высвобождение NO из комплекса гем-FeII-NO протекает крайне медленно и в результате подавляющая часть гем-FeII-NO дополнительно окисляется до нитрата с целью регенерировать NOS в трехвалентной форме [4].
Продуктивный и непродуктивный пути в каталитическом цикле NOS
В каталитическом цикле NOS можно выделить два пути, условно названные «продуктивный» и «непродуктивный». Если NO успевает высвободиться из комплекса гем-FeIII-NO и выйти из кармана фермента, то цель цикла достигается, а NOS готова к следующему циклу. Если же NO не успевает выйти из кармана фермента и повторно связывается с гем-FeIII до прихода следующего электрона, то гем-FeIII-NO восстанавливается до гем-FeII-NO, который может реагировать с O2, образуя нитрат и гем-FeIII, или крайне медленно напрямую высвобождать NO, как показано на рис. 2 [5].
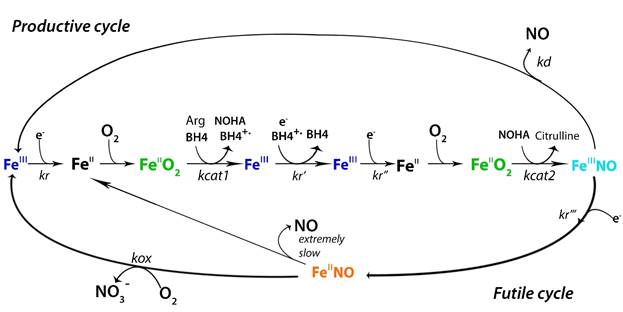
Рис. 2. Продуктивная и непродуктивная ветви каталитического цикла NOS [5]
Восстановление гема трехвалентного железа является лимитирующей стадией реакций биосинтеза NO (центральная линейная часть). Этот перенос электрона необходим для восстановления гем-FeIII перед каждой каталитической стадией, а также для восстановления радикала BH4 между реакциями окисления Arg и NOHA. Комплекс гем-FeIII-NO может либо высвобождать NO в рамках продуктивного цикла, либо восстанавливаться редуктазным доменом до комплекса гем-FeII-NO, который реагирует с O2, как часть непродуктивного цикла для образования нитрата и гема трехвалентного железа.
В непродуктивном цикле кислород непосредственно взаимодействует с комплексом гем-FeII-NO. Необходимо отметить, что величина и характер зависимости скорости этой реакции от концентрации О2 сильно отличаются между изоформами NOS. Мало того, они сильно отличаются от величины и характера зависимости скорости взаимодействия О2 с гем-FeII в основной цепочке синтеза NO [4]. Поэтому зависимость активности NOS от концентрации O2 носит сложный характер, поскольку является фактически композицией двух разных типов зависимости.
Роль тетрагидробиоптерина (BH4) в каталитическом цикле NOS
Для того чтобы NOS могла провести второй цикл активации кислорода, необходимый для окисления NOHA, необходимо быстрое восстановление радикала BH4 после гидроксилирования аргинина. Было показано, что источником электрона в данном случае является редуктазный домен NOS, а стадия восстановления BH4 зависит от СаМ [4; 5].
В последующих исследованиях было сделано предположение, что флавопротеиновый домен NOS пропускает электрон через гем для достижения связанного с ним радикала BH4 (рис. 3). Это, на первый взгляд, разрешало физическое противоречие, состоящее в том, что кофактор BH4 расположен слишком далеко от поверхности оксигеназного домена NOS, чтобы обеспечить прямой перенос электронов из FMN в редуктазный домен, даже когда FMN стыкуется с оксигеназным доменом. Предполагается, что гем может обрабатывать электрон, полученный от редуктазного домена, двумя способами: для связывания кислорода с гемом и образования комплекса гем-FeII-O2, и для восстановления связанного радикала BH4 [4].
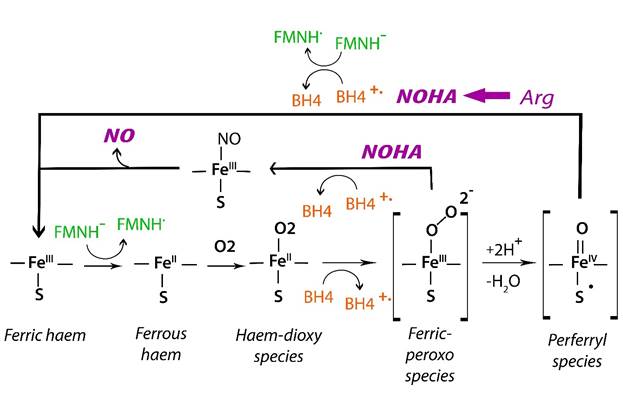
Рис. 3. Роль BH4 в активации комплекса гем-FeII-O2 [4]
Катализ начинается с восстановления гем-FeIII электроном из редуктазного домена (FMNH). Это позволяет гему связывать O2 и образовывать гем-FeII-O2, который затем восстанавливается с помощью BH4 с образованием реактивных гем-оксигрупп, реагирующих либо с Arg, либо с NOHA. После того как Arg окисляется до NOHA, редуктазный домен обеспечивает электрон для восстановления радикала BH4 и, таким образом, восстанавливает гем-FeIII для катализа окисления NOHA. Во время окисления NOHA образующийся радикал BH4 получает электрон от продуктов реакции внутри NOS, и это позволяет генерировать гем-FeIII-NO с высвобождением NO.
Было показано, что радикал BH4, который образуется на стадии окисления NOHA, быстро восстанавливается, получая электрон от продуктов, образующихся в процессе окисления NOHA, например комплекса гем-FeII-NO или даже от нитроксила [5]. То есть BH4 сначала действует как одноэлектронный донор для гем-FeII-O2, чтобы обеспечить активацию кислорода, а затем - как одноэлектронный окислитель, получая электрон от гем-FeII-NO и т.д. Считается, что ключевой ролью BH4 является именно это действие в качестве последовательного одноэлектронного восстановителя и окислителя на стадии реакции окисления NOHA, поскольку это позволяет NOS генерировать свободный NO, как конечный продукт [4; 5].
Формирование структурной схемы модели
Основываясь на новых данных о роли кофермента BH4 в каталитическом цикле NOS, а также учитывая кинетическую предпочтительность восстановления комплекса гем-FeII-O2 именно коферментом BH4 (скорость этой реакции на порядок превышает скорость переноса электрона от редуктазного домена на гем), мы сделали предположение об иной схеме работы кофермента BH4. А именно, что вместо «пропускания гемом NOS через себя электрона от редуктазного домена для восстановления BH4» [4] кофермент BH4 работает по схеме: гем в форме комплекса гем-FeII-O2 восстанавливает, а гем в формах комплексов гем-FeII и гем-FeII-NO окисляет. Такое допущение дает непротиворечивую картину роли BH4 с его циклами аутоокисления и восстановления.
Последовательность этапов каталитического цикла
Алгоритм протекания каталитического цикла NOS при физиологических условиях показан на рис. 4. Продуктивная цепочка синтеза выделена на рисунке цветом, патологические цепочки – серым.
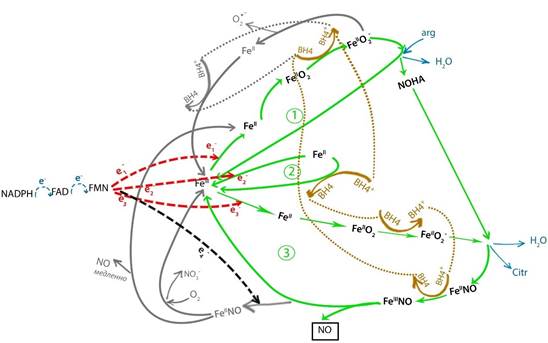
Рис. 4. Трехтактный цикл катализа NOS
1. Редуктазный домен:
1.1. NADPH связывает молекулу, содержащую флавины (FAD, FMN),
1.2. NADPH посредством гидридного переноса восстанавливает FAD,
1.3. Происходит последующее распределение одиночных электронов (диспропорционирование) между FAD и FMN,
1.4. Связывание кальмодулином ионов кальция вызывает структурные конформационные изменения, обеспечивающие передачу электрона № 1 от восстановленного FMN к гему трехвалентного железа (гем-FeIII).
2. Первый такт цикла ((1) на схеме):
2.1. Электрон № 1 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
2.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
2.3. Кофермент BH4 восстанавливает гем-FeII-О2 до гем-FeII-О2-, активируя его для дальнейшей реакции с аргинином, при этом сам превращается в радикал BH4+,
2.4. Аргинин реагирует с гем-FeII-О2- с образованием NOHA, молекулы H2O и гем-FeIII (первый такт закончился, подцикл замкнулся).
3. Второй такт (промежуточный):
3.1. Электрон № 2 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
3.2. Радикал BH4+, образованный в первом подцикле, окисляет гем-FeII до гем-FeIII, восстанавливаясь для третьего подцикла.
4. Третий подцикл:
4.1. Электрон № 3 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
4.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
4.3. Кофермент BH4 (восстановленный во втором такте) восстанавливает гем-FeII-О2 до гем-FeII-О2-, активируя его для дальнейшей реакции с NOHA, при этом сам окисляясь до радикала BH4+,
4.4. NOHA (образованный в первом такте) реагирует с гем-FeII-О2- с образованием цитруллина, H2O и комплекса гем-FeII-NO,
4.5. Радикал BH4+, образованный на предыдущем шаге (п. 4.3), окисляет комплекс гем-FeII-NO до гем-FeIII-NO, сам восстанавливаясь до BH4 (готов к новому циклу),
4.6. Комплекс гем-FeIII-NO распадается на свободный NO (конечный продукт продуктивного цикла) и гем-FeIII (третий такт закончился, цикл замкнулся).
Функционирование цикла при распространенных патологических состояниях
Схемы цикла при распространенных патологических состояниях, которые оказывают существенное влияние на картину работы NOS, показаны на рис. 5 и 6:
1. Выраженная гипоксия.
2. Дефицит субстрата (аргинина).
3. Включение непродуктивной ветви цикла, когда NO, высвободившийся из комплекса гем-FeIII-NO, не успевает выйти из фермента.
При гипоксии цикл катализа NOS блокируется уже на втором шаге первого подцикла, гем-FeII не окисляется до гем-FeII-O2.
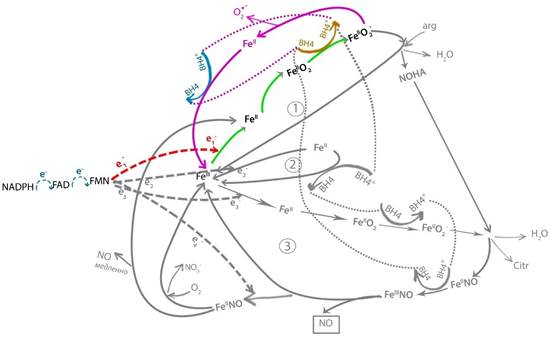
Рис. 5. Дефицит субстрата (аргинина): последовательность этапов цикла NOS (выделены цветом)
1. Редуктазный домен:
1.1. NADPH связывает молекулу, содержащую флавины (FAD, FMN),
1.2. NADPH посредством гидридного переноса восстанавливает FAD,
1.3. Происходит последующее распределение одиночных электронов (диспропорционирование) между FAD и FMN,
1.4. Связывание кальмодулином ионов кальция вызывает структурные конформационные изменения, обеспечивающие передачу электрона № 1 от восстановленного FMN к гему трехвалентного железа (гем-FeIII).
2. Цикл NOS:
2.1. Электрон № 1 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
2.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
2.3. Кофермент BH4 восстанавливает гем-FeII-О2 до гем-FeII-О2-, активируя его, при этом сам превращается в радикал BH4+,
2.4. В силу своей нестабильности [7] комплекс гем-FeII-О2- распадается на О2- и гем-FeII,
2.5. Комплекс гем-FeII окисляется радикалом BH4+ (получившимся в результате п. 2.3) до гем-FeIII (замкнули цикл катализа), при этом радикал BH4+ восстанавливается до BH4 (готов к следующему циклу).
Необходимо отметить, что такой патологический цикл значительно короче продуктивного и требует на один цикл всего один электрон от редуктазного домена вместо трех для продуктивного цикла. Поскольку в каталитическом цикле лимитирующей фазой (из-за наиболее низкой скорости) является перенос электрона от редуктазного домена на гем, то патологический цикл NOS при дефиците субстрата должен быть почти в 3 раза более производительным, чем нормальный цикл, генерируя O2- в значимых количествах («разобщение» NOS [10]).
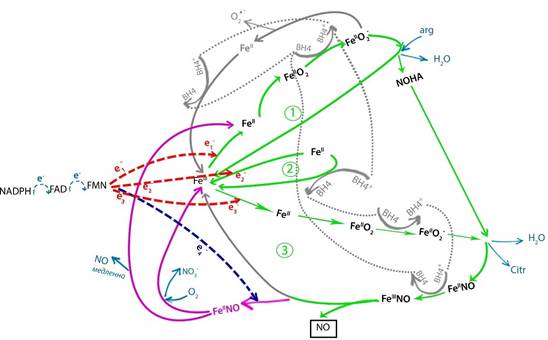
Рис. 6. Последовательность этапов каталитического цикла NOS при включении непродуктивной ветви цикла
Коэффициент распределения циклов катализа на продуктивные и непродуктивные определяется соотношением скоростей выхода NO из кармана гема фермента и скоростью восстановления гема редуктазным доменом [4]. Если NO, образовавшийся при распаде комплекса гем-FeIII-NO, не успевает выйти из «кармана» фермента и опять связывается с гем-FeIII, то редуктазный домен успевает перенести электрон № 4 на комплекс гем-FeIII-NO, восстанавливая его до гем-FeII-NO, а кофермент BH4 к этому моменту цикла уже восстановлен и не может окислить гем-FeII-NO.
До третьего такта цикла последовательность этапов полностью совпадает с нормальным продуктивным циклом, поэтому ниже приводятся этапы, начиная с третьего такта.
1. Третий такт:
1.1. Электрон № 3 от редуктазного домена восстанавливает гем-FeIII до гем-FeII,
1.2. При условии отсутствия дефицита О2, гем-FeII окисляется до гем-FeII-О2,
1.3. Кофермент BH4 (восстановленный во втором такте) восстанавливает гем-FeII-О2 до до гем-FeII-О2-, активируя его для дальнейшей реакции с NOHA, при этом сам окисляясь до радикала BH4+,
1.4. NOHA (образованный в первом такте цикла) реагирует с гем-FeII-О2- с продукцией цитруллина, H2O и комплекса гем-FeII-NO,
1.5. Радикал BH4+, образованный на предыдущем шаге (п. 1.3), окисляет комплекс гем-FeII-NO до гем-FeIII-NO, сам восстанавливаясь до BH4 (готов к новому циклу),
1.6. NO не успевает выйти из кармана гема, снова связываясь с гем-FeIII и комплекс гем-FeIII-NO восстанавливается до гем-FeII-NO электроном № 4 из редуктазного домена, далее подцикл распадается на два возможных пути:
1.6.1. При достаточности кислорода гем-FeII-NO реагирует с ним, образуя NO3- и гем-FeIII (такт № 3 закончился, непродуктивный цикл замкнулся),
1.6.2. Путь, возможный при гипоксии: гем-FeII-NO распадается на NO и гем-FeII (цикл замкнулся сразу на второй шаг первого такта).
Заключение
Таким образом, сформированная трехтактная структурная схема каталитического цикла NOS позволяет увязать имеющуюся информацию о взаимодействии и схеме работы доменов и связывающих центров как при нормальной работе фермента, так и в ситуациях гипоксии, нехватки субстрата или снижения скорости высвобождения NO из кармана NOS, что приводит к запуску патологических вариантов цикла.
Принятое допущение о свойствах BH4 (восстановитель для комплекса гем-FeII-O2 и окислитель для гем-FeII, гем-FeII-NO) позволило выделить замкнутый цикл реакций BH4 внутри каталитического цикла NOS (выделен точечным пунктиром на рис. 4-6), дающий возможность BH4 без расходования обеспечивать и ускорять протекание цикла.
Предложенная трехтактная структурная схема позволит сформировать имитационную модель ферментативной части цикла NO, что будет полезно для прогнозирования поведения NOS при распространенных патологических состояниях.
Библиографическая ссылка
Попова Н.А., Климанов И.А., Соодаева С.К., Темнов А.А. ФОРМИРОВАНИЕ СТРУКТУРНОЙ СХЕМЫ УНИВЕРСАЛЬНОЙ МОДЕЛИ КАТАЛИТИЧЕСКОГО ЦИКЛА NO-СИНТАЗ // Современные проблемы науки и образования. 2022. № 4. ;URL: https://science-education.ru/ru/article/view?id=31989 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/spno.31989



