Рак предстательной железы (РПЖ) является 2-м по распространенности в мире онкологическим заболеванием, диагностируемым у мужчин (в 2019 г. было зарегистрировано более 1 млн 200 тыс. новых случаев), а в структуре смертности от злокачественных новообразований РПЖ удерживает пятую позицию [1, 2].
Лучевая терапия (ЛТ) может использоваться как альтернатива хирургическому лечению в качестве первичной монотерапии при РПЖ с низким и промежуточным риском, а также для лечения местно-распространенных форм РПЖ в рамках сочетанной терапии [3, 4].
Рекомендации по терапии различаются в зависимости от времени развития биохимического рецидива. При его возникновении после радикальной простатэктомии возможны варианты проведения лучевой терапии. Если же рецидив детектируется после проведения лучевой терапии, используются альтернативные методы лечения [5].
Высокая частота биохимических и локальных рецидивов злокачественных опухолей предстательной железы, вызванная устойчивостью опухолевых клеток к облучению, послужила основанием для поиска новых подходов к лучевой терапии. Первым таким подходом стало использование повышенных суммарных очаговых доз (СОД), однако возможности ЛТ в конце ХХ в. были ограничены рядом причин технического характера, что сказывалось на переносимости проводимого лечения. Позже C.J. Wallis и соавторы показали, что увеличение дозы облучения может как улучшить терапевтический эффект, так и повысить риск повреждений нормальных тканей или развития вторичной онкологической патологии в органах риска [6]. К 2021 г. в технологических подходах ЛТ РПЖ достигнут значительный прогресс, однако не позволивший решить проблему радиоустойчивости опухолевых клеток. Так, согласно данным L. Chang и соавторов, через 5 лет после проведения курсов ЛТ у 50% пациентов с рецидивирующим течением РПЖ опухолевые клетки будут обладать выраженной устойчивостью к стандартным схемам облучения [7].
Исследования, послужившие основой европейских клинических рекомендаций по лечению РПЖ, продемонстрировали снижение количества локальных и биохимических рецидивов при увеличении дозы конформной ЛТ. Однако метаанализ, обобщающий данные по лечению 1300 больных локализованным РПЖ, не позволил установить зависимость между результатами лечения и методикой ЛТ [8, 9]. Таким образом, остается открытым вопрос о роли эскалации доз в улучшении результатов лечения.
Поэтому целью исследования стало выявление в модельном эксперименте взаимосвязи между дозой облучения и формированием радиорезистентности.
Материалы и методы исследования
Для проведения модельного эксперимента была выбрана стандартизированная клеточная линия опухолевых клеток предстательной железы человека – PC-3, которая культивировалась в CO2-инкубаторе в стерильных плоскодонных флаконах, содержащих RPMI-1640 c 10%-ной сывороткой и гентамицином (не более 50 мкг/мл RPMI-1640) [10]. Облучение клеток проводили на линейном ускорителе частиц Novalis TX, для предлучевой подготовки использовали томограф Somatom Definition AS и ПО Eclips [11]. Для эксперимента были выбраны следующие режимы фракционирования.
1. Пятидневное облучение в дозах 6.4 и 7.25 Гр.
Этап 1. Клетки облучали ежедневно, 5 дней подряд (первый вариант – итоговая изоэффективная СОД 77,4 Гр (РОД 6,4 Гр, соответствует дистанционной ЛТ), второй вариант – итоговая изоэффективная СОД 97,6 Гр (РОД 7,25 Гр, соответствует стереотаксической ЛТ)) [11]. Каждый день через 60 мин после ЛТ в 6 контрольных флаконах, 6 флаконах для первого варианта и 6 флаконах для второго варианта меняли питательную среду и оценивали количество погибших клеток. После каждого дня облучения проводили микроскопирование и фотофиксацию клеточного монослоя (микроскоп Leica DM IL LED Fluo). Для оценки количества живых/мертвых клеток и общего количества использовали камеру Горяева и 0,4%-ный раствор трипанового синего. После 5-го облучения и подсчета клеток клеточную линию снимали с подложки флакона, используя раствор Трипсина–Версена. Полученную суспензию использовали для определения на проточном цито-флюориметре Facs Canto II количества клеток на разных стадиях апоптоза (Annexin V-FITC Apoptosis Detection Kit): Annexin V(+) позитивные и PI(–) негативные клетки принимали за находящиеся в апоптозе, позитивные по Annexin V(+) и PI(+) считали мертвыми (некроз, поздняя стадия апоптоза), негативные по Annexin V(–) и PI(–) принимали за живые клетки [11]. Также проводилась оценка количества клеток, находящихся в разных фазах клеточного цикла (ДНК-цитометрия).
Оставшиеся после каждой дозы по 3 флакона + 3 флакона контроля (интактные) сохраняли для этапа 2.
Этап 2. Сохранившиеся после первого этапа облучения клетки продолжали культивировать в течение 120 ч, заменяя питательную среду каждые 24 ч. После 120 ч культивирования повторяли облучение в дозах 6,4 и 7,25 Гр, подсчет клеток проводили по схеме, описанной выше.
2. Однократное облучение клеток PC3 в дозе 15 и 17 Гр.
Была использована следующая схема эксперимента (рис. 1):
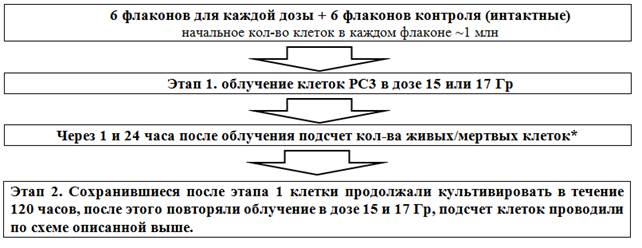
Рис. 1. Схема облучения клеток PC-3 в дозе 15 и 17 Гр (*Через 24 ч после ЛТ проводили микроскопирование и клетки обрабатывали раствором Трипсина–Версена (для 3 флаконов каждой дозы и 3 флаконов контроля). Далее: 1) оценивали количество клеток на различных стадиях апоптоза (аннексиновый тест), 2) оценивали количество клеток в разных фазах клеточного цикла (ДНК-цитометрия))
3. Однократное облучение клеток PC-3 в дозе 21 Гр.
Была использована следующая схема эксперимента (рис. 2).
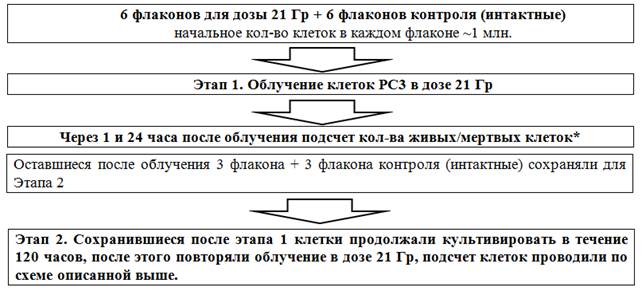
Рис. 2. Схема облучения клеток PC-3 в дозе 21 Гр (*Через 24 ч после ЛТ микроскопировали и снимали клетки с подложки флакона раствором Трипсина–Версена (3 флакона облученных в дозе 21 Гр и 3 флакона контроля). Далее: 1) оценивали количество клеток на различных стадиях апоптоза (аннексиновый тест), 2) с помощью ДНК-цитометрии оценивали количество клеток в разных фазах клеточного цикла)
Полученные данные статистически обрабатывали с помощью однофакторного дисперсионного анализа (One-Way ANOVA), который осуществляли в среде R (R-Studio 8.15.180015).
Результаты исследования и их обсуждение
На первом этапе модельного эксперимента была оценена эффективность воздействия доз 6,4 и 7,25 Гр на клетки PC-3 (рис. 3): было зафиксировано статистически значимое (р<0,05) снижение общего количества клеток на 71,6% и 71,4% соответственно, при этом порядка 50,0% от оставшегося количества опухолевых клеток были жизнеспособными и могли делиться.

Рис. 3. Состояние клеточного монослоя после пятидневного эксперимента и общее количество клеток. * – (р<0,05), статистически значимые изменения относительно контрольных флаконов
Сохранившие жизнеспособность после этапа 1 клетки продолжали культивировать в течение 5 дней, заменяя питательную среду каждые день. После этого было повторено облучение в дозах 6,4 Гр и 7,25 Гр (клетки в контрольных и экспериментальных флаконах перед облучением были нормализованы до 5 млн). После повторного облучения в дозах 6,4 Гр и 7,25 Гр статистически значимых отличий в общем количестве клеток относительно контроля обнаружено не было. При дозе в 6,4 Гр количество опухолевых клеток снизилось на 6,0%, а при дозе 7,25 Гр – на 8,0% (рис. 4).
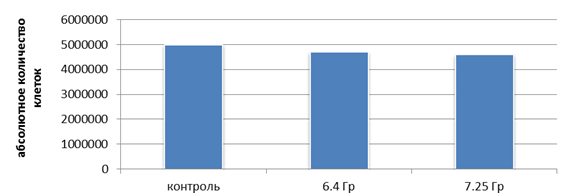
Рис. 4. Общее количество клеток после повторного облучения
Результаты оценки апоптоза с помощью аннексинового теста представлены в таблице 1 и на рисунке 5.
Таблица 1
Оценка апоптоза с помощью аннексинового теста (Этап 2)
|
Исследуемый образец |
Ann V(–) PI(–) (живые), % |
Ann V(–) PI(+) (мертвые), % |
Ann V(+) PI(–) (ранний апоптоз), % |
Ann V(+) PI(+) (поздний апоптоз), % |
|
Контроль |
94,4 |
0,1 |
1,3 |
3,9 |
|
6,4 Гр |
88,3 |
0,4 |
3,2 |
8,1 |
|
7,25 Гр |
88,2 |
0,3 |
4,9 |
8,6 |
Применение аннексинового теста показало, что после облучения количество живых клеток снизилось на 6% и 7% соответственно для доз 6,4 Гр и 7,25 Гр относительно контроля. При этом количество клеток в раннем апоптозе для доз 6,4 Гр и 7,25 Гр относительно контроля увеличилось в 2,5 и 3,8 раза (p<0,005) соответственно, количество клеток в позднем апоптозе увеличилось в 2,1 и 2,2 раза (p<0,005) соответственно, количество мертвых клеток увеличилось в 4,0 и 3,0 раза (p<0,005) соответственно.
Оценка количества клеток, находящихся на различных фазах клеточного цикла (ДНК-цитометрия), показала, что статистически значимо повторное облучение не влияло на количество опухолевых клеток в фазе G1 и S, но приводило к увеличению количества клеток в фазе G2 в 3,2 и 6,8 раза (p<0,05) соответственно при дозах 6,4 Гр и 7,25 Гр относительно контроля (табл. 2).
Таблица 2
Оценка клеточного цикла линии PC-3 после облучения (Этап 2)
|
Исследуемый образец |
% клеток на стадии |
||
|
G1 |
G2 |
S |
|
|
Контроль |
56,59 |
8,00 |
35,41 |
|
6,4 Гр |
47,42 |
25,78 |
26,80 |
|
7,25 Гр |
22,75 |
54,30 |
22,95 |
У эукариот клеточный цикл состоит из периода клеточного роста (интерфаза: синтез ДНК и белков, подготовка к делению клетки) и периода клеточного деления (М-фаза). В интерфазе выделяют три стадии: G1-фаза (синтез мРНК, белков и других клеточных компонентов), S-фаза (репликация ДНК в ядре клетки), G2-фаза (подготовка к митозу). В М-фазе выделяют стадию кариокинеза (деление клеточного ядра) и стадию цитокинеза (деление цитоплазмы) [12].
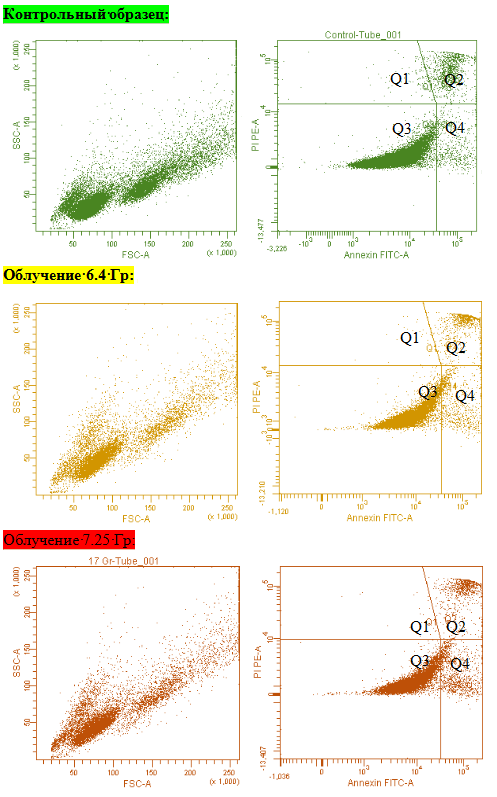
Рис. 5. Оценка апоптоза с помощью аннексинового теста
Примечание: *На левом графике представлены неокрашенные клетки, различающиеся по размеру и гранулярности; на правом графике – окрашенные пропидием и аннексином клетки.
· Q-1 – мертвые клетки (окрашены пропидием).
· Q-2 – клетки на стадии позднего апоптоза (окрашены пропидием и аннексином).
· Q-3 – живые клетки (не окрасились ни аннексином, ни пропидием).
· Q-4 – клетки на стадии раннего апоптоза (окрашены только аннексином).
Таким образом, второй этап облучения опухолевых клеток предстательной железы на линейном ускорителе частиц Novalis TX в дозах 6,4 и 7,25 Гр не приводит к значительному снижению общего количества клеток и их жизнеспособности, что можно объяснить формированием и последующим увеличением количества радиорезистентных клонов, выживших после первого этапа облучения.
Также была проведена оценка эффективности однократного облучения в дозах 15,0 Гр и 17,0 Гр на клетки PC-3. Однократное облучение клеток на линейном ускорителе частиц в дозах 15,0 и 17,0 Гр не вызвало статистически значимого снижения количества живых клеток через 60 мин после воздействия (рис. 6).
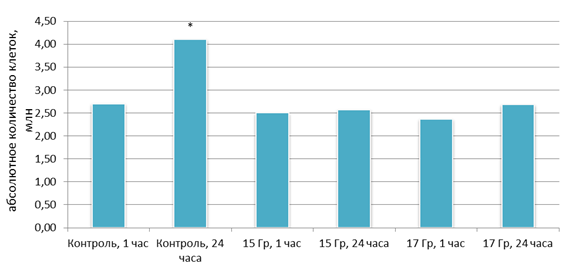
Рис. 6. Количество живых клеток после однократного облучения в дозах 15 и 17 Гр
Однако в контрольных флаконах через 24 ч обнаружено увеличение количества живых клеток в 1,5 раза (p<0,05), а в облученных флаконах статистически значимого изменения количества живых клеток не обнаружено. Результаты оценки апоптоза с помощью аннексинового теста представлены в таблице 3.
Таблица 3
Оценка апоптоза с помощью аннексинового теста после облучения 15 и 17 Гр (Этап 1)
|
Исследуемый образец |
Ann V(–) PI(–), % |
Ann V(+) PI(–), % |
Ann V(+)PI(+), % |
Ann V(–) PI(+), % |
|
Контроль (1 ч) |
91,7 |
4,3 |
3,9 |
0,1 |
|
15,0 Гр (1 ч) |
88,3 |
3,2 |
8,1 |
0,4 |
|
17,0 Гр (1 ч) |
88,2 |
4,9 |
6,6 |
0,3 |
|
Контроль (24 ч) |
98,4 |
0,3 |
0,9 |
0,4 |
|
15,0 Гр (24 ч) |
85,1 |
4,2 |
10,1 |
0,6 |
|
17,0 Гр (24 ч) |
81,1 |
6,2 |
11,6 |
1,1 |
Применение аннексинового теста показало, что через 1 ч после облучения в дозах 15 и 17 Гр количество живых клеток и клеток в раннем апоптозе относительно контроля не изменилось, однако зафиксировано увеличение количества клеток на стадии позднего апоптоза и количества мертвых клеток в 2,1 и 4,0 раза (p<0,05) соответственно для дозы 15 Гр и в 1,7 и 3,0 раза (p<0,05) соответственно для дозы 17 Гр. Через 1 день после воздействия доз 15 Гр и 17 Гр количество живых клеток относительно контроля также не изменилось, но количество клеток на стадии раннего и позднего апоптоза и количество мертвых клеток статистически значимо (p<0,05) увеличилось в 14,0, 11,2 и 1,5 раза соответственно для дозы 15 Гр и в 20,7, 12,9 и 2,8 раза соответственно для дозы 17 Гр.
ДНК-цитометрия показала, что статистически значимо однократное облучение не влияло на количество опухолевых клеток в фазе G1 и G2, но через 24 ч приводило к уменьшению количества клеток в фазе S в 1,4 и 1,5 раза (p<0,05) соответственно при дозах 15 Гр и 17 Гр относительно контроля (табл. 4).
Таблица 4
Оценка клеточного цикла PC-3 после облучения 15 и 17 Гр (этап 1)
|
Исследуемый образец |
% клеток |
||
|
G1 |
G2 |
S |
|
|
Контроль |
56,59 |
8,00 |
35,41 |
|
15,0 Гр (1 ч) |
47,42 |
15,78 |
36,80 |
|
17,0 Гр (1 ч) |
42,75 |
14,30 |
42,95 |
|
15,0 Гр (24 ч) |
53,42 |
20,78 |
25,80 |
|
17,0 Гр (24 ч) |
55,75 |
21,30 |
22,95 |
Обобщая полученные данные, можно констатировать следующий факт: несмотря на то, что облучение в дозах 15 и 17 Гр не вызывает значительной гибели опухолевых клеток, эффект от облучения проявляется в остановке пролиферации и клеточного цикла (отсутствии прироста клеточной массы и снижении количества клеток на стадии S) и активации апоптоза у части клеток.
Однако через 120 ч культивирования количество опухолевых клеток, подвергнутых облучению в дозах 15 и 17 Гр, достигло 5,0 и 4,5 млн соответственно. Клетки были пересеяны и во флаконах, содержащих по 4 млн опухолевых клеток, подвергнуты повторному облучению. Повторное облучение в дозах 15 и 17 Гр вызвало снижение количества живых клеток в 4,0 раза (через 1 ч) и 19,9 раза (через 24 ч) для дозы 15 Гр и снижение количества живых клеток в 5,5 раза (через 1 ч) и 7,7 раз (через 24 ч) для дозы 17 Гр (рис. 7).
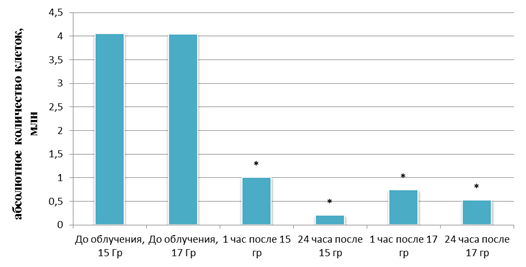
Рис. 7. Количество живых клеток PC-3 после повторного облучения в дозах 15 и 17 Гр.
* – статистически значимые отличия от уровня клеток до облучения (p<0,05)
Применение аннексинового теста показало, что через 1 ч после повторного облучения в дозах 15 Гр и 17 Гр количество живых клеток относительно контроля не изменилось. Количество клеток PC-3, находящихся на стадиях раннего и позднего апоптоза, увеличилось в 4,4 и 1,6 раза (p<0,05) соответственно для дозы 15 Гр и в 6,1 и 1,8 раза (p<0,05) соответственно для дозы 17 Гр. Количество мертвых клеток также статистически значимо (p<0,05) увеличилось в 6,0 раза для дозы 15 Гр и в 5,0 раза для дозы 17 Гр. Через 24 ч после облучения второго этапа в дозах 15 Гр и 17 Гр количество живых клеток относительно контроля также не изменилось, но количество клеток на стадии раннего и позднего апоптоза и количество мертвых клеток статистически значимо (p<0,05) увеличилось в 5,3, 2,8 и 9,0 раза соответственно для дозы 15 Гр и в 4,8, 2,6 и 16,0 раза соответственно для дозы 17 Гр (табл. 5).
Таблица 5
Оценка апоптоза с помощью аннексинового теста после облучения 15 и 17 Гр (этап 2)
|
Исследуемый образец |
Ann V(–) PI(–), % |
Ann V(+) PI(–), % |
Ann V(+) PI(+), % |
Ann V(–) PI(+), % |
|
контроль 1* |
95.1 |
1.1 |
3.7 |
0.1 |
|
15,0 Гр (1 ч) |
88,8 |
4,8 |
5,8 |
0,6 |
|
15,0 Гр (24 ч) |
82,8 |
5,8 |
10,5 |
0,9 |
|
контроль 2* |
94,1 |
1,5 |
4,3 |
0,1 |
|
17,0 Гр (1 ч) |
82,7 |
9,2 |
7,6 |
0,5 |
|
17,0 Гр (24 ч) |
80,1 |
7,2 |
11,1 |
1,6 |
* контроль 1 – для флаконов, облученных в дозе 15,0 Гр, контроль 2 – для флаконов, облученных в дозе 17,0 Гр
При этом оценка количества клеток, находящихся на различных фазах клеточного цикла, показала, что статистически значимо повторное облучение не влияло на количество опухолевых клеток в фазе G1 и S через 1 ч после облучения, но приводило к уменьшению количества клеток в фазе G2 в 1,6 и 2,1 раза (p<0,05) соответственно при дозах 15 Гр и 17 Гр относительно контроля (табл. 6). Максимальные изменения числа клеток, находящихся на различных фазах клеточного цикла, были обнаружены через 24 ч после повторного облучения: увеличение количества клеток в G1 в 1,4 раза (p<0,05) (для 15 и 17 Гр), снижение клеток в G2 в 1,8 и 2,7 раза (p<0,05) для 15 и 17 Гр соответственно, снижение количества клеток в S-фазе в 2,5 и 2,6 раза (p<0,05) для 15 и 17 Гр соответственно.
Таблица 6
Оценка клеточного цикла PC-3 после облучения 15 и 17 Гр (этап 2)
|
Исследуемый образец |
% клеток |
||
|
G1 |
G2 |
S |
|
|
Контроль |
61,19 |
9,00 |
29,81 |
|
15,0 Гр (1 ч) |
62,02 |
5,78 |
32,20 |
|
15,0 Гр (24 ч) |
83,12 |
5,12 |
11,76 |
|
17,0 Гр (1 ч) |
63,95 |
4,30 |
31,75 |
|
17,0 Гр (24 ч) |
85,01 |
3,30 |
11,69 |
С использованием дозы 21 Гр в модельном эксперименте были получены аналогичные результаты. Однократное облучение на Novalis TX клеток PC-3 в дозе 21 Гр не привело к значительному снижению количества живых клеток через 1 ч после облучения (рис. 8). Однако в контрольных флаконах через 24 ч обнаружено увеличение количества живых клеток в 1,5 раза (p<0,05), а в облученных флаконах статистически значимого увеличения количества живых клеток не обнаружено, наоборот, через 24 ч после облучения обнаружено снижение количества клеток в 1,9 раза (p<0,05) относительно соответствующего контроля. Результаты оценки апоптоза с помощью аннексинового теста представлены в таблице 7.
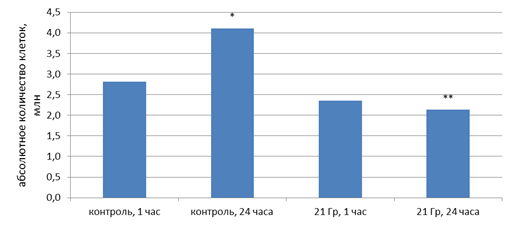
Рис. 8. Количество живых клеток после однократного облучения в дозе 21 Гр
Таблица 7
Оценка апоптоза с помощью аннексинового теста после облучения 21 Гр
|
Образец и этап исследования |
Ann V(–)PI(–), % |
Ann V(–) PI(+), % |
Ann V(+) PI(–), % |
Ann V(+) PI(+), % |
|
Контроль |
98,4 |
0,4 |
0,3 |
0,9 |
|
21 Гр – 1-й этап |
86,2 |
5,9 |
5,4 |
2,5 |
|
21 Гр – 2-й этап |
75,9 |
7,6 |
7,7 |
8,8 |
Применение аннексинового теста показало, что через 1 день после повторного облучения в дозе 21 Гр количество живых клеток относительно контроля не изменилось. Количество клеток на стадии раннего и позднего апоптоза, а также количество мертвых клеток статистически значимо (p<0,05) увеличилось в 18,0, 2,8 и 14,8 раза соответственно. При этом оценка количества клеток, находящихся на различных фазах клеточного цикла, показала, что статистически значимо облучение не влияло на количество опухолевых клеток в фазе G1 и S через 24 ч после облучения, но клеток в фазе G2 после облучения в этой дозе не было обнаружено вообще (табл. 8).
Таблица 8
Оценка клеточного цикла после облучения 21 Гр
|
Образец |
% |
|
||
|
|
||||
|
G1 |
G2 |
S |
||
|
|
|
|
||
|
Контроль |
56,59 |
8,00 |
35,41 |
|
|
21 Гр – 1-й этап |
64,31 |
0,00 |
35,69 |
|
|
21 Гр – 2-й этап |
94,61 |
0,00 |
5,39 |
|
Повторное облучение в дозе 21 Гр привело к статистически значимому снижению количества живых клеток в 1,6 раза (p<0,05) через 1 ч и в 3,7 раза (p<0,05) через 24 ч (рис. 9).
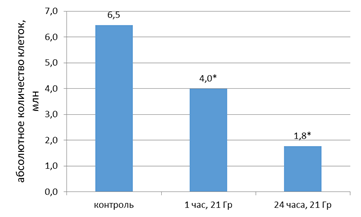
Рис. 9. Количество живых клеток после повторного облучения в дозе 21 Гр.
* – статистически значимые отличия от уровня клеток в контроле (p<0,05)
С использованием аннексинового теста было установлено, что через 1 день после повторного облучения в дозе 21 Гр количество живых клеток относительно контроля снизилось в 1,3 раза (p<0,05), количество клеток на стадии раннего и позднего апоптоза увеличилось в 25,7 (p<0,05) и 9,8 раза (p<0,05) соответственно, а количество мертвых клеток увеличилось в 19,0 раза (табл. 7). При этом оценка количества клеток, находящихся на различных фазах клеточного цикла, показала, что статистически значимо повторное облучение в дозе 21 Гр увеличило количество опухолевых клеток в фазе G1 в 1,7 раза (p<0,05), а в фазе S снизило в 6,6 раза (p<0,05) через 24 ч после облучения (табл. 8).
Заключение
Таким образом, ежедневное (5 дней подряд) воздействие облучения линейного ускорителя частиц в дозах 6,4 Гр и 7,25 Гр на опухолевые клетки предстательной железы (PC-3) вызывает гибель значительной части клеток-мишеней, но повторное облучение этими же дозами способствует проявлению эффекта радиорезистентности. Однократное облучение в дозах 15, 17 и 21 Гр обладает менее выраженным элиминирующим эффектом на клетки, однако при повторном облучении через 120 ч эффект усиливается, а радиорезистентность опухолевых клеток не проявляется.
Исследование выполнено в рамках гос. задания «Поиск молекулярно-генетических предикторов радиорезистентного рака предстательной железы и разработка персонифицированных терапевтических подходов»



