Рак предстательной железы (РПЖ) является 2-м по распространенности в мире онкологическим заболеванием, диагностируемым у мужчин (в 2019 г. было зарегистрировано более 1 млн 200 тыс. новых случаев), а в структуре смертности от злокачественных новообразований РПЖ удерживает пятую позицию [1, 2].
Лучевая терапия (ЛТ) может использоваться как альтернатива хирургическому лечению в качестве первичной монотерапии при РПЖ с низким и промежуточным риском, а также для лечения местно-распространенных форм РПЖ в рамках сочетанной терапии [3, 4].
Рекомендации по терапии различаются в зависимости от времени развития биохимического рецидива. При его возникновении после радикальной простатэктомии возможны варианты проведения лучевой терапии. Если же рецидив детектируется после проведения лучевой терапии, используются альтернативные методы лечения [5].
Высокая частота биохимических и локальных рецидивов злокачественных опухолей предстательной железы, вызванная устойчивостью опухолевых клеток к облучению, послужила основанием для поиска новых подходов к лучевой терапии. Первым таким подходом стало использование повышенных суммарных очаговых доз (СОД), однако возможности ЛТ в конце ХХ в. были ограничены рядом причин технического характера, что сказывалось на переносимости проводимого лечения. Позже C.J. Wallis и соавторы показали, что увеличение дозы облучения может как улучшить терапевтический эффект, так и повысить риск повреждений нормальных тканей или развития вторичной онкологической патологии в органах риска [6]. К 2021 г. в технологических подходах ЛТ РПЖ достигнут значительный прогресс, однако не позволивший решить проблему радиоустойчивости опухолевых клеток. Так, согласно данным L. Chang и соавторов, через 5 лет после проведения курсов ЛТ у 50% пациентов с рецидивирующим течением РПЖ опухолевые клетки будут обладать выраженной устойчивостью к стандартным схемам облучения [7].
Исследования, послужившие основой европейских клинических рекомендаций по лечению РПЖ, продемонстрировали снижение количества локальных и биохимических рецидивов при увеличении дозы конформной ЛТ. Однако метаанализ, обобщающий данные по лечению 1300 больных локализованным РПЖ, не позволил установить зависимость между результатами лечения и методикой ЛТ [8, 9]. Таким образом, остается открытым вопрос о роли эскалации доз в улучшении результатов лечения.
Поэтому целью исследования стало выявление в модельном эксперименте взаимосвязи между дозой облучения и формированием радиорезистентности.
Материалы и методы исследования
Для проведения модельного эксперимента была выбрана стандартизированная клеточная линия опухолевых клеток предстательной железы человека – PC-3, которая культивировалась в CO2-инкубаторе в стерильных плоскодонных флаконах, содержащих RPMI-1640 c 10%-ной сывороткой и гентамицином (не более 50 мкг/мл RPMI-1640) [10]. Облучение клеток проводили на линейном ускорителе частиц Novalis TX, для предлучевой подготовки использовали томограф Somatom Definition AS и ПО Eclips [11]. Для эксперимента были выбраны следующие режимы фракционирования.
1. Пятидневное облучение в дозах 6.4 и 7.25 Гр.
Этап 1. Клетки облучали ежедневно, 5 дней подряд (первый вариант – итоговая изоэффективная СОД 77,4 Гр (РОД 6,4 Гр, соответствует дистанционной ЛТ), второй вариант – итоговая изоэффективная СОД 97,6 Гр (РОД 7,25 Гр, соответствует стереотаксической ЛТ)) [11]. Каждый день через 60 мин после ЛТ в 6 контрольных флаконах, 6 флаконах для первого варианта и 6 флаконах для второго варианта меняли питательную среду и оценивали количество погибших клеток. После каждого дня облучения проводили микроскопирование и фотофиксацию клеточного монослоя (микроскоп Leica DM IL LED Fluo). Для оценки количества живых/мертвых клеток и общего количества использовали камеру Горяева и 0,4%-ный раствор трипанового синего. После 5-го облучения и подсчета клеток клеточную линию снимали с подложки флакона, используя раствор Трипсина–Версена. Полученную суспензию использовали для определения на проточном цито-флюориметре Facs Canto II количества клеток на разных стадиях апоптоза (Annexin V-FITC Apoptosis Detection Kit): Annexin V(+) позитивные и PI(–) негативные клетки принимали за находящиеся в апоптозе, позитивные по Annexin V(+) и PI(+) считали мертвыми (некроз, поздняя стадия апоптоза), негативные по Annexin V(–) и PI(–) принимали за живые клетки [11]. Также проводилась оценка количества клеток, находящихся в разных фазах клеточного цикла (ДНК-цитометрия).
Оставшиеся после каждой дозы по 3 флакона + 3 флакона контроля (интактные) сохраняли для этапа 2.
Этап 2. Сохранившиеся после первого этапа облучения клетки продолжали культивировать в течение 120 ч, заменяя питательную среду каждые 24 ч. После 120 ч культивирования повторяли облучение в дозах 6,4 и 7,25 Гр, подсчет клеток проводили по схеме, описанной выше.
2. Однократное облучение клеток PC3 в дозе 15 и 17 Гр.
Была использована следующая схема эксперимента (рис. 1):
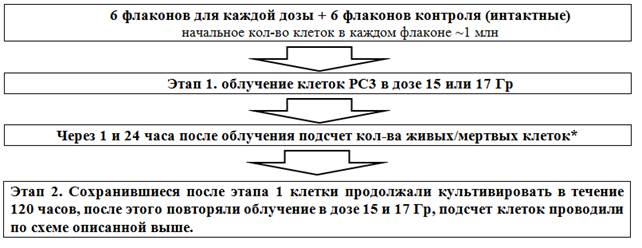
Рис. 1. Схема облучения клеток PC-3 в дозе 15 и 17 Гр (*Через 24 ч после ЛТ проводили микроскопирование и клетки обрабатывали раствором Трипсина–Версена (для 3 флаконов каждой дозы и 3 флаконов контроля). Далее: 1) оценивали количество клеток на различных стадиях апоптоза (аннексиновый тест), 2) оценивали количество клеток в разных фазах клеточного цикла (ДНК-цитометрия))
3. Однократное облучение клеток PC-3 в дозе 21 Гр.
Была использована следующая схема эксперимента (рис. 2).
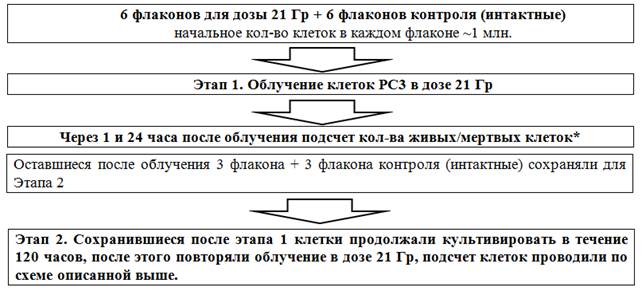
Рис. 2. Схема облучения клеток PC-3 в дозе 21 Гр (*Через 24 ч после ЛТ микроскопировали и снимали клетки с подложки флакона раствором Трипсина–Версена (3 флакона облученных в дозе 21 Гр и 3 флакона контроля). Далее: 1) оценивали количество клеток на различных стадиях апоптоза (аннексиновый тест), 2) с помощью ДНК-цитометрии оценивали количество клеток в разных фазах клеточного цикла)
Полученные данные статистически обрабатывали с помощью однофакторного дисперсионного анализа (One-Way ANOVA), который осуществляли в среде R (R-Studio 8.15.180015).
Результаты исследования и их обсуждение
На первом этапе модельного эксперимента была оценена эффективность воздействия доз 6,4 и 7,25 Гр на клетки PC-3 (рис. 3): было зафиксировано статистически значимое (р<0,05) снижение общего количества клеток на 71,6% и 71,4% соответственно, при этом порядка 50,0% от оставшегося количества опухолевых клеток были жизнеспособными и могли делиться.

Рис. 3. Состояние клеточного монослоя после пятидневного эксперимента и общее количество клеток. * – (р<0,05), статистически значимые изменения относительно контрольных флаконов
Сохранившие жизнеспособность после этапа 1 клетки продолжали культивировать в течение 5 дней, заменяя питательную среду каждые день. После этого было повторено облучение в дозах 6,4 Гр и 7,25 Гр (клетки в контрольных и экспериментальных флаконах перед облучением были нормализованы до 5 млн). После повторного облучения в дозах 6,4 Гр и 7,25 Гр статистически значимых отличий в общем количестве клеток относительно контроля обнаружено не было. При дозе в 6,4 Гр количество опухолевых клеток снизилось на 6,0%, а при дозе 7,25 Гр – на 8,0% (рис. 4).
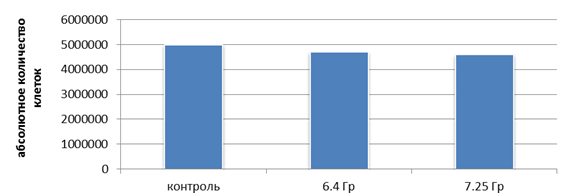
Рис. 4. Общее количество клеток после повторного облучения
Результаты оценки апоптоза с помощью аннексинового теста представлены в таблице 1 и на рисунке 5.
Таблица 1
Оценка апоптоза с помощью аннексинового теста (Этап 2)
|
Исследуемый образец |
Ann V(–) PI(–) (живые), % |
Ann V(–) PI(+) (мертвые), % |
Ann V(+) PI(–) (ранний апоптоз), % |
Ann V(+) PI(+) (поздний апоптоз), % |
|
Контроль |
94,4 |
0,1 |
1,3 |
3,9 |
|
6,4 Гр |
88,3 |
0,4 |
3,2 |
8,1 |
|
7,25 Гр |
88,2 |
0,3 |
4,9 |
8,6 |
Применение аннексинового теста показало, что после облучения количество живых клеток снизилось на 6% и 7% соответственно для доз 6,4 Гр и 7,25 Гр относительно контроля. При этом количество клеток в раннем апоптозе для доз 6,4 Гр и 7,25 Гр относительно контроля увеличилось в 2,5 и 3,8 раза (p<0,005) соответственно, количество клеток в позднем апоптозе увеличилось в 2,1 и 2,2 раза (p<0,005) соответственно, количество мертвых клеток увеличилось в 4,0 и 3,0 раза (p<0,005) соответственно.
Оценка количества клеток, находящихся на различных фазах клеточного цикла (ДНК-цитометрия), показала, что статистически значимо повторное облучение не влияло на количество опухолевых клеток в фазе G1 и S, но приводило к увеличению количества клеток в фазе G2 в 3,2 и 6,8 раза (p<0,05) соответственно при дозах 6,4 Гр и 7,25 Гр относительно контроля (табл. 2).
Таблица 2
Оценка клеточного цикла линии PC-3 после облучения (Этап 2)
|
Исследуемый образец |
% клеток на стадии |
||
|
G1 |
G2 |
S |
|
|
Контроль |
56,59 |
8,00 |
35,41 |
|
6,4 Гр |
47,42 |
25,78 |
26,80 |
|
7,25 Гр |
22,75 |
54,30 |
22,95 |
У эукариот клеточный цикл состоит из периода клеточного роста (интерфаза: синтез ДНК и белков, подготовка к делению клетки) и периода клеточного деления (М-фаза). В интерфазе выделяют три стадии: G1-фаза (синтез мРНК, белков и других клеточных компонентов), S-фаза (репликация ДНК в ядре клетки), G2-фаза (подготовка к митозу). В М-фазе выделяют стадию кариокинеза (деление клеточного ядра) и стадию цитокинеза (деление цитоплазмы) [12].
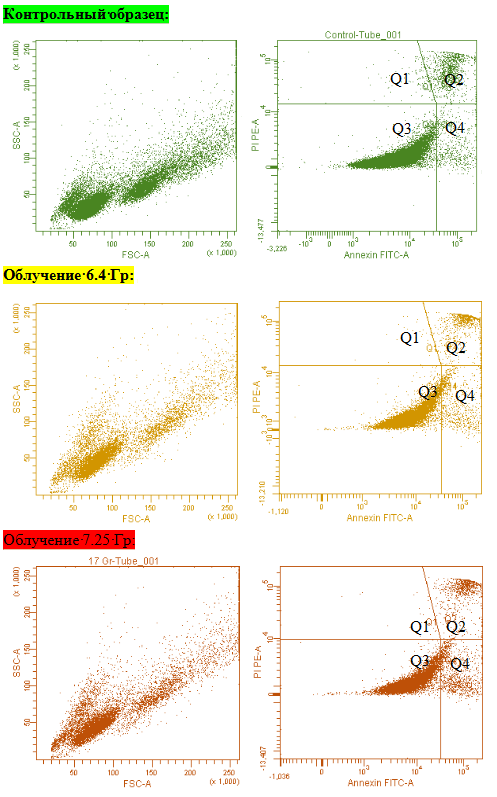
Рис. 5. Оценка апоптоза с помощью аннексинового теста
Примечание: *На левом графике представлены неокрашенные клетки, различающиеся по размеру и гранулярности; на правом графике – окрашенные пропидием и аннексином клетки.
· Q-1 – мертвые клетки (окрашены пропидием).
· Q-2 – клетки на стадии позднего апоптоза (окрашены пропидием и аннексином).
· Q-3 – живые клетки (не окрасились ни аннексином, ни пропидием).
· Q-4 – клетки на стадии раннего апоптоза (окрашены только аннексином).
Таким образом, второй этап облучения опухолевых клеток предстательной железы на линейном ускорителе частиц Novalis TX в дозах 6,4 и 7,25 Гр не приводит к значительному снижению общего количества клеток и их жизнеспособности, что можно объяснить формированием и последующим увеличением количества радиорезистентных клонов, выживших после первого этапа облучения.
Также была проведена оценка эффективности однократного облучения в дозах 15,0 Гр и 17,0 Гр на клетки PC-3. Однократное облучение клеток на линейном ускорителе частиц в дозах 15,0 и 17,0 Гр не вызвало статистически значимого снижения количества живых клеток через 60 мин после воздействия (рис. 6).
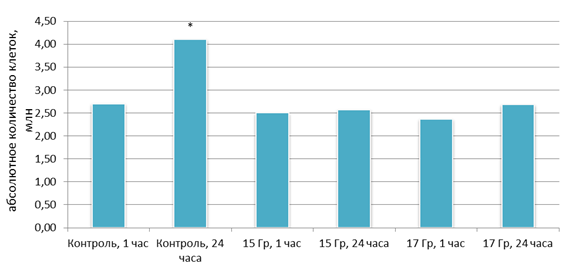
Рис. 6. Количество живых клеток после однократного облучения в дозах 15 и 17 Гр
Однако в контрольных флаконах через 24 ч обнаружено увеличение количества живых клеток в 1,5 раза (p<0,05), а в облученных флаконах статистически значимого изменения количества живых клеток не обнаружено. Результаты оценки апоптоза с помощью аннексинового теста представлены в таблице 3.
Таблица 3
Оценка апоптоза с помощью аннексинового теста после облучения 15 и 17 Гр (Этап 1)
|
Исследуемый образец |
Ann V(–) PI(–), % |
Ann V(+) PI(–), % |
Ann V(+)PI(+), % |
Ann V(–) PI(+), % |
|
Контроль (1 ч) |
91,7 |
4,3 |
3,9 |
0,1 |
|
15,0 Гр (1 ч) |
88,3 |
3,2 |
8,1 |
0,4 |
|
17,0 Гр (1 ч) |
88,2 |
4,9 |
6,6 |
0,3 |
|
Контроль (24 ч) |
98,4 |
0,3 |
0,9 |
0,4 |
|
15,0 Гр (24 ч) |
85,1 |
4,2 |
10,1 |
0,6 |
|
17,0 Гр (24 ч) |
81,1 |
6,2 |
11,6 |
1,1 |
Применение аннексинового теста показало, что через 1 ч после облучения в дозах 15 и 17 Гр количество живых клеток и клеток в раннем апоптозе относительно контроля не изменилось, однако зафиксировано увеличение количества клеток на стадии позднего апоптоза и количества мертвых клеток в 2,1 и 4,0 раза (p<0,05) соответственно для дозы 15 Гр и в 1,7 и 3,0 раза (p<0,05) соответственно для дозы 17 Гр. Через 1 день после воздействия доз 15 Гр и 17 Гр количество живых клеток относительно контроля также не изменилось, но количество клеток на стадии раннего и позднего апоптоза и количество мертвых клеток статистически значимо (p<0,05) увеличилось в 14,0, 11,2 и 1,5 раза соответственно для дозы 15 Гр и в 20,7, 12,9 и 2,8 раза соответственно для дозы 17 Гр.
ДНК-цитометрия показала, что статистически значимо однократное облучение не влияло на количество опухолевых клеток в фазе G1 и G2, но через 24 ч приводило к уменьшению количества клеток в фазе S в 1,4 и 1,5 раза (p<0,05) соответственно при дозах 15 Гр и 17 Гр относительно контроля (табл. 4).
Таблица 4
Оценка клеточного цикла PC-3 после облучения 15 и 17 Гр (этап 1)
|
Исследуемый образец |
% клеток |
||
|
G1 |
G2 |
S |
|
|
Контроль |
56,59 |
8,00 |
35,41 |
|
15,0 Гр (1 ч) |
47,42 |
15,78 |
36,80 |
|
17,0 Гр (1 ч) |
42,75 |
14,30 |
42,95 |
|
15,0 Гр (24 ч) |
53,42 |
20,78 |
25,80 |
|
17,0 Гр (24 ч) |
55,75 |
21,30 |
22,95 |
Обобщая полученные данные, можно констатировать следующий факт: несмотря на то, что облучение в дозах 15 и 17 Гр не вызывает значительной гибели опухолевых клеток, эффект от облучения проявляется в остановке пролиферации и клеточного цикла (отсутствии прироста клеточной массы и снижении количества клеток на стадии S) и активации апоптоза у части клеток.
Однако через 120 ч культивирования количество опухолевых клеток, подвергнутых облучению в дозах 15 и 17 Гр, достигло 5,0 и 4,5 млн соответственно. Клетки были пересеяны и во флаконах, содержащих по 4 млн опухолевых клеток, подвергнуты повторному облучению. Повторное облучение в дозах 15 и 17 Гр вызвало снижение количества живых клеток в 4,0 раза (через 1 ч) и 19,9 раза (через 24 ч) для дозы 15 Гр и снижение количества живых клеток в 5,5 раза (через 1 ч) и 7,7 раз (через 24 ч) для дозы 17 Гр (рис. 7).
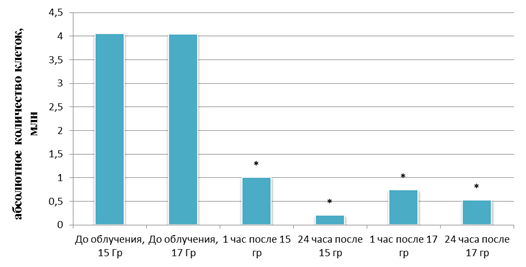
Рис. 7. Количество живых клеток PC-3 после повторного облучения в дозах 15 и 17 Гр.
* – статистически значимые отличия от уровня клеток до облучения (p<0,05)
Применение аннексинового теста показало, что через 1 ч после повторного облучения в дозах 15 Гр и 17 Гр количество живых клеток относительно контроля не изменилось. Количество клеток PC-3, находящихся на стадиях раннего и позднего апоптоза, увеличилось в 4,4 и 1,6 раза (p<0,05) соответственно для дозы 15 Гр и в 6,1 и 1,8 раза (p<0,05) соответственно для дозы 17 Гр. Количество мертвых клеток также статистически значимо (p<0,05) увеличилось в 6,0 раза для дозы 15 Гр и в 5,0 раза для дозы 17 Гр. Через 24 ч после облучения второго этапа в дозах 15 Гр и 17 Гр количество живых клеток относительно контроля также не изменилось, но количество клеток на стадии раннего и позднего апоптоза и количество мертвых клеток статистически значимо (p<0,05) увеличилось в 5,3, 2,8 и 9,0 раза соответственно для дозы 15 Гр и в 4,8, 2,6 и 16,0 раза соответственно для дозы 17 Гр (табл. 5).
Таблица 5
Оценка апоптоза с помощью аннексинового теста после облучения 15 и 17 Гр (этап 2)
|
Исследуемый образец |
Ann V(–) PI(–), % |
Ann V(+) PI(–), % |
Ann V(+) PI(+), % |
Ann V(–) PI(+), % |
|
контроль 1* |
95.1 |
1.1 |
3.7 |
0.1 |
|
15,0 Гр (1 ч) |
88,8 |
4,8 |
5,8 |
0,6 |
|
15,0 Гр (24 ч) |
82,8 |
5,8 |
10,5 |
0,9 |
|
контроль 2* |
94,1 |
1,5 |
4,3 |
0,1 |
|
17,0 Гр (1 ч) |
82,7 |
9,2 |
7,6 |
0,5 |
|
17,0 Гр (24 ч) |
80,1 |
7,2 |
11,1 |
1,6 |
* контроль 1 – для флаконов, облученных в дозе 15,0 Гр, контроль 2 – для флаконов, облученных в дозе 17,0 Гр
При этом оценка количества клеток, находящихся на различных фазах клеточного цикла, показала, что статистически значимо повторное облучение не влияло на количество опухолевых клеток в фазе G1 и S через 1 ч после облучения, но приводило к уменьшению количества клеток в фазе G2 в 1,6 и 2,1 раза (p<0,05) соответственно при дозах 15 Гр и 17 Гр относительно контроля (табл. 6). Максимальные изменения числа клеток, находящихся на различных фазах клеточного цикла, были обнаружены через 24 ч после повторного облучения: увеличение количества клеток в G1 в 1,4 раза (p<0,05) (для 15 и 17 Гр), снижение клеток в G2 в 1,8 и 2,7 раза (p<0,05) для 15 и 17 Гр соответственно, снижение количества клеток в S-фазе в 2,5 и 2,6 раза (p<0,05) для 15 и 17 Гр соответственно.
Таблица 6
Оценка клеточного цикла PC-3 после облучения 15 и 17 Гр (этап 2)
|
Исследуемый образец |
% клеток |
||
|
G1 |
G2 |
S |
|
|
Контроль |
61,19 |
9,00 |
29,81 |
|
15,0 Гр (1 ч) |
62,02 |
5,78 |
32,20 |
|
15,0 Гр (24 ч) |
83,12 |
5,12 |
11,76 |
|
17,0 Гр (1 ч) |
63,95 |
4,30 |
31,75 |
|
17,0 Гр (24 ч) |
85,01 |
3,30 |
11,69 |
С использованием дозы 21 Гр в модельном эксперименте были получены аналогичные результаты. Однократное облучение на Novalis TX клеток PC-3 в дозе 21 Гр не привело к значительному снижению количества живых клеток через 1 ч после облучения (рис. 8). Однако в контрольных флаконах через 24 ч обнаружено увеличение количества живых клеток в 1,5 раза (p<0,05), а в облученных флаконах статистически значимого увеличения количества живых клеток не обнаружено, наоборот, через 24 ч после облучения обнаружено снижение количества клеток в 1,9 раза (p<0,05) относительно соответствующего контроля. Результаты оценки апоптоза с помощью аннексинового теста представлены в таблице 7.
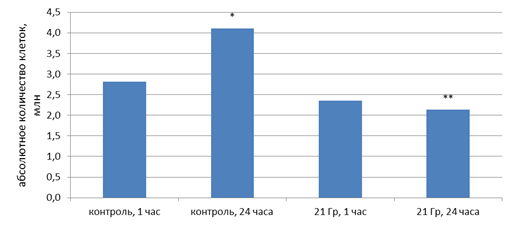
Рис. 8. Количество живых клеток после однократного облучения в дозе 21 Гр
Таблица 7
Оценка апоптоза с помощью аннексинового теста после облучения 21 Гр
|
Образец и этап исследования |
Ann V(–)PI(–), % |
Ann V(–) PI(+), % |
Ann V(+) PI(–), % |
Ann V(+) PI(+), % |
|
Контроль |
98,4 |
0,4 |
0,3 |
0,9 |
|
21 Гр – 1-й этап |
86,2 |
5,9 |
5,4 |
2,5 |
|
21 Гр – 2-й этап |
75,9 |
7,6 |
7,7 |
8,8 |
Применение аннексинового теста показало, что через 1 день после повторного облучения в дозе 21 Гр количество живых клеток относительно контроля не изменилось. Количество клеток на стадии раннего и позднего апоптоза, а также количество мертвых клеток статистически значимо (p<0,05) увеличилось в 18,0, 2,8 и 14,8 раза соответственно. При этом оценка количества клеток, находящихся на различных фазах клеточного цикла, показала, что статистически значимо облучение не влияло на количество опухолевых клеток в фазе G1 и S через 24 ч после облучения, но клеток в фазе G2 после облучения в этой дозе не было обнаружено вообще (табл. 8).
Таблица 8
Оценка клеточного цикла после облучения 21 Гр
|
Образец |
% |
|
||
|
|
||||
|
G1 |
G2 |
S |
||
|
|
|
|
||
|
Контроль |
56,59 |
8,00 |
35,41 |
|
|
21 Гр – 1-й этап |
64,31 |
0,00 |
35,69 |
|
|
21 Гр – 2-й этап |
94,61 |
0,00 |
5,39 |
|
Повторное облучение в дозе 21 Гр привело к статистически значимому снижению количества живых клеток в 1,6 раза (p<0,05) через 1 ч и в 3,7 раза (p<0,05) через 24 ч (рис. 9).
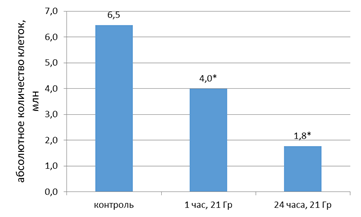
Рис. 9. Количество живых клеток после повторного облучения в дозе 21 Гр.
* – статистически значимые отличия от уровня клеток в контроле (p<0,05)
С использованием аннексинового теста было установлено, что через 1 день после повторного облучения в дозе 21 Гр количество живых клеток относительно контроля снизилось в 1,3 раза (p<0,05), количество клеток на стадии раннего и позднего апоптоза увеличилось в 25,7 (p<0,05) и 9,8 раза (p<0,05) соответственно, а количество мертвых клеток увеличилось в 19,0 раза (табл. 7). При этом оценка количества клеток, находящихся на различных фазах клеточного цикла, показала, что статистически значимо повторное облучение в дозе 21 Гр увеличило количество опухолевых клеток в фазе G1 в 1,7 раза (p<0,05), а в фазе S снизило в 6,6 раза (p<0,05) через 24 ч после облучения (табл. 8).
Заключение
Таким образом, ежедневное (5 дней подряд) воздействие облучения линейного ускорителя частиц в дозах 6,4 Гр и 7,25 Гр на опухолевые клетки предстательной железы (PC-3) вызывает гибель значительной части клеток-мишеней, но повторное облучение этими же дозами способствует проявлению эффекта радиорезистентности. Однократное облучение в дозах 15, 17 и 21 Гр обладает менее выраженным элиминирующим эффектом на клетки, однако при повторном облучении через 120 ч эффект усиливается, а радиорезистентность опухолевых клеток не проявляется.
Исследование выполнено в рамках гос. задания «Поиск молекулярно-генетических предикторов радиорезистентного рака предстательной железы и разработка персонифицированных терапевтических подходов»
Библиографическая ссылка
Кутилин Д.С., Зинькович М.С., Гусарева М.А., Солнцева А.А., Фатькина Н.Б., Карнаухова Е.А., Крохмаль Ю.Н., Васильева Е.О., Розенко Л.Я., Донская А.К. ПОИСК НОВЫХ АЛГОРИТМОВ ОБЛУЧЕНИЯ ОПУХОЛЕВЫХ КЛЕТОК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ НА ЛИНЕЙНОМ УСКОРИТЕЛЕ ЧАСТИЦ, ПОЗВОЛЯЮЩИХ ПРЕОДОЛЕТЬ ФОРМИРОВАНИЕ РАДИОРЕЗИСТЕНТНОСТИ. // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30940 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.30940



