Больные, страдающие сахарным диабетом II типа (СД), являются группой высокого риска развития инфекций мочевыводящих путей (ИМП) [1; 2]. Так, заболеваемость ИМП среди пациентов с СД составляет 46,9 на 1000 в сравнении с показателем у пациентов, не имеющих СД - 29,9 на 1000 [3; 4]. Высокий риск развития ИМП у больных СД обусловлен нарушением процессов микроциркуляции, формированием иммуносупрессии, развитием диабетической нефропатии, а также нейропатии мочевого пузыря с нарушением пассажа мочи [3].
Так, почти у 80% больных СД формируется диабетическая нефропатия (ДН), возможным результатом которой является развитие тяжелой почечной недостаточности (ХБП 4-5) [5]. Также к развитию ИМП у больных СД предрасполагают глюкозурия, сниженная антибактериальная активность мочи, нарушение защитной способности нейтрофилов [2; 3].
Огромная роль в развитии СД принадлежит иммунной дизрегуляции и воспалительному процессу, что сопровождается гиперпродукцией провоспалительных цитокинов, которые способствуют формированию инсулинорезистентности, гипергликемии (чаще постпрандиальной), участвуют в развитии микроангиопатии, нефропатии и др. [6; 7]. Это ведет к хронизации ИМП, снижению функции почек, что, в свою очередь, утяжеляет течение СД и ухудшает прогноз заболевания [6]. Огромное влияние на течение ИМП у больных СД оказывает состояние фагоцитов, прежде всего – нейтрофилов, которым принадлежит важная роль в интегративном ответе иммунной системы при инфекционно-воспалительных заболеваниях [8].
Большое значение в связи с этим отводится противовоспалительным цитокинам, в частности интерлейкину 4 (IL4) [6]. IL4 продуцируется Т-хелперами, тучными клетками, базофилами, эозинофилами, стромальными клетками костного мозга и др. [6]. IL4 является ключевым регулятором гуморального и адаптивного иммунитета, оказывает стимулирующее воздействие на пролиферацию и дифференцировку активированных Т- и В-лимфоцитов, синтез антител, повышает активность фагоцитов, синтез колониестимулирующих факторов, лейкопоэз, оказывает выраженное противовоспалительное действие [6].
Все вышеизложенное обосновывает необходимость включения иммуномодуляторов в схемы терапии пациентов, страдающих ИМП на фоне СД [9].
Учитывая этиопатогенетические аспекты развития и течения ИМП у больных СД, в качестве иммуномодулятора был использован ликопид (Лп). Лп стимулирует функциональную активность фагоцитов (ФАН), усиливает антигенпрезентирующую функцию макрофагов, пролиферацию Т- и B-лимфоцитов [10].
Установлена эффективность Лп в лечении заболеваний, сопровождающихся формированием иммуносупрессии [10]. Показано, что применение Лп способствует снижению уровня провоспалительных цитокинов (IL-1ß, IL-6 и TNF–α) [10].
Цель исследования: оценить воздействие Лп на содержание IL4 и ФАН у пациентов, страдающих СД и ИМП.
Материалы и методы исследования
Обследовано 155 чел., распределенных на следующие группы: группа «СД» - больные СД, группа «ИМП» - больные ИМП, группа «СД+ИМП» - больные СД и ИМП, группа «СД+ИМП+Лп» - больные СД и ИМП, получавшие иммуномодулятор Лп (табл. 1). Пациенты с СД, ИМП, СД с ИМП получали терапию в соответствии с действующими стандартами лечения [11; 12], а больные в группе «СД+ИМП+Лп» - дополнительно принимали Лп (10 мг 1 раз в сутки, 10 дней (ООО научно-производственное предприятие «Пептек ЗАО, Россия»)). Также в исследование была включена группа «Здоровые» - без признаков (анамнестических, клинических) СДII, ИМП и других заболеваний (таблица).
Характеристика групп пациентов
|
Показатели |
Здоровые |
СД |
ИМП |
СД+ИМП |
СД+ИМП+Лп |
|
|
|
Абс. (%) |
|
|
|
|
|
|
Количество пациентов (n) |
35 |
31 |
32 |
30 |
27 |
|
|
Пол |
М |
11 (31,4%) |
14 (45,2%) |
15 (42,86%) |
10 (33,3%) |
3 (11,1%) |
|
Ж |
24 (68,6%) |
17 (54,8%) |
20 (57,14%) |
20 (66,7%) |
24 (88,9%) |
|
|
Возраст (лет) |
43,0 [39,0-50,0] |
60,0 [53,0-63,0] |
56,0 [47,0-63,0] |
56,50 [50,0-61,0] |
60,0 [53,0 – 64,0] |
|
|
Индекс массы тела (кг/м2) |
24,80 [22,50-25,80] |
29,60 [27,40-34,90] |
27,05 [23,50-28,60] |
32,0 [28,60-33,50] |
32,65 [29,10-37,0] |
|
|
АД |
сАД |
110 [110,0 – 120,0] |
140 [120,0 – 150,0] |
117 [110,0 – 120,0] |
140 [130,0 – 150,0] |
130 [120,0 – 160,0] |
|
дАД |
70,0 [70,0 – 80,0] |
80,0 [80,0 – 90,0] |
72,5 [70,0 – 80,0] |
80,0 [80,0 – 90,0] |
80,0 [80,0 – 90,0] |
|
|
Стаж СДII (лет) |
- |
9,50 [6,0-12,0] |
- |
9,0 [8,0-11,0] |
6,50 [5,0 – 11,0] |
|
|
Стаж ИМП (лет) |
- |
- |
9,0 [7,0 – 10,0] |
9,0 [7,0 – 11,0] |
9,0 [7,0 – 11,0] |
|
Верификацию диагноза у пациентов осуществляли на основании «Алгоритмов специализированной медицинской помощи больным сахарным диабетом» (8-й выпуск, 2017 г.). Основание: данные анамнеза, результаты клинических и лабораторных исследований (определение базального и суточного уровня глюкозы в сыворотке крови, а также - в суточной порции мочи, содержания HbA1c), консультативные заключения офтальмолога и невролога.
Критерии включения:
|
• возраст |
• старше 18 лет |
|
• диагноз СД II |
• ранее установленный |
|
• лабораторные данные |
• гликемия натощак<7,0 ммоль/л • гликемия постпрандиальная<19,0 ммоль/л • HbA1<7%) |
|
• диагноз ИМП (пиелонефрит) |
• подтвержденный |
Каждый пациент подписывал информированное согласие на включение в исследование и соблюдение этических принципов.
Во всех группах определяли: уровень IL-4 методом иммуноферментного анализа (тест-система ЗАО «Вектор-Бест», г. Новосибирск), интенсивность оксидантного метаболизма нейтрофилов (спонтанный и индуцированный НСТ-тест - НСТсп, НСТинд) и ФАН [13].
Результаты регистрировали на 1-м визите (до лечения), а в группах «СД+ИМП» и «СД+ИМП+Лп» - на 2-м (через 2 недели), 3-м (через 4 недели) и 4-м визитах (через 8 недель лечения).
Статистическую обработку проводили с помощью методов вариационной статистики [14], пакета программ Statistica 10.0. Нормальность распределения данных определяли с использованием критерия Шапиро-Вилка. Оценку значимости различий определяли, вычисляя медиану и межквартильный интервал, дисперсионный анализ - с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использовали Q-критерий Дана. Критический уровень значимости р для статистических критериев принимали равным 0,05.
Результаты исследования и их обсуждение
Уровень IL4 в группах «СД» и «ИМП» был статистически значимо выше такового в группе «Здоровые» (p=0,00076 и p=0,00053 соответственно) (рис. 1).
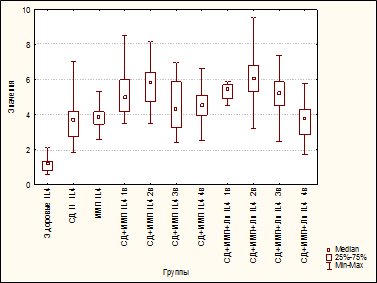 |
Рис. 1. Уровень IL4 (пг/мл) у здоровых, больных сахарным диабетом, больных инфекцией мочевых путей, больных сахарным диабетом и инфекцией мочевых путей, больных сахарным диабетом и инфекцией мочевых путей и получавших ликопид
Как и в предыдущих исследованиях, у больных СД отмечалось снижение интенсивности образования активных форм кислорода (АФК) как в НСТсп, так и в НСТинд (рис. 2) [15]. Это сочеталось с подавлением ФАН: в 3,75 раза по сравнению с группой «Здоровые» (p≤0,00001), и в 3,2 раза – с группой «ИМП» (p≤0,00001) (рис. 2) [15]. Эти результаты согласуются с данными других авторов и подтверждают дисфункциональное состояние фагоцитов у больных СД [7].
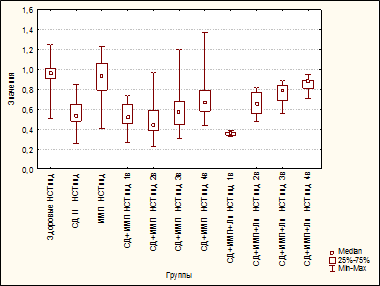 |
Рис. 2. Интенсивность кислородзависимого метаболизма ПМЯЛ в индуцированном НСТ-тесте у здоровых, больных сахарным диабетом, больных инфекцией мочевых путей, больных сахарным диабетом и инфекцией мочевых путей, получавших ликопид
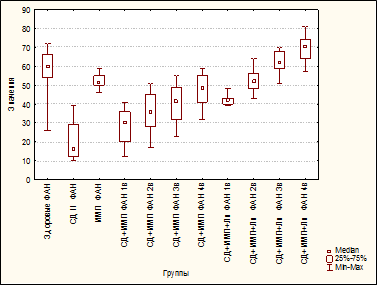 |
Рис. 3. Фагоцитарная активность нейтрофилов у здоровых, больных сахарным диабетом, больных инфекцией мочевых путей, больных сахарным диабетом и инфекцией мочевых путей, больных сахарным диабетом и инфекцией мочевых путей, получавших ликопид
В группе больных СД с ИМП уровень IL4 до лечения (1-й визит) и через 2 недели лечения (2-й визит) был почти в 2 раза выше, чем у больных СД без ИМП (p=0,01205, p=0,00041 соответственно) и в 2 раза ниже, чем у больных ИМП (p=0,00771, p=0,00022 соответственно) (рис. 1). Через 4 и 8 недель от начала лечения уровень IL4 не отличался от такового в группе «СД» (p=1,0000 и p=1,0000). При этом, как и в группе больных «СД», уровень IL4 в группе «СД+ИМП» на все сроки наблюдения был статистически значимо выше, чем в группе «Здоровые» (рис. 1).
Ранее было показано, что в группе «СД+ИМП» идентично изменялась интенсивность образования АФК в НСТсп: сохранялась на уровне таковой в группе «СД», будучи статистически значимо ниже таковой в группах «ИМП» (в т.ч. в остром периоде заболевания) и «Здоровые» вплоть до 4-го визита (рис. 2). К 4-му же визиту интенсивность образования АФК повышалась до уровня показателей в группах «ИМП» и «Здоровые» (рис. 2) [15].
В условиях же индукции интенсивность кислородзависимого метаболизма ПМЯЛ на протяжении первых трех визитов была статистически значимо ниже аналогичных показателей в группах «ИМП» и «Здоровые», оставаясь на одном уровне с показателями в группе «СД». И лишь к 4-му визиту интенсивность образования АФК повышалась, оставаясь почти на 30% ниже таковой в группах «ИМП» и «Здоровые» [15].
Идентично изменялись показатели ФАН: в острый период (1-й визит) ФАН вдвое превышала показатель в группе «СД», оставаясь статистически значимо ниже вплоть до 4-го визита, чем в группах «ИМП» и «Здоровые» (рис. 3) [15]. Только к 8-й неделе от начала терапии уровень ФАН возрастал до уровня такового в группах «ИМП» (p=1,0000) и «Здоровые» (p=0,45198) (рис. 3).
Эти данные свидетельствуют о подавлении микробицидного потенциала ПМЯЛ у больных СДII с ИМП, что существенно снижает результативность терапии и способствует длительному течению ИМП.
В группе больных «СД+ИМП+Лп» уровень IL4 как до лечения (1-й визит), так и в процессе лечения (2-й, 3-й визиты) был статистически значимо выше аналогичного показателя в группах «СД» (p=0,00255, p=0,00002, p=0,03383 на 1, 2 и 3-й визиты) и «ИМП» (p=0,00155, p=0,00001, p=0,02329 на 1, 2 и 3-й визиты) (рис. 1), снижаясь к 4-му визиту до уровня больных СДII без ИМП (p=1,0000) (рис. 1). Динамика уровня IL4 в группе «СД+ИМП+Лп» не имела существенных отличий от таковой в группе «СД+ИМП» (рис. 1).
В группе «СД+ИМП+Лп» интенсивность образования АФК в НСТсп как до лечения, так и через 2 недели не превышала показателей у больных СД без ИМП, значимо превышая ее на 3-й и 4-й визиты (p=0,00133, p≤0,00001 - на 3-й и 4-й визиты) (рис. 2). И, напротив, в начале наблюдения интенсивность образования АФК в группе «СД+ИМП+Лп» была статистически значимо ниже таковой в группах «ИМП» (p≤0,00001, p=0,00005 - на 1-й и 2-й визиты) и «Здоровые» (p≤0,00001, p=0,00018 - на 1-й и 2-й визиты), повышаясь на 3-й и 4-й визиты до уровня показателей в группах «ИМП» (p=0,24825, p=1,0000 соответственно) и «Здоровые» (p=0,48912, p=1,0000 соответственно) (рис. 2). Вместе с тем динамика показателей НСТсп в группе «СД+ИМП+Лп» не имела отличий от показателей в группе «СД+ИМП».
В условиях же индукции применение Лп обеспечило повышение интенсивности образования АФК на 3-й и 4-й визиты до уровня в группе «Здоровые» (p=0,61042, p=1,0000), статистически значимо превышая уровень образования АФК в НСТинд у больных СД без ИМП (p=0,00714 и p≤0,00001 соответственно) (рис. 2).
Изменение показателей оксидантного метаболизма ПМЯЛ в группах «СД+ИМП+Лп» и «СД+ИМП» выявило, что на 2-й и 3-й визиты, интенсивность образования АФК в группе «СД+ИМП+Лп» превышала таковую в группе «СД+ИМП» более чем на 20% (p=0,04766 и p=0,01488 соответственно) (рис. 2). Через 8 недель от начала терапии интенсивность образования АФК в группе «СД+ИМП+Лп» превышала таковую в группе «СД+ИМП» почти на 20%, не достигая, однако, статистической значимости (рис. 2). Это свидетельствует о значительном улучшении микробицидного потенциала нейтрофильных гранулоцитов у больных СДII с ИМП, получавших Лп, и предполагает большую результативность антимикробной и противовоспалительной терапии.
Включение Лп в стандартную схему лечения ИМП у больных СД привело к статистически значимому увеличению ФАН в сравнении с группой «СД» - начиная со 2-й недели (p=0,02257, p≤0,00001 - на 2, 3 и 4-й визиты) (рис. 3). В сравнении с группой «ИМП» показатели ФАН на первых трех визитах в группе «СД+ИМП+Лп» не отличались, а к 4-му визиту – статистически значимо превышали их (p=0,00257) (рис. 3).
Следует подчеркнуть, что уже через 2 недели от начала терапии в группе «СД+ИМП+Лп» показатели ФАН были статистически значимо выше таковых в группе «СД+ИМП» (p=0,00137 через 2 недели и p≤0,00001 – через 4 и 8 недель) (рис. 3). Более того, начиная со 2-го визита фагоцитарная активность в группе «СД+ИМП+Лп» достигала уровня таковой в группе «Здоровые» (p=1,000 – на 2-й и 3-й визиты, p=0,16170 – на 4-й визит) (рис. 3).
Полученные данные согласуются с известной способностью Лп повышать неспецифическую резистентность, фагоцитарную и бактерицидную способность фагоцитов, а также с его эффективностью в лечении гнойно-воспалительных и гнойно-септических заболеваний [10].
Резюмируя, можно отметить, что добавление Лп к стандартной схеме лечения больных СД с ИМП способствовало нормализации уровня IL4, восстановлению биоцидного потенциала и увеличению поглотительной активности нейтрофильных гранулоцитов.
Результаты исследования позволяют заключить, что добавление Лп к стандартной терапии ИМП у больных СД корректирует иммунный дисбаланс и существенно улучшает функциональное состояние нейтрофильных гранулоцитов.
Выводы
1. У больных в группе «СД» выявлено повышение уровня IL4, снижение функциональной активности нейтрофилов (фагоцитарная способность, микробицидный потенциал).
2. У больных в группе «СД+ИМП» на фоне стандартной терапии наблюдается высокий уровень IL4, подавление кислородзависимого метаболизма и фагоцитарной активности нейтрофилов.
3. Включение ликопида в стандартную терапию больных СД с ИМП не изменяет уровень IL4, восстанавливает микробицидную способность и повышает фагоцитарную активность нейтрофильных гранулоцитов.



