Тяжесть острого гематогенного остеомиелита и клинические проявления данного заболевания у детей достаточно разнообразны и прямо или косвенно зависят от очень многих условий (факторов): иммунологической реактивности макроорганизма, вирулентности микроорганизма, возраста ребенка, обширности и локализации поражения, сроков от начала заболевания и объема предшествующего (если таковое имело место) лечения [1, 2]. Острый гематогенный остеомиелит с позиций физиологии и патологической физиологии является частным вариантом инфекционного иммунозависимого воспаления [3, 4]. Инфекционно-зависимое иммунное воспаление в свою очередь рассматривается как частный вариант взаимодействия микро- и микроорганизмов. При этом иммуновоспалительный процесс может быть вызван не только внешней (патогенной) микрофлорой, но и активацией условно-патогенной микрофлоры в условиях снижения механизмов поддержания «иммунного гомеостаза» и невосприимчивости макроорганизма [5, 6].
Дисбаланс синтеза не только простагландинов и гормонов, но и цитокинов (интерлейкинов) и компонентов системы комплемента как проявление нарушений механизмов поддержания иммунного гомеостаза провоцирует развитие как поздних гнойных осложнений, так и в первую очередь хронического остеомиелита. Участие интерлейкинов в прогрессировании иммуновоспалительной реакции опосредуется их ролью в качестве селективных медиаторов межклеточных взаимодействий с дальнейшим образованием иммунных комплексов и антител [7-9].
Недостаточной эффективности проводимого комплексного консервативного и оперативного лечения острого гематогенного остеомиелита в детском возрасте во многом способствует не только позднее установление правильного диагноза (зачастую после 48–72 часов) и, как следствие, несвоевременное применение активной хирургической тактики в лечении, чаще уже в стадии развивающегося или развившегося сепсиса, с угрозой жизни ребенка и/или развития ранних и поздних осложнений, приводящих в последующем к глубокой инвалидизации ребенка, но и недостаточно полная коррекция иммунологических показателей, к которым в первую очередь относятся система цитокинов, комплемента и активность полиморфноядерных лейкоцитов периферической крови [10, 11]. Проблема сепсиса при осложнениях из-за поздней диагностики острого гематогенного остеомиелита в детском возрасте является сегодня одной из важных и актуальных в детской хирургии [9, 11].
Из-за недостаточного количества работ, посвященных изучению и разработке эффективных средств и способов иммунореабилитации у детей с острым гематогенным остеомиелитом [1, 5, 6], целью данного исследования стало определение иммунокорригирующих эффектов лонгидазы в виде свечей у детей с местно-очаговой формой острого гематогенного остеомиелита.
Материал и методы
Под постоянным проспективным наблюдением находились 35 пациентов (средний возраст 9,7±1,4 лет) с местно-очаговой формой острого гематогенного остеомиелита (ОГО). Постановка диагноза ОГО (местная очаговая форма) основывалась на клинических рекомендациях «Острый гематогенный остеомиелит у детей» (2015): клиническая симптоматика, данные лабораторно-инструментальных методов обследования, интраоперационная картина.
При оценке локализации патологического процесса у детей с ОГО было выявлено, что наибольшее число детей было с поражением большеберцовой кости: 36% в 1-й группе. На втором месте по локализации патологического очага по частоте бедренная кость (32% случаев), на третьем месте – плечевая кость (18% детей).
В качестве контроля использовались показатели 18 детей (средний возраст 9,4±1,5 лет), у которых на момент осмотра отсутствовали признаки соматических и хирургических заболеваний.
Всем пациентам проводились предоперационная подготовка, оперативное пособие (наложение остеоперфоративных отверстий и санация гнойного очага) и ведение в раннем и позднем послеоперационном периодах (цефотаксим с амикацином и метронидазолом с изменением антибактериальной схемы по результатам посева и определения чувствительности флоры из отделяемого из остеоперфоративных отверстий, инфузионная и противогрибковая терапия). Кроме этого, 17 детей (2-я группа) дополнительно получали препарат «Лонгидаза» в свечах (3 000 МЕ с третьих суток 5 свечей ректально каждые 72 часа).
Забор и лабораторное обследование биологического материала (плазмы крови) проводились в первые сутки поступления (до оперативного пособия), через 48 часов после наложения остеоперфоративных отверстий и в конце третьей недели от поступления (на 21-е сутки). С помощью набора реагентов ProCon (ООО «Протеиновый контур», г. Санкт-Петербург) определяли уровень ИЛ-4, С3-, С4-компонентов системы комплемента, ИЛ-1β, фактора Н, ИЛ-8, С1-инг., ФНОα, ИЛ-10 в плазме крови методом твердофазного иммуноферментного анализа.
В качестве критериев активности и интенсивности фагоцитоза нейтрофилов периферической крови использовали процент фагоцитоза, фагоцитарное число, т.е. оценивалась фагоцитарная активность нейтрофилов. По реакции восстановления нитросинего тетразолия (спонтанного и стимулированного зимозаном) определяли значения НСТ-теста, т.е. определялась кислородзависимая активность нейтрофилов.
Полученные результаты обрабатывали с использованием методик описательной и вариационной статистики. По общепринятым критериям вариационно-статистического анализа проводили статистическую обработку результатов исследования с расчетом средних величин (M) и ошибки средней арифметической (m). Достоверность различий определяли по U-критерию. Статистически значимыми считали различия с p<0,05.
Результаты исследования
У детей с острым гематогенным остеомиелитом при поступлении в клинику в плазме крови выявлены выраженные изменения представительности про- и противовоспалительных цитокинов, проявляющиеся повышением концентрации ФНОα, ИЛ-1β, ИЛ-8, ИЛ-4, тогда как концентрация ИЛ-10 остается на уровне здоровых доноров (рис. 1).

Рис. 1. Иммунокорригирующая эффективность лонгидазы у детей
с острым гематогенным остеомиелитом
Примечание: * – p<0,05 по отношению к группе здоровых детей.
У данной категории пациентов в плазме крови установлено повышение концентрации С3-компонента системы комплемента и С1-ингибитора и фактора Н, а концентрация С4-компонента оказалась на уровне группы здоровых детей (рис. 1).
Проведенное оперативное лечение у детей с острым гематогенным остеомиелитом привело к еще большему изменению изученных показателей цитокинового звена иммунитета и системы комплемента: отмечается еще большее возрастание концентрации ФНОα, ИЛ-4 и С3-компонента системы комплемента (рис. 1).
У детей с острым гематогенным остеомиелитом при поступлении в стационар определяется снижение фагоцитарной активности нейтрофилов периферической крови, что проявляется снижением фагоцитарного индекса (ФИ) и фагоцитарного числа (ФЧ) (рис. 2).
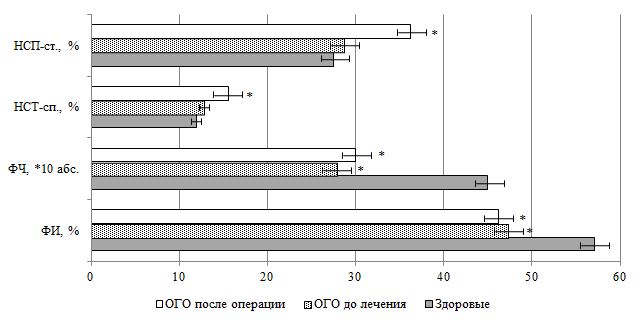
Рис. 2. Функционально-метаболическая активность нейтрофилов периферической крови
у детей с острым гематогенным остеомиелитом
Примечание: * – p < 0,05 по отношению к группе здоровых детей.
Сразу после оперативного лечения у детей с острым гематогенным остеомиелитом наблюдается возрастание кислородзависимой активности нейтрофилов периферической крови, что проявилось возрастанием показателей НСТ-теста спонтанного (НСТ-сп.) и стимулированного (НСТ-стим.) (рис. 2).
На 21-е сутки от поступления в стационар у детей с острым гематогенным остеомиелитом из 1-й группы имеют место нормализация уровня ИЛ-8, С3- и С4-компонента системы комплемента и коррекция концентрации С1-ингибитора и фактора Н, но не до уровня здоровых доноров.
У детей с острым гематогенным остеомиелитом, получавших препарат «Лонгидаза» в виде свечей ректально по 3 000 МЕ с 3-х суток от оперативного пособия каждые 72 часа 5 раз, уже к 21-м суткам нормализуется дополнительно функционально-метаболическая активность нейтрофилов периферической крови (фагоцитарную активность – ФИ, ФЧ; кислородзависимую активность – НСТ-сп. и НСТ-стим.), концентрацию регуляторов компонентов системы комплемента: уровень С1-ингибитора и фактора Н.
Обсуждение
В настоящий момент неоспоримыми являются данные, которые убедительно свидетельствуют о непосредственном участии каждого из компонентов цитокинового звена (про- и противовоспалительного), активных и регуляторных компонентов системы комплемента в работе основных звеньев поддержания иммунологического гомеостаза. Данные компоненты иммунной системы не только выступают в качестве активаторов и/или супрессоров тех или иных механизмов, но и стимулируют другие факторы иммунологической защиты организма, а также сдерживают избыточную активность специфических воспалительных реакций, предотвращая тем самым выработку аутоантител [10, 11].
Поэтому определение динамики концентрации провоспалительных и противовоспалительных интерлейкинов, активных компонентов системы комплемента и их регуляторов при различных видах патологических состояний служит важным маркером нарушений в иммунологической реактивности всего макроорганизма в целом [8, 10].
Полученные результаты оценки уровня цитокинов в плазме крови у детей с острым гематогенным остеомиелитом местно-очаговой формы свидетельствуют о дезадаптации механизмов поддержания иммунного гомеостаза у данной категории пациентов, поскольку в плазме крови уже при поступлении в стационар имеет место возрастание уровня провоспалительных цитокинов, тогда как компенсаторного повышения уровня ИЛ-10 не наблюдается. Кроме этого, у данной категории пациентов активируется система комплемента по классическому пути, о чем свидетельствует повышенная концентрация С3-компонента системы комплемента и С1-ингибитора, тогда как функциональная активность полиморфноядерных лейкоцитов в периферической крови снижена, и в первую очередь это касается их фагоцитарной активности, о чем свидетельствует максимальное снижение данного показателя.
Проводимое оперативное лечение с анестезиологическим обеспечением, безусловно, как и описано в современной литературе [2], ухудшает показатели иммунного гомеостаза, что и было выявлено через 48 часов от оперативного лечения, а стандартная фармакотерапия в послеоперационном периоде не оказывает в полной мере корригирующего влияния на измененные показатели иммунного статуса у детей с острым гематогенным остеомиелитом.
Фармакологический препарат «Лонгидаза» – конъюгат протеолитического фермента гиалуронидаза с высокомолекулярным носителем из группы производных N-оксида поли-1,4-этиленпиперазина [9]. Согласно аннотации к препарату лонгидаза регулирует (модулирует) синтез в первую очередь медиаторов воспаления (цитокинов – ИЛ-1 и ФНОα), тем самым нивелирует течение острой фазы иммунного воспаления, повышая показатели гуморального иммунного ответа и иммунологическую резистентность макроорганизма к инфекции. Полученные в данных исследованиях результаты об эффективности использования препарата «Лонгидаза» с целью нивелирования иммунных нарушений, которые обусловлены не только основным заболеванием, но и оперативным пособием и проводимым общим анестезиологическим пособием, позволяют рекомендовать его применение в лечении острого гематогенного остеомиелита у детей после хирургического пособия.
Выводы
Процесс развития иммунного ответа на внедрение инфекционного агента, который имеет место при остром гематогенном остеомиелите, сопровождается значительными изменениями представительности про- и противовоспалительных цитокинов, компонентов системы комплемента и активности нейтрофилов периферической крови. Под воздействием патогенного микроорганизма иммунокомпетентные клетки приспосабливаются к новым условиям и отвечают на это изменением экспрессией целого «букета» цитокинов и компонентов системы комплемента, что является одним из эффективных механизмов поддержания «хрупкого иммунного гомеостаза», что крайне важно и актуально в условиях детского организма [10, 11].
Таким образом, полученные в ходе проведенного исследования результаты свидетельствуют о выраженных изменениях цитокинового звена иммунитета, системы комплемента и функционально-метаболической активности нейтрофилов периферической крови у детей при местно-очаговой форме острого гематогенного остеомиелита, которые усугубляются проводимым оперативным лечением и анестезиологическим обеспечением.
Выявленные изменения иммунного статуса не полностью корригируются стандартной фармакотерапией, тогда как применение дополнительно препарата «Лонгидаза» в свечах позволило нивелировать изменения цитокинового звена иммунитета, системы комплемента и восстановить функционально-метаболическую активность нейтрофилов периферической крови. Это дало возможность выписать всех пациентов с выздоровлением, при проведенном дальнейшем динамическом наблюдении на протяжении 6 месяцев после выписки из стационара не было выявлено ни одного случая хронизации процесса.



