В последние десятилетия в придачу к «золотым стандартам» лабораторной диагностики нефропатий, таких как скорость клубочковой фильтрации (СКФ), микроальбуминурия, креатинин и мочевина, прибавился целый список индикаторов патологии почек, прежде всего за счет открытия уникальных биохимических маркеров повреждения почек [1-3], предназначенных для диагностики, мониторинга и оценки качества лечения острой и хронической нефропатии различного генеза. Эти биомаркеры, несущие специфическую информацию о функции почек на различных уровнях (клубочковая фильтрация, канальцевая реабсорбция), представляют собой низкомолекулярные белки или пептиды, фильтрующиеся в мочу, где они и определяются с помощью современных высокочувствительных методов иммунохимического анализа [3-5]. То есть при заболеваниях почек и мочевыводящих путей биохимический анализ мочи является более информативным, чем анализ крови [4; 6; 7].
Однако в экспериментах на животных для диагностики ранних нарушений функции почек кровь является более удобным объектом исследования, чем моча [8]. При этом после острого и хронического эксперимента в крови у лабораторных животных предпочтительней оценивать активность индикаторных ферментов, чем уровень видо- и органоспецифических почечных маркеров, определяемых иммунохимическими методами [8].
Среди ферментов мочи, имеющих только почечное происхождение, представляет интерес нейтральная α-глюкозидаза (НАГ), связанная со специфическими метаболическими процессами в петле Генле и в клетках эпителия проксимальных канальцев и отсутствующая в других морфологических образованиях почки (например, в клубочках) [3]. Однако из-за низкой активности этого фермента в сыворотке крови вопрос о связи сывороточной НАГ с дисфункцией почек в научной литературе не освещен.
Кроме того, любое повреждение паренхиматозного органа, в том числе и почки, влечет за собой системную воспалительную реакцию и острофазовый ответ, сопряженные с метаболическим взрывом в печени и развитием неспецифической гиперферментемии [8-10]. Еще более неопределенная ситуация с интерпретацией гиперферментемии возникает в случае взаимно отягощающего гепаторенального синдрома [9; 11].
Цель исследования – сравнить активность ряда ферментов в сыворотках крови кроликов после моделирования у них травматического или токсического повреждения почки и печени и отобрать среди них ферменты, наиболее характерные для острого повреждения почечной ткани.
Материалы и методы исследования. Эксперименты выполнены на 54 кроликах породы шиншилла в возрасте 0,5-1,5 лет и массой 1,5-2,0 кг в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием лабораторных животных» [8]. Животные были распределены на 2 опытные группы, подвергавшиеся оперативному воздействию, и 2 группы, на которых моделировали острые токсические повреждения (ОТП) печени и почки.
В первых двух группах кроликов по 17 животных в каждой под эфирным наркозом через лапаротомический разрез с помощью разработанного авторами устройства по передней поверхности печени (I группа) или наружному краю левой почки (II группа) разрывалась паренхима с моделированием идентичных рвано-ушибленных ран размером 0,6×0,2 см и глубиной 0,2 см, не проникающая в систему полостей. Раны печени и почки ушивали двойным восьмиобразным гемостатическим швом [8; 10].
10 кроликов III группы поочередно подвергали воздействию четыреххлористым углеродом (CCl4) в закрытом аквариуме емкостью 20 л, на дно которого наносили 0,5 мл CCl4 (время экспозиции 15 минут). Показателем степени острого токсического повреждения (ОТП) печени являлся иммунохимический тест на сывороточный альфа-фетопротеин (АФП) [12]. В IV группе кроликов (10 животных) моделировали ОТП почки (токсический нефрит) путем внутримышечного введения 50% раствора глицерина из расчета 0,8 мл/100 г веса. Внутримышечное введение глицерина приводит к развитию рабдомиолиза и выбросу в кровь большого количества свободного миоглобина. Миоглобин вызывает острое токсическое повреждение различных систем и органов, но в большей степени – почек, где развивается токсическое поражение клубочкового и канальцевого аппарата почек [13].
У кроликов всех групп до и на сроках 1, 3, 5, 7, 14 суток после операций и моделирования токсического повреждения из ушной вены производился забор крови в объеме 2,5 мл. Сыворотки крови, разлитые по аликвотам 0,5 мл, хранились до исследования при -20 °С без консерванта.
Активность лизоцима (ЛЗЦ) в сыворотках крови кроликов определяли колориметрическим микрометодом [14] путем измерения оптической плотности в образцах с тест-культурой микрококка. Концентрацию АФП в сыворотках крови кроликов определяли методом ИФА [2]. Активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), лактатдегидрогеназы (ЛДГ), гамма-глютамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ) измеряли на биохимическом анализаторе Microlab с набором реагентов (Vitalab, Нидерланды) [8]. Активность нейтральной α-глюкозидазы (НАГ) в образцах забуференной (рН 6,5) кроличьей сыворотки оценивали модифицированным косвенным методом И.С. Лукомской и соавт. [15] по нарастанию концентрации глюкозы (Δ ммоль/л) в присутствии добавленного до конечной концентрации 1% субстрата мальтозы.
Результаты обработаны методами описательной статистики с помощью прикладных пакетов программ Statistica, Ехсel и после проверки распределения выборок на нормальность представлены в виде средних значений и их ошибок (М+m). Достоверность различий между группами оценивали по U-критерию Манна–Уитни. Достоверными считали различия при рU < 0,05 [10].
Результаты исследований и их обсуждение. В сыворотках крови 54 кроликов до экспериментов (контроль) средние значения активностей семи исследованных ферментов составили 11,6±0,75 МЕ/л - для АЛТ, 10,0±0,82 МЕ/л - для АСТ, 193±11,7 МЕ/л - для ЛДГ, 52,5±3,59 МЕ/л - для ЩФ, 3,9±0,31 МЕ/л - для ГГТП, 1,6±0,10 МЕ/л - для ЛЗЦ и 3,2±0,22 ммоль/л глюкозы - для НАГ. Средняя концентрация АФП в крови интактных кроликов составила 6,1±0,71 нг/мл. Результаты определения активности ферментов и уровней АФП в различные сроки в 4 группах эксперимента представлены в таблице и на рис. 1-3 (в виде отношения средних величин в экспериментальных группах к значениям контроля).
После механического и токсического повреждения печени и почки в крови кроликов во все сроки наблюдения с различной интенсивностью и динамикой достоверно (p<0,05) по сравнению с контролем повышается активность АЛТ, АСТ, ЛДГ, ЩФ и ГГТП (таблица).
Динамика изменения активности ферментов и уровня АФП в крови у кроликов после моделирования травматического и токсического повреждения печени и почки
|
Показатели |
Сутки |
Активность фермента в МЕ/л (M±m) |
||||
|
Контроль (до экспери-мента) n=54 |
I группа (Травма печени) n=17 |
II группа (Травма почки) n=17 |
III группа (ОТП печени) n=10 |
IV группа (ОТП почки) n=10 |
||
|
АЛТ |
1-е |
11,6±0,75 |
46,0±2,93*^ |
70,2±4,09*^^ |
58,3±2,92^ |
51,4±3,96^^ |
|
3-и |
48,4±2,29*^ |
71,1±4,07* |
78,6±5,25^ |
67,3±5,94 |
||
|
5-е |
38,1±1,46*^ |
64,8±2,77*^^ |
77,4±4,89^ |
80,4±5,08^^ |
||
|
7-е |
44,8±2,94*^ |
60,2±3,23*^^ |
75,8±4,97^ |
69,6±4,65^^ |
||
|
14-е |
46,6±3,01^ |
50,1±3,08^^ |
66,2±3,74^ |
62,0±3,99^^ |
||
|
21-е |
41,4±2,14^ |
44,7±2,04^^ |
53,6±3,40^ |
53,6±3,51^^ |
||
|
АСТ |
1-е |
10,0±0,82 |
40,4±2,74*^ |
62,0±3,72*^^ |
70,6±5,49**^ |
26,9±3,62**^^ |
|
3-и |
42,2±2,94*^ |
64,2±3,33*^^ |
62,9±5,02^ |
53,2±5,93^^ |
||
|
5-е |
39,4±2,36*^ |
62,8±3,28* |
66,4±4,89^ |
69,0±5,28 |
||
|
7-е |
30,3±2,91*^ |
58,4±3,09*^^ |
54,7±4,70**^ |
72,9±5,74**^^ |
||
|
14-е |
24,7±1,95*^ |
40,1±2,93*^^ |
37,6±3,49**^ |
56,4±5,15**^^ |
||
|
21-е |
19,7±1,71*^ |
25,2±2,02*^^ |
29,7±3,40**^ |
48,7±4,26**^^ |
||
|
ЛДГ |
1-е |
193±11,7 |
806±60,6*^ |
427±34,6* |
500±43,7**^ |
402±37,2** |
|
3-и |
847±65,6* |
448±35,8*^^ |
749±60,9** |
534±47,3**^^ |
||
|
5-е |
886±67,6*^ |
371±26,7*^^ |
1280±121,1**^ |
612±56,4**^^ |
||
|
7-е |
912±73,7* |
375±30,7*^^ |
1036,6±86,2** |
591±59,2**^^ |
||
|
14-е |
748±59,5* |
297±29,0*^^ |
912±91,1** |
485±41,6**^^ |
||
|
21-е |
466±45,6* |
262±26,3*^^ |
469,2±43,84 |
374±33,5^^ |
||
|
ЩФ |
1-е |
52,5±3,59 |
248,6±30,50*^ |
184,5±22,99*^^ |
318,7±35,59^ |
337,4±40,24^^ |
|
3-и |
241,3±17,68 |
222,1±19,95 |
242,8±28,62 |
279,2±39,88 |
||
|
5-е |
227,5±11,64 |
203,5±17,44 |
214,7±28,44 |
256,7±31,22 |
||
|
7-е |
258,9±21,31* |
183,6±13,42* |
290,6±36,68 |
223,0±29,51 |
||
|
14-е |
240,7±18,87* |
132,4±12,67*^^ |
231,2±31,26 |
194,1±21,55^^ |
||
|
21-е |
125,5±11,48^ |
112,5±8,76^^ |
257,9±28,64**^ |
143,3±14,46**^^ |
||
|
ГГТП |
1-е |
3,9±0,31 |
11,9±0,86* |
7,7±0,67* |
11,0±1,11** |
6,5±0,85** |
|
3-и |
13,7±0,91* |
9,5±0,86* |
14,9±1,45** |
8,2±0,95** |
||
|
5-е |
14,7±1,08* |
10,3±0,95* |
13,7±1,38** |
11,0±0,98** |
||
|
7-е |
12,4±0,94* |
9,7±0,78* |
10,0±1,24 |
10,9±1,03 |
||
|
14-е |
10,0±0,80* |
8,1±0,58*^^ |
8,5±0,96 |
10,3±1,01^^ |
||
|
21-е |
7,8±0,81* |
6,2±0,54*^^ |
6,6±0,92 |
8,3±0,90^^ |
||
|
ЛЗЦ |
1-е |
1,6±0,10 |
1,8±0,22 |
2,1±0,26 |
1,9±0,39 |
2,5±0,36 |
|
3-и |
2,4±0,25^ |
2,5±0,36 |
1,8±0,34**^ |
3,2±0,54** |
||
|
5-е |
2,9±0,33 |
2,9±0,41 |
2,2±0,49** |
4,0±0,62** |
||
|
7-е |
3,2±0,36 |
3,2±0,39 |
2,7±0,53 |
4,1±0,58 |
||
|
14-е |
2,7±0,32 |
2,8±0,29^^ |
3,3±0,45 |
4,3±0,51^^ |
||
|
21-е |
2,3±0,27 |
2,3±0,26^^ |
1,8±0,34** |
3,8±0,45**^^ |
||
|
НАГ (ммоль/л глюкозы) |
1-е |
3,2±0,22 |
3,8±0,62* |
6,1±0,77* |
3,9±0,72** |
6,5±0,82** |
|
3-и |
5,4±0,73* |
9,5±0,84* |
4,8±0,70** |
10,2±1,53** |
||
|
5-е |
6,3±0,89* |
10,9±0,92* |
5,2±0,87** |
11,0±1,48** |
||
|
7-е |
5,2±0,80* |
8,2±0,75*^^ |
4,7±0,76** |
11,1±1,22**^^ |
||
|
14-е |
4,7±0,76 |
5,8±0,69^^ |
4,3±0,73** |
10,3±1,08**^^ |
||
|
21-е |
4,3±0,68 |
4,3±0,56^^ |
3,8±0,71** |
6,8±0,66**^^ |
||
|
АФП нг/мл |
1-е |
6,1±0,71 |
10,7±1,90 |
9,1±1,93 |
18,8±5,60** |
6,7±1,35** |
|
3-и |
35,3±8,31 |
17,5±3,72 |
48,7±11,34** |
9,4±2,86** |
||
|
5-е |
36,2±9,81* |
12,8±2,49* |
32,1±7,78** |
10,0±2,92** |
||
|
7-е |
23,1±4,53 |
13,3±2,09 |
27,6±6,91** |
10,3±3,13** |
||
|
14-е |
18,0±3,68* |
9,8±1,92* |
13,3±3,59 |
6,8±1,31 |
||
|
21-е |
10,5±2,26* |
5,3±0,97* |
11,8±1,80 |
7,3±1,25 |
||
Примечание:
достоверные различия (p<0,05) по сравнению с контролем – выделены серой заливкой ячейки таблицы.
* – достоверные различия (p<0,05) между группами I «Травма печени» и II «Травма почки».
** – достоверные различия (p<0,05) между группами III «ОТП печени» и IV «ОТП почки».
^ – достоверные различия (p<0,05) между группами I «Травма печени» и III «ОТП печени».
^^ – достоверные различия (p<0,05) между группами II «Травма почки» и IV «ОТП почки».
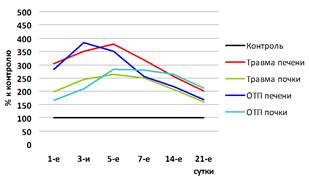
При этом активность АЛТ, АСТ, ЛДГ и ЩФ во всех экспериментальных группах увеличивалась на 500-700% (таблица, рис. 1). Существенно не отличались от контрольных значений только уровни ЛЗЦ и НАГ в 1-е сутки после механической травмы печени, НАГ в группе «ОТП печени» и АФП в группе «травма почки» в 1-е и последние сутки эксперимента, АФП во все сроки после ОТП почки и ЛЗЦ после ОТП печени на 1, 3, 5-е сутки и в конце эксперимента (таблица).
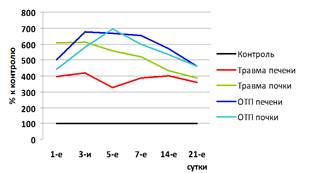
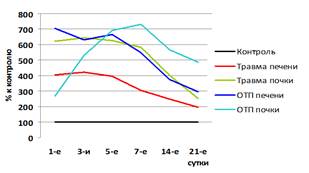
а б

в г
Рис. 1. Динамика изменения активности АСТ, АЛТ, ЛДГ и ЩФ в крови у кроликов после моделирования травматического и токсического повреждения печени и почки в % к контрольным цифрам (а – АСТ; б – АЛТ; в – ЛДГ; г – ЩФ)
Средние величины АЛТ, АСТ, НАГ были выше и при экспериментальных травмах, и при ОТП почки, а ЛДГ, ЩФ, ГГТП и АФП – выше при травмах и ОТП печени. Межорганные различия по ЛДГ и НАГ наблюдались как в случае механической травмы, так и ОТП печени и почки, а по АЛТ достоверно отличались только после механической травмы, но не после токсического поражения печени и почки.
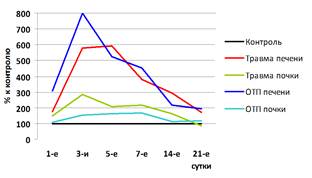
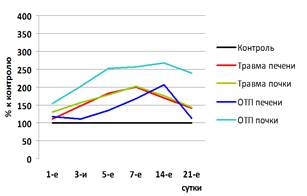
д е
Рис. 2. Динамика изменения активности ГГТП и концентрации АФП в крови у кроликов после моделирования травматического и токсического повреждения печени и почки в % к контрольным цифрам (д – АФП; е – ГГТП)
Достоверные межорганные различия по АСТ, ГГТП и ЛЗЦ после ОТП наблюдались без определенной закономерности. Не установлено статистически достоверных межорганных различий по активности ЩФ после ОТП печени и почки, а по ЛЗЦ – после механических травм этих паренхиматозных органов (таблица).
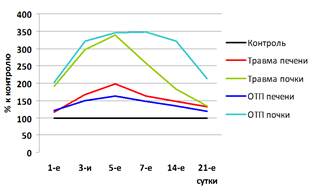
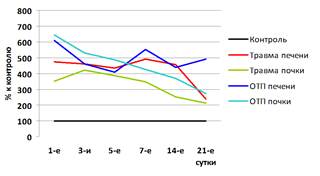
ж з
Рис. 3. Динамика изменения активности НАГ и лизоцима в крови у кроликов после моделирования травматического и токсического повреждения печени и почки в % к контрольным цифрам (ж – лизоцим; з – НАГ)
Инъекции глицерина кроликам гистологически проявлялись начиная с 3 суток и во все последующие сроки наблюдения нарастающими признаками острой почечной недостаточности у животных (отеком клубочков и канальцев, их сужением и закрытием, плазматической имбибицией стенок сосудов и их облитерацией), а биохимически – стойким сохранением повышенных уровней АЛТ, АСТ, ГГТП, ЛЗЦ и НАГ во все сроки наблюдения (рис. 1-3). Наоборот, ингаляционное ОТП печени четыреххлористым углеродом (CCl4) продолжалось на протяжении только одной недели, о чем свидетельствовала нормализация после 7-х суток уровней АФП и большинства ферментов (рис. 2).
При сравнении механической и токсической моделей поражения почки и печени (таблица) выявлено, что ОТП печени и почек приводит к достоверно большей активации ферментов АЛТ и АСТ, чем механическая травма обоих органов, а ЛДГ достоверно не дифференцирует характер повреждения печени, но различает модель повреждения почки. Повреждение печени, но не почки сопровождается повышением АФП, ЛДГ и ГГТП (таблица, рис. 1-3). Из исследованных ферментов только НАГ в максимальной степени отражает повреждение почки, но не печени вне зависимости от этиологии повреждения (рис. 3).
Выводы
Установлено, что индикаторным ферментом при повреждении почки травматического и токсического генеза можно считать только НАГ. Введение глицерина не вызывает существенного увеличения НАГ, но не АФП, что свидетельствует о специфическом нефротоксическом действии данного агента. Полученные результаты могут иметь значение для дифференциальной диагностики патологии почек с латентным течением.



