Несостоятельность кишечного анастомоза (НКА) в колоректальной хирургии - это одно из наиболее тяжелых и коварных осложнений, сопровождающееся увеличением летальности и продолжительности пребывания больных в стационаре [1; 2]. В течение последних десятилетий были разработаны новые технологичные методы наложения анастомозов, однако это не привело к снижению частоты возникновения НКА [3]. По данным литературы, частота развития НКА варьирует между 1 и 19% и зависит от типа накладываемого анастомоза. Так, при тонкотолстокишечном соустье частота развития НКА отмечается в 1-8% случаев, при толстотолстокишечном анастомозе - в 2-3%, при илеоректальном анастомозе - в 3-7%, при колоректальном или колоанальном анастомозе этот показатель наибольший и достигает 19% [4; 5]. Высокая частота НКА отмечается не только в локальных исследованиях, посвященных анализу результатов при наложении низких колоректальных анастомозов, но и в хорошо спланированных рандомизированных, популяционных исследованиях [6; 7].
Достаточно большое число признаков расцениваются как факторы риска несостоятельности толстокишечного анастомоза. К ним относятся: мужской пол, коморбидные заболевания, функциональное состояние органов и систем, нутритивный статус, вредные привычки (курение, употребление алкоголя), иммуносупрессия, неоадъювантная химио- и лучевая терапия, наличие дивертикулита, стадия опухолевого процесса, наложение низкого колоректального анастомоза, длительность оперативного вмешательства, интраоперационная кровопотеря или периоперационная гемотрансфузия [2; 4; 8]. Следует отметить, что некоторые факторы риска НКА не могут быть скорректированы в стационаре, а потенциально контролируемые факторы также тяжело поддаются воздействию хирурга [2; 4].
Экстренные вмешательства на толстой кишке являются независимым фактором риска для возникновения НКА, при этом наложение разгрузочной стомы уменьшает частоту развития клинически значимых осложнений НКА, особенно при низкой передней резекции [6].
Многие исследователи указывают на то, что развитие НКА сопровождается ухудшением онкологических результатов и пятилетней выживаемости больных раком толстой кишки. В частности, НКА снижает общую выживаемость, а также увеличивает число рецидивов опухоли независимо от стадии злокачественного процесса [9]. Несостоятельность колоректального анастомоза прямо коррелирует с частотой возникновения местных рецидивов [10]. По данным литературы, частота местных рецидивов колеблется от 0,5 до 30% в зависимости от применяемых методов обнаружения и степени тяжести НКА [11]. Исследовательская группа по изучению рака прямой кишки определила степени тяжести НКА, выделив 3 уровня: уровень A – НКА, не требующая дополнительных лечебных мероприятий; уровень B – НКА, требующая активных лечебных мероприятий без релапаротомии; уровень C – НКА, требующая выполнения релапаротомии [12].
Клинические и онкологические результаты лечения колоректального рака у больных с формированием НКА напрямую зависят от срока диагностики этого осложнения. Ранняя диагностика НКА играет решающую роль в профилактике тяжелых септических осложнений. Выявление несостоятельности анастомоза редко происходит до 5-го дня послеоперационного периода (ПОП) и обычно происходит на 4-8-е сутки ПОП [3; 9; 13]. Это связано с тем, что клиническая картина не всегда проявляется в виде перитонита или внутрибрюшного абсцесса, а может маскироваться лихорадкой, кишечной непроходимостью или даже диареей. Однако некоторые симптомы несостоятельности анастомоза, часто неспецифические, могут проявляться раньше [13]. Диагностика несостоятельности анастомоза на ранних сроках позволяет избежать большого числа осложнений и снизить летальность [2]. В клинической практике золотым стандартом для диагностики несостоятельности анастомоза является компьютерная томография, особенно с внутривенным или внутрикишечным контрастированием [3; 9].
В настоящее время отсутствуют специфические маркеры несостоятельности анастомоза в колоректальной хирургии. Одним из ранних маркеров несостоятельности анастомоза является C-реактивный белок (СРБ), уровень которого увеличивается на 3-4-е сутки послеоперационного периода на фоне системной воспалительной реакции, развивающейся в результате внутрибрюшных септических осложнений. При этом чувствительность и специфичность теста остаётся сомнительной, диапазон референсных значений варьируются от 150 до 250 мг/л [13-15].
Ряд исследований демонстрируют, что прогностически значимым уровнем является диапазон от 180 (мг/л) и выше, на основании чего делается вывод о высокой прогностической значимости СРБ при несостоятельности анастомоза [16]. В то же время результаты некоторых метаанализов показывают, что концентрация СРБ на 3-5-е сутки ПОП является полезным отрицательным прогностическим тестом, а не хорошим положительным предиктором [1; 17]. Возможно, это связано с тем, что концентрация CРБ в образцах крови может быть точным прогнозирующим фактором смертности от любых причин [18].
Еще одним направлением поиска предикторов НКА является исследование перитонеального выпота на содержание цитокинов: IL-6, IL-10, TNF-α. В ряде работ зафиксирован рост уровней этих медиаторов воспаления в течение первых трёх суток ПОП у больных с НКА [19]. Помимо цитокинов, в перитонеальном выпоте исследовались концентрации биохимических маркеров, отражающих гипоксию тканей, к которым относятся пируват и лактат [20; 21]. В качестве критерия оценки ишемии тканей и развития воспалительных осложнений предложено определение уровня pH перитонеального выпота. В ряде исследований было продемонстрировано, что снижение уровня pH ниже 6,8 на 3-и сутки ПОП может свидетельствовать о развитии внутрибрюшных осложнений, в том числе и НКА. Уровень pH выпота как предиктор НКА обладает высокой чувствительностью - 98,7% и специфичностью - 94,7% [22].
В своей работе мы попытались проанализировать ежесуточную динамику изменений лабораторных показателей крови и перитонеального выпота в послеоперационном периоде у больных, радикально оперированных по поводу злокачественных новообразований толстой кишки с первичным восстановлением непрерывности толстой кишки.
Материалы и методы. В исследование включены 111 больных, оперированных по поводу злокачественных новообразований левой половины толстой кишки за период с 2015 по 2016 г. в колопроктологическом отделении КГБУЗ «Красноярская межрайонная клиническая больница № 20 им. И.С. Берзона». Исследование проводилось проспективно, в анализ не были включены больные без анастомоза, с наложенными превентивными кишечными стомами, все больные оперированы открытым методом, путем срединной лапаротомии. Из исследования исключены больные с опухолями IV стадии. У всех больных, включенных в исследование, выполняли лабораторные исследования крови и перитонеального выпота на 1, 2, 3, 5 и 7-е сутки послеоперационного периода.
В указанный период у больных контролировались в анализе крови содержание лейкоцитов, СОЭ, лейкоцитарный индекс интоксикации (по Я.Я. Каль-Калифу, 1941), С-реактивный белок, лактат. В перитонеальном выпоте определялись уровень pH, показатели лактата.
Сравнительный анализ указанных показателей проведён у больных с гладким течением ПОП и у пациентов с НКА. Распределение больных на группы выполнено ретроспективно, на основании клинически установленного факта развития НКА в послеоперационном периоде.
При проведении статистического анализа тестирование на нормальность распределения выполняли с помощью теста Колмогорова-Смирнова, для сравнения средних значений в группах использовали U-критерий Mann-Whitney.
Полученные результаты. За указанный период в исследование были включены 111 больных, удовлетворяющих критериям включения. Группу с не осложненным течением послеоперационного периода составили 102 больных, из них мужчин 52 человека (51%), женщин 50 (49%). Средний возраст 65 ± 10,5 года (таблица). Злокачественное новообразование толстой кишки локализовалось в сигмовидном отделе у 78 больных (76,5%), в нисходящей ободочной кишке у 24 больных (23,5%). По стадиям опухолевого процесса больные распределились: 15 больных (14,7%) I стадия, 35 больных (34,3%) II стадия, 52 больных (51,0%) III стадия (по классификации TNM).
Несостоятельность анастомоза зафиксирована у 9 больных (8,1%), из которых сформирована группа НКА. Частота развития НКА не зависела от локализации опухоли: у 6 больных - после резекции сигмовидной кишки (7,6%) и у 3 (12,5%) больных - после левосторонней гемиколэктомии (критерий χ2 – 0.49, р>0,05). В этой группе преобладали мужчины – 6 больных (67%), преимущественно у больных диагностированна III стадия опухолевого процесса – 7 больных (78%).
Характеристика больных, включенных в исследование
|
Без осложнений, n (%) |
Несостоятельность анастомоза, n (%) |
Уровень р* |
|
|
Пол мужской женский |
52 (51%) 50 (49%) |
6 (67%) 3 (33%) |
>0,05 |
|
Возраст ≤ 60 > 60 |
43 (42%) 58 (58%) |
4 (44%) 5 (56%) |
>0,05 |
|
Локализация опухоли с.descendens c.sigmoideum |
78 (76,5%) 24(23,5%) |
6 (7,6%) 3 (12,5%) |
>0,05 |
|
Стадия процесса I стадия II стадия III стадия |
15 (14,7%) 35 (34,3%) 52 (51,0%) |
0 (0,0%) 2 (22%) 7(78%) |
>0,05 |
* критерий χ2
При анализе гематологических показателей клинически значимые результаты отмечены в динамике уровней лейкоцитоза, скорости оседания эритроцитов (СОЭ) и лейкоцитарного индекса интоксикации (ЛИИ).
Достоверные отличия показателей лейкоцитоза и ЛИИ между группами больных без осложнений (БО) в послеоперационном периоде и больных с несостоятельностью кишечного анастомоза (НКА) начинают регистрироваться с 3-х суток послеоперационного периода. Динамика уровня СОЭ запаздывает как в динамике отрицательных изменений, так и при улучшении состояния больного, первые достоверные отличия СОЭ начинают отмечаться лишь на 5-е сутки послеоперационного периода (рис. 1).
Значимых отличий в динамике биохимических показателей у больных с несостоятельностью толстокишечного анастомоза зарегистрировано не было. Исключение составил уровень C-реактивного белка. Кроме того, учитывая важную роль ишемии тканей в развитии несостоятельности анастомоза, мы дополнительно определяли уровень лактата плазмы крови.
Следует отметить, что достоверные отличия уровня СРБ между группами больных с развитием НКА и БО начинают регистрироваться уже со 2-х суток послеоперационного периода, в то время как уровень лактата в плазме крови начинает достоверно отличаться между группами только с 5-х суток послеоперационного периода (рис. 2).
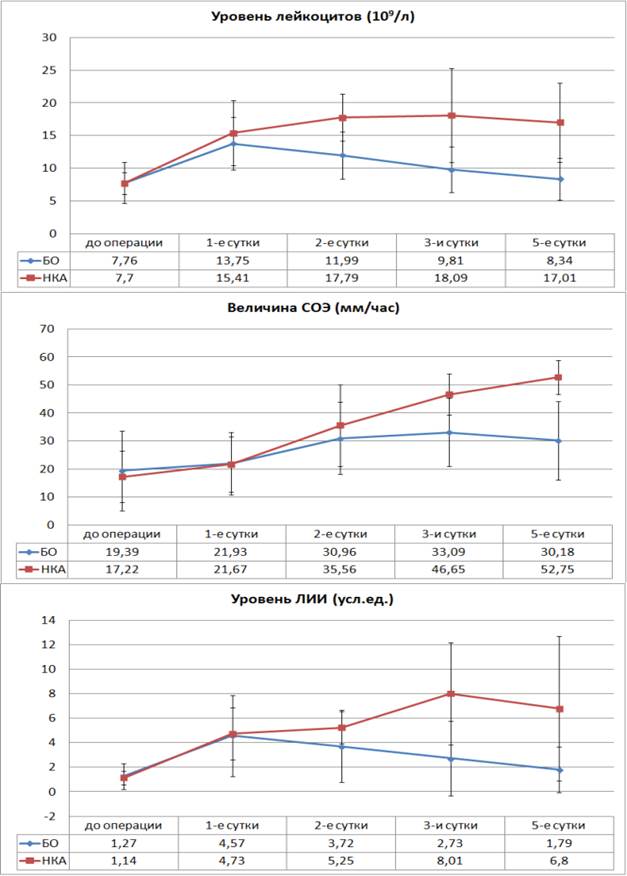
Рис. 1. Динамика уровней лейкоцитоза СОЭ и ЛИИ в послеоперационном периоде у больных без осложнений и с развитием НКА
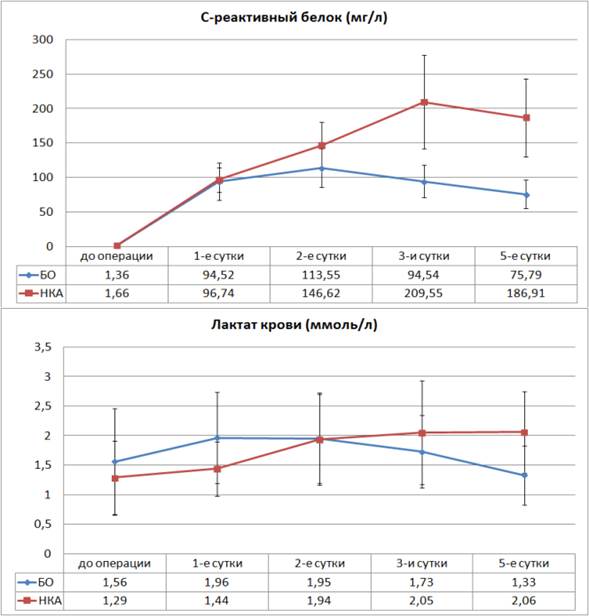
Рис. 2. Динамика уровней СРП и лактата плазмы крови в послеоперационном периоде
Динамика биохимических показателей в выпоте из брюшной полости демонстрирует достоверные отличия уровней лактата и рН уже на ранних сроках развития осложнений (рис. 3). Достоверное снижение уровня рН выпота при развитии несостоятельности анастомоза отмечается со вторых суток ПОП до 6,8 ± 0,51 (p=0,023). В дальнейшем уровень рН уже не превышает этого значения. При неосложненном течении послеоперационного периода этот показатель не опускается ниже 7,14 ± 0,24.
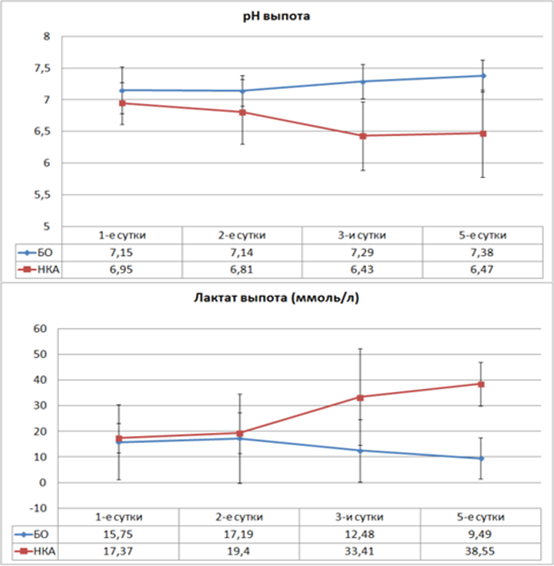
Рис. 3. Динамика уровней pH и лактата выпота из брюшной полости в послеоперационном периоде
Зачастую анализ усредненных значений не позволяет выбрать определенную тактику в отношении конкретного больного, так как даже при неосложненном течении послеоперационного периода у некоторых больных мы отмечали значения определенных показателей (например, CРБ) на уровнях, характерных для осложненного течения послеоперационного периода. С целью персонификации диагностического подхода мы проанализировали динамику изменений относительных величин СРБ и лактата. Показателем kCRP стало отношение текущего уровня СРБ у конкретного больного к уровню СРБ, полученного у него в первые сутки послеоперационного периода. Показателем kLac стало отношение лактата выпота к лактату плазмы крови.
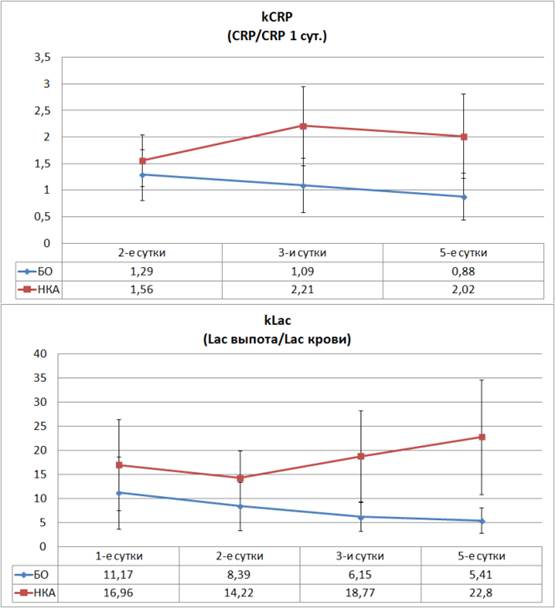
Рис. 4. Динамика расчетных коэффициентов в послеоперационном периоде у больных без осложнений и на фоне развития НКА
Анализ посуточной динамики указанных коэффициентов и сравнение их уровней между группами свидетельствует о появлении достоверных отличий уже на вторые сутки послеоперационного периода, а начиная с третьих суток эти отличия становятся высоко достоверными (рис. 4). Так, уровень kCRP при развитии несостоятельности толстокишечного анастомоза на вторые сутки превышает контрольный показатель на 21% (p=0,016), а с третьих суток эта разница начинает превышать 100% (p<0,001). При рассмотрении разницы kLac можно отметить высоко достоверные отличия уже со вторых суток наблюдения, когда разница с контрольным уровнем достигает 69% (p=0,002), а на третьи сутки этот показатель втрое превышает контрольное значение (p<0,001), и эта тенденция к росту сохраняется.
Заключение. Ранняя диагностика послеоперационных осложнений - это сложный клинический, лабораторный и инструментальный поиск, направленный на выявление совокупности «малых» признаков уже свершившегося, но еще клинически не проявившего себя в полной мере патологического процесса. Проведенный анализ динамики уровней гематологических и биохимических маркеров плазмы крови, анализ динамики биохимических показателей перитонеального выпота дает основания для выделения уровней лейкоцитов, ЛИИ, СРБ, pH выпота из брюшной полости в группу лабораторных предикторов несостоятельности кишечного анастомоза, которые совокупно позволяют заподозрить НКА уже на 3-и сутки послеоперационного периода. Дополнения этих значений расчетными значениями kCRP и kLac повышают диагностическую ценность предлагаемого набора тестов в ранней диагностике несостоятельности толстокишечного анастомоза.



