Любая водная экосистема, являясь открытой термодинамической системой, имеет сложную систему подвижных биологических связей, которые нарушаются под воздействием антропогенных факторов. Антропогенное влияние отражается не только на видовом составе водных сообществ и соотношении численности слагающих их видов, но и на качестве иловых сульфидных грязей.
В составе нативной грязи выделяется группа специфических органических компонентов – гуминовых веществ, представленных гумином и подвижными составляющими - гумусовыми кислотами. В составе гумусовых кислот пелоидов на основании их молекулярно-массового распределения, а также растворимости в различных средах принято выделять группы фульвовых, гиматомелановых и гуминовых кислот [1]. Это высокомолекулярные соединения нестехиометрического состава, характеризующиеся гетерогенностью, полимолекулярностью, поли-, гетерофункциональностью. Структура макромолекул изменчива, неупорядоченна и формируется под влиянием динамично образующихся и разрывающихся химических связей различной этиологии.
В настоящее время процесс образования гуминовых веществ – гумификация, рассматривается не просто как утилизация органических остатков, а как образование нового класса природных соединений, необходимых для обеспечения непрерывности современных жизненных форм [2]. Глобальной является биопротекторная функция гуминовых веществ, обусловленная связыванием в прочные комплексы как ионов металлов, так и органических экотоксикантов [3]. В связи с изложенным весьма актуальны не только вопросы экологической чистоты и безопасности применения нативной грязи, но и теоретические аспекты ее генеза.
Целью работы явилось исследование возможности применения теоретических приемов, позволяющих рассчитать основные термодинамические характеристики почв, для гумусовых кислот иловых низкоминерализованных сульфидных грязей, а также выявление взаимосвязи термодинамических функций гумусовых кислот с позиций классических представлений об их строении и экопротекторной роли в биосфере.
Материалы и методы. Определение углерода, водорода и азота проводили на анализаторе фирмы «Карло Эрба» при температуре 1010 °С при постоянном потоке гелия.
Термодинамические параметры рассчитывали по результатам элементного анализа, принятого для гумусовых кислот почв [1]. Теплоемкость (Ср) рассчитывали по уравнению:
Ср = 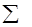 Сi ni, где Сi - атомная теплоемкость; ni - число атомов согласно простейшей формуле гумусовых кислот [4].
Сi ni, где Сi - атомная теплоемкость; ni - число атомов согласно простейшей формуле гумусовых кислот [4].
Для расчета абсолютной энтропии (S0) и энтропии образования (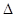 S0) использовали эмпирическую формулу подсчета абсолютной энтропии твердых веществ: S0 = 1,1 Ср.
S0) использовали эмпирическую формулу подсчета абсолютной энтропии твердых веществ: S0 = 1,1 Ср.
Абсолютная энтропия S0 и энтропия образования 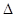 S0 кислородсодержащих органических соединений связаны уравнением:
S0 кислородсодержащих органических соединений связаны уравнением:
S0 = 1,03 + 0,039 ( 7 + 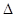 S0 )2, где S0 и
S0 )2, где S0 и 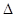 S выражены в Дж/К·г.
S выражены в Дж/К·г.
Для анализа природных объектов вычисляют энергию Гиббса, используя соотношение:
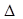 G0 = К
G0 = К 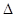 Н0, где К - коэффициент пропорциональности.
Н0, где К - коэффициент пропорциональности.
Для гумусовых кислот почв [5] установлена регрессионная зависимость
К = 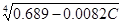 , где [C] – массовое содержание углерода в процентах.
, где [C] – массовое содержание углерода в процентах.
Зная величину К и энтропии образования 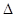 S0, после несложного преобразования уравнения Гиббса-Гельмгольца, рассчитывали стандартную энергию Гиббса образования гумусовых кислот:
S0, после несложного преобразования уравнения Гиббса-Гельмгольца, рассчитывали стандартную энергию Гиббса образования гумусовых кислот: 
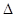 G0 = -К T
G0 = -К T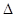 S0 / ( 1 - К ).
S0 / ( 1 - К ).
Значение энтальпии образования (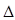 Н0) находили из уравнения:
Н0) находили из уравнения: 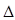 Н0 =
Н0 = 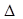 G0 / К.
G0 / К.
Результаты исследования и их обсуждение. Гумусовые кислоты пелоидов образуются в анаэробных сильно восстановительных условиях, обусловленных высоким содержанием сероводорода и сульфид-ионов, и существенно отличаются условиями формирования от почвенных кислот. Тем не менее нами за основу расчета термодинамических функций использованы подходы, предложенные для характеристики гумусовых кислот почв [4-6]. Отсутствие в научной литературе информации по исследованию термодинамических функций в ряду гумусовых кислот пелоидов обусловило наблюдение сезонных колебаний, которые не могут не влиять на химические и биологические свойства исследуемых соединений.
В таблицах 1-3 приведены результаты элементного анализа сезонных проб пелоидов, на основании которых рассчитаны термодинамические характеристики фракций.
Таблица 1
Элементный состав фульвокислот
|
Определяемый показатель |
Весна
|
Лето
|
Осень
|
|
|
Углерод |
Масс. |
31,61±0,90 |
25,06±0,71 |
31,18±1,10 |
|
Мольн. |
21,24±0,50 |
15,00±0,41 |
18,39±0,60 |
|
|
Водород |
Масс. |
5,82±0,15 |
7,61±0,22 |
7,69±0,21 |
|
Мольн. |
47,01±0,85 |
54,63±1,10 |
48,14±0,90 |
|
|
Азот |
Масс. |
1,98±0,03 |
3,13±0,06 |
2,49±0,03 |
|
Мольн. |
1,13±0,04 |
1,58±0,02 |
1,27±0,02 |
|
|
Кислород |
Масс. |
60,59±1,12 |
64,20±1,05 |
58,64±1,12 |
|
Мольн. |
30,61±0,60 |
28,79±0,51 |
25,93±0,80 |
|
Таблица 2
Элементный состав гиматомелановых кислот
|
Определяемый показатель |
Весна
|
Лето |
Осень
|
|
|
Углерод |
Масс. |
52,19±1,20 |
59,60±1,30 |
56,59±1,40 |
|
Мольн. |
32,41±0,60 |
36,33±0,95 |
34,71±1,10 |
|
|
Водород |
Масс. |
6,46±0,20 |
6,58±0,35 |
6,55±0,40 |
|
Мольн. |
48,14±0,90 |
48,10±1,20 |
48,16±1,50 |
|
|
Азот |
Масс. |
3,27±0,06 |
2,26±0,04 |
2,79±0,04 |
|
Мольн. |
1,71±0,03 |
1,17±0,03 |
1,47±0,02 |
|
|
Кислород |
Масс. |
38,08±1,20 |
31,56±1,20 |
34,07±1,40 |
|
Мольн. |
17,73±0,49 |
14,40±0,80 |
15,66±1,00 |
|
Для всех элементов сезонные колебания не выходят за пределы 10%. Исключение составляет азот, содержание которого изменяется от 1,47 до 2,79 и колебание равно ±19%.
Гуминовые кислоты обладают практически постоянным элементным составом независимо от времени года (табл.3), колебания здесь не превышают 6%.
Таблица 3
Элементный состав гуминовых кислот
|
Определяемый показатель |
Весна
|
Лето |
Осень
|
|
|
Углерод |
Масс. |
54,25±1,40 |
54,47±1,35 |
55,87±1,48 |
|
Мольн. |
37,70±1,10 |
41,23±0,95 |
39,26±0,83 |
|
|
Водород |
Масс. |
4,88±0,06 |
3,83±0,03 |
4,71±0,05 |
|
Мольн. |
40,70±1,60 |
34,79±0,75 |
39,68±1,10 |
|
|
Азот |
Масс. |
4,12±0,05 |
3,33±0,04 |
4,03±0,07 |
|
Мольн. |
2,42±0,03 |
2,18±0,03 |
2,44±0,05 |
|
|
Кислород |
Масс. |
36,75±1,20 |
38,38±1,10 |
35,39±1,10 |
|
Мольн. |
19,18±0,07 |
21,80±1,00 |
18,62±0,95 |
|
Поскольку истинные значения молярных масс гумусовых кислот неизвестны, то более корректно и информативно сопоставление термодинамических характеристик, отнесенных к единице массы вещества. Как видно из приведенных данных, значения удельной теплоемкости и абсолютной энтропии фульвокислот, рассчитанные на 1 грамм объекта исследования, несколько повышаются от весеннего периода к осеннему (табл. 4). Изменения энтропии, энтальпии, энергии Гиббса характеризуются убылью и достигают максимальных значений в осенний период. Таким образом, все термодинамические характеристики в случае фульвокислот достигают своих максимальных значений осенью.
Таблица 4
Термодинамические функции фульвокислот
|
Т/д функция |
Единицы измерения |
Сезон года |
||
|
Весна |
Лето |
Осень |
||
|
Cp |
Дж/К•моль |
995,25 |
884,09 |
873,72 |
|
Дж/К•г |
1,41 |
1,45 |
1,57 |
|
|
S0 |
Дж/моль |
729,03 |
628,49 |
597,98 |
|
Дж/г |
1,03 |
1,03 |
1,07 |
|
|
DS0 |
Дж/моль |
-4900,10 |
-4361,44 |
-4465,27 |
|
Дж/г |
-6,92 |
-7,15 |
-8,01 |
|
|
DH0 |
кДж/моль |
-7685,40 |
-6501,80 |
-7003,50 |
|
кДж/г |
-10,86 |
-10,66 |
-12,57 |
|
|
DG0 |
кДж/моль |
-6225,20 |
-5202,10 |
-5672,80 |
|
кДж/г |
-8,79 |
-8,53 |
-10,20 |
|
Таблица 5
Термодинамические функции гиматомелановых кислот
|
Функция |
Единицы измерения |
Сезон года |
||
|
Весна |
Лето |
Осень |
||
|
Cp |
Дж/К·моль |
599,30 |
825,66 |
683,58 |
|
Дж/К·г |
1,37 |
1,24 |
1,36 |
|
|
S0 |
Дж/моль |
466,00 |
822,15 |
546,24 |
|
Дж/г |
1,07 |
1,24 |
1,09 |
|
|
DS0 |
Дж/моль |
-2640,84 |
-3140,59 |
-2916,43 |
|
Дж/г |
-6,03 |
-4,72 |
-5,81 |
|
|
DH0 |
КДж/моль |
-2713,70 |
-2836,10 |
-2803,50 |
|
КДж/г |
-6,22 |
-4,30 |
-5,59 |
|
|
DG0 |
КДж/моль |
-1926,70 |
-1900,20 |
-1934,40 |
|
КДж/г |
-4,41 |
-2,86 |
-3,86 |
|
Таблица 6
Термодинамические функции гуминовых кислот
|
Функция |
Единицы измерения |
Сезон года |
||
|
Весна |
Лето |
Осень |
||
|
Cp |
Дж/К·моль |
422,63 |
469,83 |
414,37 |
|
Дж/К·г |
1,23 |
1,14 |
1,21 |
|
|
S0 |
Дж/К моль |
417,40 |
559,38 |
429,43 |
|
Дж/Кг |
1,21 |
1,36 |
1,25 |
|
|
DS0 |
Дж/К моль |
-1673,22 |
-1688,70 |
-1593,57 |
|
Дж/К г |
-4,86 |
-4,09 |
-4,64 |
|
|
DH0 |
кДж/моль |
-1673,22 |
-1688,75 |
-1531,90 |
|
кДж/г |
-4,90 |
-4,09 |
-4,46 |
|
Сезонная вариативность позволила выявить общие тенденции изменений термодинамических характеристик, но она не имеет катастрофических значений, поэтому для проведения сравнительного анализа фракций гумусовых кислот пелоидов использованы средние значения термодинамических параметров с учетом всех сезонных значений (табл. 7).
Таблица 7
Средние термодинамические функции в ряду гумусовых кислот
|
Функция |
Единицы измерения |
Фульвокислоты |
Гиматомелановые кислоты |
Гуминовые кислоты |
|
Молекулярная масса, а.е.м. |
14951 |
27029 |
63612 |
|
|
Ср |
Дж/К моль |
917,68 |
702,85 |
435,60 |
|
Дж/К г |
1,47 |
1,32 |
1,18 |
|
|
S0 |
Дж/К моль |
651,83 |
611,5 |
468,74 |
|
Дж/К г |
1,04 |
1,14 |
1,27 |
|
|
DS0 |
Дж/К моль |
-4575,60 |
-2899,29 |
-1651,83 |
|
Дж/К г |
-7,33 |
-5,42 |
-4,49 |
|
|
DH0 |
кДж/моль |
-7063,60 |
-2784,40 |
-1631,29 |
|
кДж/г |
-11,31 |
-5,21 |
-4,43 |
|
|
DG0 |
кДж/моль |
-5700,00 |
-1920,43 |
-1372,40 |
|
кДж/г |
-9,13 |
-3,92 |
-3,73 |
Массовая удельная теплоемкость вещества зависит от атомной теплоемкости элементов, входящих в состав молекулы. Теплоемкость фульвокислот, по нашим результатам, составляет 1,47 кДж К/г, что больше показателей теплоемкости гуминовых и гиматомелановых кислот в 1,25 и 1,1 раза соответственно. Это связано с элементным составом фульвокислот (таблица 1), в которых превалирует массовая доля кислорода. По справочным данным, теплоемкость кислорода выше, чем у водорода, и еще выше, чем у углерода.
Абсолютная энтропия гумусовых кислот, характеризующая степень неупорядоченности молекул, в исследуемом ряду возрастает от фульвокислот к гуминовым, что согласуется с фактом более высокой энтропии образования молекул ароматического ряда по сравнению с алифатическими соединениями и свидетельствует о преобладании ароматических фрагментов в структуре гуминовых кислот. Фульвокислоты, как фракция с наименьшей молекулярной массой, характеризуются большей упорядоченностью структурных фрагментов по сравнению с высокомолекулярными фракциями гуминовых и гиматомелановых кислот, имеющих надмолекулярные взаимодействия различной этиологии.
Величины энтальпии (DH0) для всех гумусовых кислот имеют отрицательные значения, возрастающие от гуминовых к фульвокислотам (таблица 7), что характеризует более высокую энергоемкость фульвокислот в связи с повышенным содержанием в их составе атомов кислорода.
Интегральным показателем, связывающим энтальпийный и энтропийный факторы, является величина свободной энергии Гиббса (DG0). Отрицательные значения DG0 для исследуемых объектов возрастают от гуминовых к фульвокислотам, что свидетельствует о предпочтительном образовании более низкомолекулярной фракции. Это логично с позиций формирования высокомолекулярных субстратов гуминовых и гиматомелановых кислот, структура которых представляет собой стохастический клубок постоянно меняющейся формы за счет непрерывных процессов образования и разрушения межмолекулярных связей. В процессе переработки микроорганизмами фульвокислоты включаются в процессы образования более высокомолекулярных фракций гумусовых кислот, являясь, таким образом, их генетическими предшественниками. Гиматомелановые и фульвокислоты более активно участвуют в процессах жизнедеятельности микроорганизмов, выступая для них более доступным энергетическим материалом.
Процесс формирования гумусовых кислот носит энтальпийно-энтропийный характер, и уменьшение доли атомов кислорода с одновременным ростом степени хаотичности структур в ряду фульвовых – гиматомелановых – гуминовых кислот адекватно отражается в изменении всех термодинамических характеристик изучаемых объектов.
Выводы
1. Теоретические приёмы расчёта основных термодинамических характеристик почв применены к расчёту термодинамических характеристик гумусовых кислот иловых низкомолекулярных сульфидных грязей.
2. Массовая удельная теплоёмкость, зависящая от атомной теплоёмкости элементов, составляющих вещество, максимальна в случае фульвокислот, что можно объяснить высокой массовой долей в них атомов кислорода, теплоёмкость которых выше, чем теплоёмкость атомов водорода и углерода.
3. Рассчитанные значения ряда термодинамических параметров для фульвовых, гиматомелановых и гуминовых кислот в разные сезоны года подтверждают наибольшую вероятность самопроизвольного протекания процесса гумификации в тёплое время года.
4. Возрастание отрицательных значений энергии Гиббса от гуминовых кислот через гиматомелановые к фульвокислотам свидетельствует, по-видимому, о предпочтительном образовании более низкомолекулярной фракции с дальнейшим превращением её в более высокомолекулярные гуминовые кислоты.
5. Образование гумусовых кислот носит энтальпийно-энтропийный характер, происходит с выделением тепла и образованием стохастического клубка высокомолекулярных биополимеров, сопровождается образованием новых связей различной природы, что подтверждается отрицательными значениями приращений энтропии, энтальпии, энергии Гиббса.



