Любая водная экосистема, являясь открытой термодинамической системой, имеет сложную систему подвижных биологических связей, которые нарушаются под воздействием антропогенных факторов. Антропогенное влияние отражается не только на видовом составе водных сообществ и соотношении численности слагающих их видов, но и на качестве иловых сульфидных грязей.
В составе нативной грязи выделяется группа специфических органических компонентов – гуминовых веществ, представленных гумином и подвижными составляющими - гумусовыми кислотами. В составе гумусовых кислот пелоидов на основании их молекулярно-массового распределения, а также растворимости в различных средах принято выделять группы фульвовых, гиматомелановых и гуминовых кислот [1]. Это высокомолекулярные соединения нестехиометрического состава, характеризующиеся гетерогенностью, полимолекулярностью, поли-, гетерофункциональностью. Структура макромолекул изменчива, неупорядоченна и формируется под влиянием динамично образующихся и разрывающихся химических связей различной этиологии.
В настоящее время процесс образования гуминовых веществ – гумификация, рассматривается не просто как утилизация органических остатков, а как образование нового класса природных соединений, необходимых для обеспечения непрерывности современных жизненных форм [2]. Глобальной является биопротекторная функция гуминовых веществ, обусловленная связыванием в прочные комплексы как ионов металлов, так и органических экотоксикантов [3]. В связи с изложенным весьма актуальны не только вопросы экологической чистоты и безопасности применения нативной грязи, но и теоретические аспекты ее генеза.
Целью работы явилось исследование возможности применения теоретических приемов, позволяющих рассчитать основные термодинамические характеристики почв, для гумусовых кислот иловых низкоминерализованных сульфидных грязей, а также выявление взаимосвязи термодинамических функций гумусовых кислот с позиций классических представлений об их строении и экопротекторной роли в биосфере.
Материалы и методы. Определение углерода, водорода и азота проводили на анализаторе фирмы «Карло Эрба» при температуре 1010 °С при постоянном потоке гелия.
Термодинамические параметры рассчитывали по результатам элементного анализа, принятого для гумусовых кислот почв [1]. Теплоемкость (Ср) рассчитывали по уравнению:
Ср = 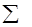 Сi ni, где Сi - атомная теплоемкость; ni - число атомов согласно простейшей формуле гумусовых кислот [4].
Сi ni, где Сi - атомная теплоемкость; ni - число атомов согласно простейшей формуле гумусовых кислот [4].
Для расчета абсолютной энтропии (S0) и энтропии образования (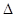 S0) использовали эмпирическую формулу подсчета абсолютной энтропии твердых веществ: S0 = 1,1 Ср.
S0) использовали эмпирическую формулу подсчета абсолютной энтропии твердых веществ: S0 = 1,1 Ср.
Абсолютная энтропия S0 и энтропия образования 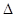 S0 кислородсодержащих органических соединений связаны уравнением:
S0 кислородсодержащих органических соединений связаны уравнением:
S0 = 1,03 + 0,039 ( 7 + 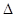 S0 )2, где S0 и
S0 )2, где S0 и 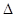 S выражены в Дж/К·г.
S выражены в Дж/К·г.
Для анализа природных объектов вычисляют энергию Гиббса, используя соотношение:
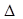 G0 = К
G0 = К 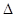 Н0, где К - коэффициент пропорциональности.
Н0, где К - коэффициент пропорциональности.
Для гумусовых кислот почв [5] установлена регрессионная зависимость
К = 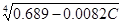 , где [C] – массовое содержание углерода в процентах.
, где [C] – массовое содержание углерода в процентах.
Зная величину К и энтропии образования 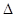 S0, после несложного преобразования уравнения Гиббса-Гельмгольца, рассчитывали стандартную энергию Гиббса образования гумусовых кислот:
S0, после несложного преобразования уравнения Гиббса-Гельмгольца, рассчитывали стандартную энергию Гиббса образования гумусовых кислот: 
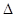 G0 = -К T
G0 = -К T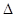 S0 / ( 1 - К ).
S0 / ( 1 - К ).
Значение энтальпии образования (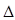 Н0) находили из уравнения:
Н0) находили из уравнения: 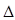 Н0 =
Н0 = 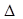 G0 / К.
G0 / К.
Результаты исследования и их обсуждение. Гумусовые кислоты пелоидов образуются в анаэробных сильно восстановительных условиях, обусловленных высоким содержанием сероводорода и сульфид-ионов, и существенно отличаются условиями формирования от почвенных кислот. Тем не менее нами за основу расчета термодинамических функций использованы подходы, предложенные для характеристики гумусовых кислот почв [4-6]. Отсутствие в научной литературе информации по исследованию термодинамических функций в ряду гумусовых кислот пелоидов обусловило наблюдение сезонных колебаний, которые не могут не влиять на химические и биологические свойства исследуемых соединений.
В таблицах 1-3 приведены результаты элементного анализа сезонных проб пелоидов, на основании которых рассчитаны термодинамические характеристики фракций.
Таблица 1
Элементный состав фульвокислот
|
Определяемый показатель |
Весна
|
Лето
|
Осень
|
|
|
Углерод |
Масс. |
31,61±0,90 |
25,06±0,71 |
31,18±1,10 |
|
Мольн. |
21,24±0,50 |
15,00±0,41 |
18,39±0,60 |
|
|
Водород |
Масс. |
5,82±0,15 |
7,61±0,22 |
7,69±0,21 |
|
Мольн. |
47,01±0,85 |
54,63±1,10 |
48,14±0,90 |
|
|
Азот |
Масс. |
1,98±0,03 |
3,13±0,06 |
2,49±0,03 |
|
Мольн. |
1,13±0,04 |
1,58±0,02 |
1,27±0,02 |
|
|
Кислород |
Масс. |
60,59±1,12 |
64,20±1,05 |
58,64±1,12 |
|
Мольн. |
30,61±0,60 |
28,79±0,51 |
25,93±0,80 |
|
Таблица 2
Элементный состав гиматомелановых кислот
|
Определяемый показатель |
Весна
|
Лето |
Осень
|
|
|
Углерод |
Масс. |
52,19±1,20 |
59,60±1,30 |
56,59±1,40 |
|
Мольн. |
32,41±0,60 |
36,33±0,95 |
34,71±1,10 |
|
|
Водород |
Масс. |
6,46±0,20 |
6,58±0,35 |
6,55±0,40 |
|
Мольн. |
48,14±0,90 |
48,10±1,20 |
48,16±1,50 |
|
|
Азот |
Масс. |
3,27±0,06 |
2,26±0,04 |
2,79±0,04 |
|
Мольн. |
1,71±0,03 |
1,17±0,03 |
1,47±0,02 |
|
|
Кислород |
Масс. |
38,08±1,20 |
31,56±1,20 |
34,07±1,40 |
|
Мольн. |
17,73±0,49 |
14,40±0,80 |
15,66±1,00 |
|
Для всех элементов сезонные колебания не выходят за пределы 10%. Исключение составляет азот, содержание которого изменяется от 1,47 до 2,79 и колебание равно ±19%.
Гуминовые кислоты обладают практически постоянным элементным составом независимо от времени года (табл.3), колебания здесь не превышают 6%.
Таблица 3
Элементный состав гуминовых кислот
|
Определяемый показатель |
Весна
|
Лето |
Осень
|
|
|
Углерод |
Масс. |
54,25±1,40 |
54,47±1,35 |
55,87±1,48 |
|
Мольн. |
37,70±1,10 |
41,23±0,95 |
39,26±0,83 |
|
|
Водород |
Масс. |
4,88±0,06 |
3,83±0,03 |
4,71±0,05 |
|
Мольн. |
40,70±1,60 |
34,79±0,75 |
39,68±1,10 |
|
|
Азот |
Масс. |
4,12±0,05 |
3,33±0,04 |
4,03±0,07 |
|
Мольн. |
2,42±0,03 |
2,18±0,03 |
2,44±0,05 |
|
|
Кислород |
Масс. |
36,75±1,20 |
38,38±1,10 |
35,39±1,10 |
|
Мольн. |
19,18±0,07 |
21,80±1,00 |
18,62±0,95 |
|
Поскольку истинные значения молярных масс гумусовых кислот неизвестны, то более корректно и информативно сопоставление термодинамических характеристик, отнесенных к единице массы вещества. Как видно из приведенных данных, значения удельной теплоемкости и абсолютной энтропии фульвокислот, рассчитанные на 1 грамм объекта исследования, несколько повышаются от весеннего периода к осеннему (табл. 4). Изменения энтропии, энтальпии, энергии Гиббса характеризуются убылью и достигают максимальных значений в осенний период. Таким образом, все термодинамические характеристики в случае фульвокислот достигают своих максимальных значений осенью.
Таблица 4
Термодинамические функции фульвокислот
|
Т/д функция |
Единицы измерения |
Сезон года |
||
|
Весна |
Лето |
Осень |
||
|
Cp |
Дж/К•моль |
995,25 |
884,09 |
873,72 |
|
Дж/К•г |
1,41 |
1,45 |
1,57 |
|
|
S0 |
Дж/моль |
729,03 |
628,49 |
597,98 |
|
Дж/г |
1,03 |
1,03 |
1,07 |
|
|
DS0 |
Дж/моль |
-4900,10 |
-4361,44 |
-4465,27 |
|
Дж/г |
-6,92 |
-7,15 |
-8,01 |
|
|
DH0 |
кДж/моль |
-7685,40 |
-6501,80 |
-7003,50 |
|
кДж/г |
-10,86 |
-10,66 |
-12,57 |
|
|
DG0 |
кДж/моль |
-6225,20 |
-5202,10 |
-5672,80 |
|
кДж/г |
-8,79 |
-8,53 |
-10,20 |
|
Таблица 5
Термодинамические функции гиматомелановых кислот
|
Функция |
Единицы измерения |
Сезон года |
||
|
Весна |
Лето |
Осень |
||
|
Cp |
Дж/К·моль |
599,30 |
825,66 |
683,58 |
|
Дж/К·г |
1,37 |
1,24 |
1,36 |
|
|
S0 |
Дж/моль |
466,00 |
822,15 |
546,24 |
|
Дж/г |
1,07 |
1,24 |
1,09 |
|
|
DS0 |
Дж/моль |
-2640,84 |
-3140,59 |
-2916,43 |
|
Дж/г |
-6,03 |
-4,72 |
-5,81 |
|
|
DH0 |
КДж/моль |
-2713,70 |
-2836,10 |
-2803,50 |
|
КДж/г |
-6,22 |
-4,30 |
-5,59 |
|
|
DG0 |
КДж/моль |
-1926,70 |
-1900,20 |
-1934,40 |
|
КДж/г |
-4,41 |
-2,86 |
-3,86 |
|
Таблица 6
Термодинамические функции гуминовых кислот
|
Функция |
Единицы измерения |
Сезон года |
||
|
Весна |
Лето |
Осень |
||
|
Cp |
Дж/К·моль |
422,63 |
469,83 |
414,37 |
|
Дж/К·г |
1,23 |
1,14 |
1,21 |
|
|
S0 |
Дж/К моль |
417,40 |
559,38 |
429,43 |
|
Дж/Кг |
1,21 |
1,36 |
1,25 |
|
|
DS0 |
Дж/К моль |
-1673,22 |
-1688,70 |
-1593,57 |
|
Дж/К г |
-4,86 |
-4,09 |
-4,64 |
|
|
DH0 |
кДж/моль |
-1673,22 |
-1688,75 |
-1531,90 |
|
кДж/г |
-4,90 |
-4,09 |
-4,46 |
|
Сезонная вариативность позволила выявить общие тенденции изменений термодинамических характеристик, но она не имеет катастрофических значений, поэтому для проведения сравнительного анализа фракций гумусовых кислот пелоидов использованы средние значения термодинамических параметров с учетом всех сезонных значений (табл. 7).
Таблица 7
Средние термодинамические функции в ряду гумусовых кислот
|
Функция |
Единицы измерения |
Фульвокислоты |
Гиматомелановые кислоты |
Гуминовые кислоты |
|
Молекулярная масса, а.е.м. |
14951 |
27029 |
63612 |
|
|
Ср |
Дж/К моль |
917,68 |
702,85 |
435,60 |
|
Дж/К г |
1,47 |
1,32 |
1,18 |
|
|
S0 |
Дж/К моль |
651,83 |
611,5 |
468,74 |
|
Дж/К г |
1,04 |
1,14 |
1,27 |
|
|
DS0 |
Дж/К моль |
-4575,60 |
-2899,29 |
-1651,83 |
|
Дж/К г |
-7,33 |
-5,42 |
-4,49 |
|
|
DH0 |
кДж/моль |
-7063,60 |
-2784,40 |
-1631,29 |
|
кДж/г |
-11,31 |
-5,21 |
-4,43 |
|
|
DG0 |
кДж/моль |
-5700,00 |
-1920,43 |
-1372,40 |
|
кДж/г |
-9,13 |
-3,92 |
-3,73 |
Массовая удельная теплоемкость вещества зависит от атомной теплоемкости элементов, входящих в состав молекулы. Теплоемкость фульвокислот, по нашим результатам, составляет 1,47 кДж К/г, что больше показателей теплоемкости гуминовых и гиматомелановых кислот в 1,25 и 1,1 раза соответственно. Это связано с элементным составом фульвокислот (таблица 1), в которых превалирует массовая доля кислорода. По справочным данным, теплоемкость кислорода выше, чем у водорода, и еще выше, чем у углерода.
Абсолютная энтропия гумусовых кислот, характеризующая степень неупорядоченности молекул, в исследуемом ряду возрастает от фульвокислот к гуминовым, что согласуется с фактом более высокой энтропии образования молекул ароматического ряда по сравнению с алифатическими соединениями и свидетельствует о преобладании ароматических фрагментов в структуре гуминовых кислот. Фульвокислоты, как фракция с наименьшей молекулярной массой, характеризуются большей упорядоченностью структурных фрагментов по сравнению с высокомолекулярными фракциями гуминовых и гиматомелановых кислот, имеющих надмолекулярные взаимодействия различной этиологии.
Величины энтальпии (DH0) для всех гумусовых кислот имеют отрицательные значения, возрастающие от гуминовых к фульвокислотам (таблица 7), что характеризует более высокую энергоемкость фульвокислот в связи с повышенным содержанием в их составе атомов кислорода.
Интегральным показателем, связывающим энтальпийный и энтропийный факторы, является величина свободной энергии Гиббса (DG0). Отрицательные значения DG0 для исследуемых объектов возрастают от гуминовых к фульвокислотам, что свидетельствует о предпочтительном образовании более низкомолекулярной фракции. Это логично с позиций формирования высокомолекулярных субстратов гуминовых и гиматомелановых кислот, структура которых представляет собой стохастический клубок постоянно меняющейся формы за счет непрерывных процессов образования и разрушения межмолекулярных связей. В процессе переработки микроорганизмами фульвокислоты включаются в процессы образования более высокомолекулярных фракций гумусовых кислот, являясь, таким образом, их генетическими предшественниками. Гиматомелановые и фульвокислоты более активно участвуют в процессах жизнедеятельности микроорганизмов, выступая для них более доступным энергетическим материалом.
Процесс формирования гумусовых кислот носит энтальпийно-энтропийный характер, и уменьшение доли атомов кислорода с одновременным ростом степени хаотичности структур в ряду фульвовых – гиматомелановых – гуминовых кислот адекватно отражается в изменении всех термодинамических характеристик изучаемых объектов.
Выводы
1. Теоретические приёмы расчёта основных термодинамических характеристик почв применены к расчёту термодинамических характеристик гумусовых кислот иловых низкомолекулярных сульфидных грязей.
2. Массовая удельная теплоёмкость, зависящая от атомной теплоёмкости элементов, составляющих вещество, максимальна в случае фульвокислот, что можно объяснить высокой массовой долей в них атомов кислорода, теплоёмкость которых выше, чем теплоёмкость атомов водорода и углерода.
3. Рассчитанные значения ряда термодинамических параметров для фульвовых, гиматомелановых и гуминовых кислот в разные сезоны года подтверждают наибольшую вероятность самопроизвольного протекания процесса гумификации в тёплое время года.
4. Возрастание отрицательных значений энергии Гиббса от гуминовых кислот через гиматомелановые к фульвокислотам свидетельствует, по-видимому, о предпочтительном образовании более низкомолекулярной фракции с дальнейшим превращением её в более высокомолекулярные гуминовые кислоты.
5. Образование гумусовых кислот носит энтальпийно-энтропийный характер, происходит с выделением тепла и образованием стохастического клубка высокомолекулярных биополимеров, сопровождается образованием новых связей различной природы, что подтверждается отрицательными значениями приращений энтропии, энтальпии, энергии Гиббса.
Библиографическая ссылка
Аввакумова Н.П., Шарипова С.Х., Кривопалова М.А., Жданова А.В., Катунина Е.Е., Глубокова М.Н., Фомин И.В. СРАВНИТЕЛЬНЫЙ АНАЛИЗ ТЕРМОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК ГУМУСОВЫХ КИСЛОТ ПЕЛОИДОВ // Современные проблемы науки и образования. 2017. № 6. ;URL: https://science-education.ru/ru/article/view?id=27214 (дата обращения: 22.01.2026).



