Тотальное эндопротезирование на данный момент является самым эффективным хирургическим вмешательством при лечении пациентов с поздними стадиями заболеваний и тяжелыми последствиями травм тазобедренного сустава. В то же время данная операция сопряжена с рядом серьезных осложнений, одним из которых является развитие перипротезной инфекции, требующей больших экономических затрат на лечение и значительно снижающей качество жизни пациентов [1]. Согласно данным национальных регистров ряда стран и некоторых эпидемиологических исследований перипротезная инфекция является третьей по частоте причиной ревизионных операций после первичного эндопротезирования тазобедренного сустава [2] и наиболее распространенной причиной неблагоприятного исхода эндопротезирования в ранние сроки [3]. Еще более грозно выглядит ситуация в Российской Федерации. По данным регистра РНИИТО им. Р.Р. Вредена перипротезная инфекция на протяжении нескольких лет уверенно занимает второе место среди причин ревизионного эндопротезирования [4].
При этом, как показали I.S. Vanhegan с соавторами, клинические результаты после ревизионных вмешательств по поводу септических осложнений эндопротезирования тазобедренного сустава гораздо менее благоприятны, чем при асептических ревизиях [5], а финансовая нагрузка на национальное здравоохранение существенно возрастает. Так, Kevin Bozic с коллегами установили, что общий объем прямых медицинских расходов, связанных с септическими ревизиями, был в 2,8 раза выше, чем при асептических, и в 4,8 раза выше, чем при первичном эндопротезировании [6].
Соответственно, предотвращение инфекционных осложнений является важнейшей задачей первичного эндопротезирования и зависит не только от соблюдения общих принципов асептики, но и от корректности проводимой антибиотикопрофилактики (АП). Под периоперационной антимикробной профилактикой подразумевают предупреждение инфекций, возникающих вследствие оперативных вмешательств либо имеющих прямую связь с ними, но не лечение фоновой инфекции. Её суть заключается в достижении необходимых концентраций антибиотиков в тканях до момента их возможной контаминации и поддержании этого уровня в течение всей операции и первых 3–4 ч. после оперативного вмешательства. В США группой экспертов принят стандарт качества АМП инфекции области хирургического вмешательства [7], в соответствии с которым антибиотикопрофилактика показана при всех ортопедических операциях, сопровождающихся установкой металлоконструкций.
В литературе выделяют 4 схемы АП: 1) ультракраткая – 1-я доза во время премедикации, 2-я вводится только при 3-х часовых и более операциях; 2) краткая – во время премедикации и затем 2–3 дозы препарата в течение суток; 3) укороченная – за 1,5–2 часа до операции и в течение 48 часов после операции; 4) продолжительная – за 12 часов и более до операции и несколько дней после операции [3, 8].
Группа канадских учёных провела исследование, в котором оценивала назначение антибиотикопрофилактики 590 хирургами-ортопедами, выполняющими тотальное эндопротезирование тазобедренного сустава [9]. При первичном тотальном эндопротезировании цефазолин был наиболее часто назначаемым антибиотиком (97,3 %). 26 % исследуемых назначали ванкомицин в качестве препарата первого выбора, либо в случаях, когда у пациента в анамнезе наблюдались случаи аллергических реакций к пенициллину. Из числа опрошенных респондентов 48,5 % начинают введение антибиотиков пациенту непосредственно в операционном блоке, и 90 % врачей отметили, что рутинно начинают антимикробную профилактику менее чем за 60 минут до разреза кожи. 91 % респондентов используют стандартные дозы антибиотика для всех пациентов, и только 7,5 % корректируют дозировку препаратов в зависимости от веса пациента. Наиболее распространенная дозировка цефазолина была 1 гр. (70,2 %), и только 29,8 % использовали препарат в дозировке 2 г. 95 % врачей назначают Ванкомицин в дозе 1 г, и 5 % корректируют дозу в зависимости от индивидуальных особенностей пациента. Продолжительность послеоперационной антимикробной профилактики существенно различалась, но чаще (42 %) профилактику проводили в течение 24 часов. В противовес этому в русскоязычной литературе большинство авторов применяют антибиотики для профилактики минимум двое суток, а многие считают необходимым введение антибиотиков в течение пяти дней, при этом хирурги стремятся использовать антибиотики широкого спектра или даже комбинацию двух антибактериальных средств [10].
Цель исследования
Цель нашего исследования заключалась в том, чтобы сравнить клиническую и экономическую эффективность краткой и продолжительной схем антимикробной профилактики (АМП) при первичном эндопротезировании тазобедренного сустава.
Материалы и методы
В исследование были включены 120 пациентов, поступивших в клинику для выполнения операции первичного тотального эндопротезирования тазобедренного сустава. Критерием включения был возраст пациентов моложе 70 лет и стандартное течение операции по замене сустава. Критерии исключения: наличие системных заболеваний и обменных артритов (ревматоидный артрит, системная красная волчанка, подагра и т.д.); наличие очагов хронической инфекции; сахарный диабет I и II типов; предшествующие операции на тазобедренном суставе; использование активных дренажей после тотального протезирования тазобедренного сустава. Пациенты были разделены на 2 группы: основную группу составили 60 пациентов, которым антимикробная профилактика проводилась в течение 24 часов после операции, в группе сравнения, также состоящей из 60 пациентов, антимикробная профилактика проводилась в течение 3–5 суток после операции. Группы были однородны по полу, возрасту, длительности оперативного вмешательства, кровопотере и срокам пребывания в стационаре после операции (табл. 1).
Таблица 1
Сравнительная характеристика групп пациентов
|
Основная группа (95% ДИ) |
Группа сравнения(95% ДИ) |
Статистическая значимость (р) |
|
|
Кол-во (N) |
60 |
60 |
|
|
Пол |
М – 16, Ж – 44 |
М – 14, Ж - 46 |
|
|
Средний возраст |
56,9 (от 53,5 до 60,3) |
53,8 (от 48,9 до 58,6) |
p = 0,8 |
|
Койко-день |
12,0 (от 11,3 до 12,6) |
12,1 (от 11,4 до 12,8) |
p = 0,99 |
|
Длительность операции (мин) |
86,7 (от 78,0 до 95,4) |
82,3 (от 75,5 до 89,1) |
p = 0,71 |
|
Кровопотеря (мл) |
295,0 (от 251,6 до 338,4) |
276,7 (от 225,8 до 327,6) |
p = 0,59 |
Всем пациентам АМП выполняли цефазолином. Антимикробная профилактика в обеих группах проводилась по схемам, представленным в таблице 2.
Таблица 2
Схема антимикробной профилактики цефазолином в исследуемых группах
|
Основная группа |
Группа сравнения |
|
1 сутки: |
3 – 5 дней: |
|
- 2 гр. за 30–60 минут до операции - 1-е сутки после операции по 1 гр. каждые 8 часов. |
- 2 гр. за 30–60 мин. до операции - 1-е сутки после операции по 1 гр. каждые 8 часов. - 2–4 дня по 1 гр. 3 раза в день. |
У пациентов обеих групп оценивали динамику температуры тела в течение 10 дней после операции, количество лейкоцитов до операции, на 1, 3, 5, 7-е и 10-е сутки; количество нейтрофилов и СОЭ до операции и на 3, 5, 7-е и 10-е сутки; уровень СРБ до операции и на 5, 7-е и 10-е сутки.
При расчёте финансовых затрат на антимикробную профилактику в основной группе и группе сравнения учитывали прямые затраты на лекарственный препарат, шприцы и расходные материалы. Для оценки трудозатрат среднего медицинского персонала проводили мониторирование времени на разведение антибиотика, выполнение инъекций и утилизацию шприцев.
По полученным данным проводился расчёт средних величин численных показателей с доверительными интервалами. Сравнение количественных параметров осуществлялось с использованием критерия Манна – Уитни в статистическом пакете общего назначения Instat+ версии 3.37 [11].
Результаты
При оценке температурных кривых в послеоперационном периоде у 40 % пациентов основной группы не наблюдалось повышения температуры выше 37,0 гр., в группе сравнения не было повышения температуры только у 20 % пациентов. Лихорадка в течение 1–2 дней продолжалась в основной группе и группе сравнения у 33,3 % и 50 % пациентов соответственно, а в течение 6–10 дней – у 1 и 2-х пациентов соответственно, причём максимальный показатель температуры превышал 38,0 градусов лишь в двух случаях (табл. 3).
Таблица 3
Показатели температуры у пациентов исследуемых групп в послеоперационном периоде
|
Число дней лихорадки |
Основная группа n= 60 (%) |
Группа сравнения n = 60 (%) |
|
0 |
24 (40,0 %) |
12 (20 %) |
|
1–2 |
20 (33,3 %) |
30 (50 %) |
|
3–5 |
14 (23,3 %) |
14 (23,3 %) |
|
6–10 |
2 (3,4 %) |
4 (6,7 %) |
Количество лейкоцитов и нейтрофилов до и после операции в обеих группах практически не отличалось и не превышало допустимых норм (рис. 1, 2).
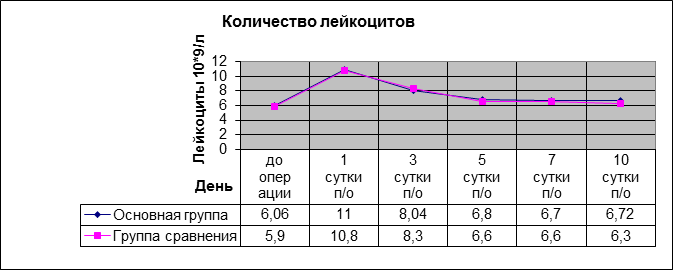
Рис. 1. Количество лейкоцитов в послеоперационном периоде в основной группе и группе сравнения
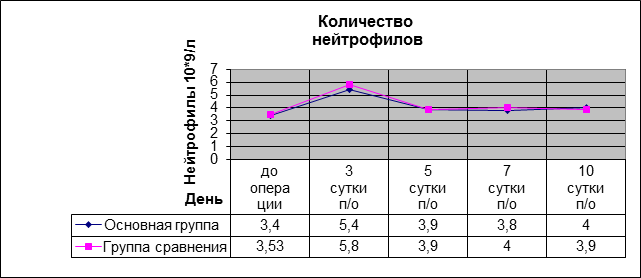
Рис. 2. Количество нейтрофилов в послеоперационном периоде в основной группе и группе сравнения
Уровень СРБ и СОЭ в основной группе на 5-е сутки с момента операции были несколько выше, чем в группе сравнения, однако также не превышали допустимых границ и имели сходную динамику снижения (рис. 3, 4).
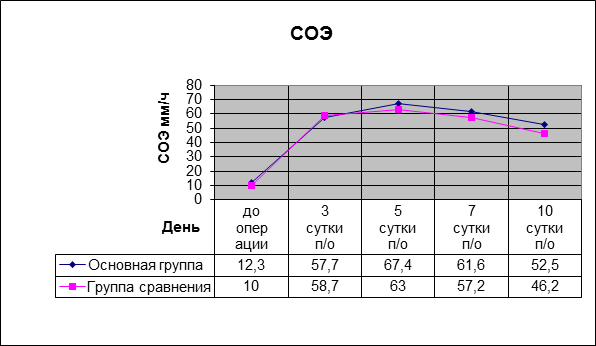
Рис. 3. СОЭ в послеоперационном периоде в основной группе и группе сравнения
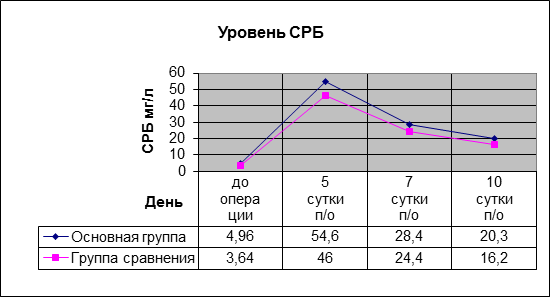
Рис. 4. Уровень СРБ в послеоперационном периоде в основной группе и группе сравнения
Отклонения от нормального течения послеоперационного периода были отмечены у 2-х пациентов. В одном случае, у пациента основной группы развился некроз участка краёв послеоперационной раны и было продолжено введение цефазолина до 10 суток. В другом случае, у пациента группы сравнения сформировалась гематома в области тазобедренного сустава, эвакуированная с помощью пункций области хирургического вмешательства на 5-е и 7-е сутки. Так же, как и в первом случае, пациенту было продолжено введение цефазолина до 10 суток. Дополнительной АБ-терапии или ревизии операционной раны в обоих случаях не потребовалось.
При выполнении анализа финансовых затрат различных схем антимикробной профилактики за единицу была принята стоимость антибиотика (табл. 4).
Таблица 4
Анализ финансовых затрат при различных схемах антимикробной профилактики
|
Наименование затрат |
1 сутки |
3 суток |
5 суток |
|
|
В операционной и ПИТ |
Расходный материал |
3,95 |
3,95 |
3,95 |
|
Антибиотик |
1 |
1 |
1 |
|
|
В отделении |
Расходный материал |
- |
2,3 |
3,9 |
|
Антибиотик |
- |
2,25 |
3,75 |
|
|
Итого: |
4,95 |
9,5 |
12,6 |
|
Расчёт финансовых затрат показал, что пятидневная АМП обходилась практически в 1,5 раза дороже трехдневной и в 2,5 раза дороже суточной антимикробной профилактики.
При расчёте трудозатрат процедурной медсестры отделения при условии выполнения 5 операций первичного тотального эндопротезирования тазобедренного сустава в день, 5 рабочих дней в неделю, набор шприцов, выполнение инъекций и утилизация шприцов в среднем увеличивает нагрузку на медицинскую сестру при трёхдневной АМП более чем на 2 часа в сутки, а при пятидневной антимикробной профилактике – практически на 4 часа (табл. 5).
Таблица 5
Трудозатраты на выполнение инъекций
|
Трудозатраты |
Время, мин. |
|
Набрать 10 шприцов лекарства |
10 |
|
Выполнить 10 инъекций |
10 |
|
Утилизировать шприцы |
10 |
|
Итого: |
30 |
Обсуждение
Современные данные о частоте развития инфекционных осложнений после первичного эндопротезирования весьма противоречивы. Достаточно популярная точка зрения отражена в публикации L.B. Engesæter с соавторами, основанной на данных Норвежского регистра, где указано, что частота инфекции снизилась с 5–10 % в 60-х годах до, приблизительно, одного процента на сегодняшний день [12]. Похожие цифры приводятся в других аналитических публикациях, основанных на данных национальных регистров, так совокупная частота инфекционных осложнений по объединенным данным NARA (The Nordic Arthroplasty Register Association) составила лишь 0,6 %. Но в регистрах отмечаются не все случаи инфекции. И другие тщательно проанализированные большие массивы данных показывают, что только в первые три месяца количество инфекционных осложнений достигает 1,3 %, а в последующем превышает два процента [13]. Сравнение записей регистра эндопротезирования и базы данных расхода лекарственных средств в Швеции продемонстрировало, что 4,5 % пациентов получали антимикробную терапию минимум на протяжении четырех недель в течение двух лет после первичного ЭП ТБС [14]. Все эти данные свидетельствуют о том, что инфекционных осложнений при первичной артропластике ТБС в целом существенно больше, чем принято считать, и одной из причин этого является нерациональная антимикробная профилактика, приводящая к развитию антибиотикоустойчивых госпитальных штаммов микроорганизмов. В то же время лидирующие возбудители перипротезной инфекции – представители Staphylococcus sp., большинство из которых сохраняют чувствительность к цефазолину [15].
Факторы риска развития перипротезной инфекции хорошо известны и включают в себя пожилой возраст, ожирение, сахарный диабет, приём гормональных препаратов, наличие у пациента злокачественных новообразований, системные заболевания, ранее перенесённые хирургические вмешательства на оперируемом суставе, длительное дренирование послеоперационной раны, наличие гематом [3].
Современная концепция антимикробной профилактики подразумевает подавление активности микроорганизмов на момент выполнения операции и в первые часы после нее. При исключении основных факторов риска развития послеоперационных осложнений, как показывает наше исследование, отсутствует целесообразность использования более длительных схем антимикробной профилактики, и краткосрочная схема не менее эффективна, что подтверждается результатами лабораторных исследований и данными температурных кривых. Немалое значение для медицинских учреждений играет экономический фактор – краткосрочная профилактика требует в 2–2,5 раза меньше финансовых и трудозатрат медперсонала. Риск развития нежелательных лекарственных реакций при введении АБ ниже при краткосрочной АМП и помогает избежать развития потенциальной резистентности микроорганизмов к антимикробным препаратам, что при необходимости выполнения ревизионных вмешательств позволит назначать менее дорогие антибиотики с лучшей чувствительностью микрофлоры.
Выводы
Проведенное нами исследование поддерживает наиболее распространенную точку зрения о высокой эффективности краткосрочной схемы, не более 24 часов, антимикробной профилактики. Такая продолжительность назначения антибиотиков позволяет значительно уменьшить финансовые расходы учреждения здравоохранения и уменьшить нагрузку на средний медицинский персонал.



