Микробиоценоз пищеварительного тракта человека составляет более 500 видов микроорганизмов, при этом их количество в различных отделах желудочно-кишечного тракта неодинаково и варьирует в широком диапазоне. Наиболее многочисленными представителями нормофлоры кишечника являются Lactobacillus sp., Bifidobacterium sp., E. coli, Bacterioides sp., Clostridium sp., анаэробные стрептококки и другие микроорганизмы. Микрофлора ЖКТ участвует в процессах переваривания и всасывания, обеспечивает трофику кишечника, синтез витаминов, антиинфекционную защиту [1; 7].
Экзогенные и эндогенные факторы могут оказывать существенное влияние на качественный состав кишечной нормофлоры, что в свою очередь не только нарушает течение физиологических процессов, но и способствует развитию тяжелых патологических состояний. Количественное и качественное изменение состава кишечной нормофлоры называют дисбактериозом кишечника. Наиболее распространенной причиной развития дисбактериоза является антимикробная химиотерапия, оказывающая прямое антагонистическое действие на представителей нормофлоры и существенно изменяющая «микробный пейзаж» пищеварительного тракта. В связи с этим при лечении антибиотиками и другими антимикробными препаратами рационально назначение пробиотических лекарственных средств во время проведения антибактериальной химиотерапии.
Успехом комплексного применения антибиотика и пробиотика является субэффективная концентрация антимикробного препарата в пищеварительном тракте и определенная резистентность пробиотического штамма к АМП. Пероральный прием антимикробного препарата дает возможность использования временного интервала, что в свою очередь позволяет назначать пробиотический препарат после снижения концентрации антибиотика в просвете кишечника до минимальных значений. Помимо этого, возможно использование сведений о резистентности пробиотических штаммов к АМП [2; 4; 6].
Также необходимо учитывать, что эффективность комплексной терапии повышается в том случае, если и пробиотический штамм и антибиотик являются синергистами, так как их совместное действие снижает частоту появления побочных эффектов этиотропной терапии и повышает эффективность эрадикационной. Таким образом, совместное применение антибиотиков и пробиотиков позволит снизить риск развития дисбактериоза или уменьшить его тяжесть.
Исходя из выше перечисленного перед нами была поставлена следующая цель исследования: определение эффективности совместного применения пробиотиков на основе бактерий рода Bacillus с антибиотиками.
Объектами наших исследований являлись чистые культуры пробиотических штаммов микроорганизмов: Bacillus subtilis 534 (из биопрепарата «Споробактерин»), Васillus сеrеus IР 5832 (из биопрепарата «Бактисубтил»), а также были получены отдельные чистые культуры Васillus subtilis ВКПМ В 7038 и Васillus licheniformis ВКПМ В 7048, входящие в состав «Ветом 2».
Для определения антибиотикорезистентности бактерий рода Bacillus, входящих в состав пробиотиков, нами использовались следующие методы: метод определения антибиотикорезистентности бактерий рода Bacillus с применением тест-систем Bio Merieux; диско-диффузионный метод (ДДМ) определения антибиотикорезистентности; метод последовательных разведений [5].
Для определения антибиотикопродуктивности бактерий рода Bacillus, входящих в состав пробиотиков, нами использовались следующие методы: метод определения антибиотикопродуктивности микроорганизмов на твердых питательных средах (метод агаровых блочков); метод определения антибиотикопродуктивности микроорганизмов при культивировании их в жидких питательных средах (метод с агаровыми лунками) [5].
Оценку эффективности совместного применения антибиотиков и пробиотиков определяли по следующей схеме (рисунок 1).
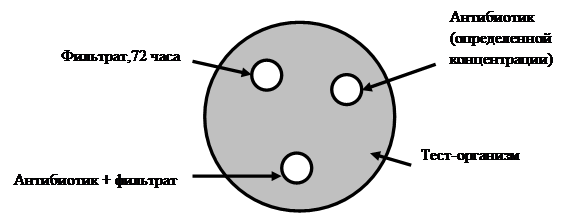
Рис. 1. Схема определения влияния антибиотика и пробиотика на подавление тест-организма в отдельности и совместно
Чашки Петри с МПА засеяли сплошным «газоном» тест-организмами (Staphylococcus aureus, Escherichia coli, Salmonella enteritidis). Затем с помощью пробойника сделали три лунки (диаметр 6 мм) и внесли: в первую 30 мкл фильтрата, инкубированного 72 часа + 30 мкл физраствора, во вторую – 30 мкл антибиотика определенной концентрации, к которому условно-патогенные микроорганизмы оказались умеренно чувствительными + 30 мкл питательного бульона, а бактерии рода Bacillus – устойчивы, а в третью лунку – 30 мкл фильтрата + 30 мкл антибиотика, для того чтобы определить их влияние друг на друга.
Первоначальным этапом нашего исследования было определение антибиотикорезистентности пробиотических препаратов («Споробактерин», «Бактисубтил», «Ветом 2») на основе бактерий рода Bacillus с применением тест-систем Bio Merieux и ДДМ.
Критерием отбора антибиотиков для ДДМ, к которым исследуемые штаммы микроорганизмов проявляли резистентность, послужило определение антибиотикочувствительности с использованием тест-систем Bio Merieux, чтобы отобрать антибиотики, к которым бактерии рода Bacillus устойчивы, а тест-организмы – умеренно чувствительны. В соответствии с данным методом было установлено, что все четыре штамма бактерии рода Bacillus оказались устойчивы к пенициллину, оксациллину, тикарциллину, мециллинаму, цефуроксиму, цефтазидиму, цефлулодину, цефиксиму, цефотаксиму, имипенему, линкомицину, хлорамфениколу, азтреонаму и колистину.
S.еnteritidis оказалась умеренно чувствительна к пенициллину, ко всем антибиотикам из группы аминогликозидов, к цефуроксиму, цефокситину, цефоперазону, цефиксиму, цефотаксиму и хлорамфениколу.
На следующем этапе антибиотикорезистентность проверяли ДДМ с использованием стандартных дисков, содержащих антибиотики (табл.1).
Таблица 1
Сравнительная таблица по антибиотикорезистентности бактерий рода Bacillus, входящих в состав пробиотиков, с применением ДДМ (мм)
|
Антибиотики |
Исследуемые тест-организмы |
||||
|
B. subtillis 534 |
B. cereus 5832 |
B. lichenoformis ВКПМ В 7048 |
B. subtillis 7038 |
S. еnteritidis |
|
|
1 |
2 |
3 |
4 |
5 |
8 |
|
Penicilline |
25,0±0,58 |
R |
R |
21,7±0,33** |
20,7±0,67** |
|
Ampicilline |
26,0±0,58 |
17,7±0,33*** |
30,7±0,67 |
24,3±0,33* |
25,7±0,67 |
|
Oxacilline |
30,3±0,33 |
14,7±0,33*** |
26,0±0,58** |
22,0±0,58*** |
R |
|
Streptomycine |
25,3±0,33 |
34,0±0,58 |
32,0±0,58 |
32,0±0,58 |
18,3±0,33*** |
|
Kanamycine |
27,0±0,58 |
20,7±0,67** |
25,0±0,58 |
25,0±0,58 |
22,0±0,58** |
|
Gentamicine |
35,0±0,58 |
30,3±0,88* |
29,7±0,33** |
29,3±0,33** |
23,7±0,33*** |
|
Netilmicine |
33,3±0,33 |
34,0±0,58 |
26,0±0,58*** |
32,3±0,88 |
21,3±0,67*** |
|
Cefalexine |
35,0±0,58 |
29,7±0,33** |
29,7±0,33** |
32,3±0,67* |
29,3±0,33** |
|
Cefotaxime |
36,3±0,67 |
20,0±0,58*** |
R |
R |
12±0,33*** |
|
Cefasoline |
30,7±0,67 |
32,7±0,33 |
32,3±0,33 |
30,3±0,88 |
32,0±1,00 |
|
Cefixime |
20,0±0,58 |
R |
R |
15,0±0,58** |
29±1.76 |
|
Меропенем |
34,0±0,58 |
32,0±0,58 |
29,3±0,67 |
35,3±0,33 |
30,0±0,58** |
|
Imipeneme |
45,7±0,67 |
38,0±1,15** |
41,3±0,67* |
41,0±0,58** |
22,0±0,58*** |
|
Aztreonam |
R |
R |
R |
R |
R |
|
Vancomycine |
21,3±0,88 |
17,7±0,33* |
18,7±0,67 |
16,7±0,67* |
22,7±0,33 |
|
Tetracycline |
25,3±0,33 |
21,3±0,33** |
22,7±0,33** |
26,3±0,33 |
22,0±1,15* |
|
Lincomycine |
20,0±0,58 |
18,0±0,58 |
21,0±0,58 |
25,7±0,67 |
13,3±0,67** |
|
Clindomycine |
26,7±0,67 |
29,3±0,67 |
27,0±0,58 |
28,0±0,58 |
R |
|
Erythromycine |
33,0±0,58 |
28,3±0,88* |
26,0±0,58** |
30,3±0,33* |
R |
|
Chlorampheni-kol |
R |
22±0,91 |
24±0,58 |
27±0,17 |
13±0,21 |
|
Colistine |
R |
R |
R |
R |
16,7±0,67 |
|
R – устойчивость к антибиотикам; * Р < 0,050; ** Р < 0,010; *** Р < 0,001. |
|||||
По результатам ДДМ B. licheniformis 7048 и B. subtilis 7038 оказались устойчивыми к цефотаксиму, азтреонаму, а B. cereus и B. licheniformis еще и к пенициллину, а B. subtillis 534 устойчив к хлорамфениколу. Все четыре штамма бактерии рода Bacillus проявили чувствительность к аминогликозидам, тетрациклинам, линкозамидам, макролидам. Полученные результаты полностью соответствуют результам, полученным Дроздовой Е.А. и Щербаковой Н.В. при изучении резистентности пробиотических штаммов микроорганизмов к антибиотикам [3].
Наиболее устойчивым является штамм B. cereus 5832, поскольку дает наименьшие зоны подавление антибиотиками, а B. subtillis 534 более чувствителен к антибиотикам, так как для него характерны наибольшие зоны подавления роста. S. еnteritidis как тест-организм является устойчивой ко многим антибиотикам.
Исходя из проведенных предварительных исследований нами были отобраны те антибиотики, к которым бактерии рода Bacillus оказались устойчивыми (Пенициллин и «Бактисубтил»; Цефотаксим и «Ветом 2» Хлорамфеникол и «Cпоробактерин»), а S. еnteritidis умеренно чувствительна.
Следующим этапом было определение минимально подавляющих концентраций (МПК) изучаемых антибиотиков на рост исследуемых микроорганизмов. с этой целью мы использовали метод последовательных разведений (табл. 2).
Таблица 2
Определение МПК пенициллина, цефотаксима, хлорамфеникола методом последовательных разведений
|
Исследуемые объекты |
Антибиотик |
Разведение антибиотиков |
||||||||||
|
1:1 |
1:2 |
1:4 |
1:8 |
1:16 |
1:32 |
1:64 |
1:128 |
1:256 |
1:512 |
|||
|
Концентрация, ЕД |
1 млн |
500 тыс. |
250 тыс. |
125 тыс. |
62,5 тыс. |
31,25 тыс. |
15,63 тыс. |
7,81 тыс. |
3,9 тыс. |
1,95 тыс. |
||
|
B. cereus |
Пенициллин |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
|
|
S. etnteritidis |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
||
|
Концентрация, г |
5 |
2,5 |
1,25 |
0,63 |
0,32 |
0,16 |
0,08 |
0,04 |
0,02 |
0,01 |
||
|
B. licheniformis ВКПМ В 7048 |
Цефотаксим |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
|
|
B. subtilis 7038 |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
||
|
S. etnteritidis |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
||
|
B. subtilis 534 |
Хлорамфеникол |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
+ |
|
|
S. etnteritidis |
- |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
||
Анализ ряда разведений растворов антибиотиков позволил определить концентрации, которые оказывают бактерицидное и бактериостатическое действие на исследуемые микроорганизмы, а также концентрации, которые не оказывают влияния на рост.
Для решения второй задачи нами проводились исследования по изучению антибиотикопродуктивности бактерий рода Bacillus, в ходе которых была выявлена их антагонистическая активность относительно тест-организмов.
В первую очередь мы попытались определить, на какие сутки происходит наибольшая выработка антибиотикоподобных веществ в питательную среду. Для этого мы использовали метод с агаровыми лунками. Бактерии рода Bacillus выращивали в питательном бульоне в течение 48, 72 и 96 часов. В дальнейшем опыте использовали фильтрат от бактерий, по результатам которого установили, что максимальная выработка антибиотикоподобных веществ осуществляется через 72 часа культивирования микроорганизма. Это можно объяснить ростом популяции бактерий и конкуренцией за питательные компоненты среды.
Изначально антибиотикопродуктивность бактерий рода Bacillus изучили при их культивировании на твердых питательных средах с использованием метода агаровых блочков (табл. 3).
Таблица 3
Сравнительная таблица по антибиотикопродуктивности бактерий рода Bacillus методом агаровых блочков
|
Название штамма |
B.subtillis 534 |
B.cereus IP 5832 |
B.lichenoformis ВКПМ В 7048 |
B.subtillis ВКПМ В 7038 |
|
S. enteritidis |
26,0±0,58 |
22,7±0,33 |
23,3±0,33 |
24,3±0,67 |
Дальнейшие исследования по определению антибиотикопродуктивности бактерий рода Bacillus проводили при культивировании на жидких питательных средах методом агаровых лунок и методом наложения дисков, пропитанных антибиотиками. Данные по зонам подавления тест-организма Salmonella enteritidis методом агаровых лунок представлены в табл. 4.
Таблица 4
Сравнительный анализ антибиотикопродуктивности бактерий рода Bacillus
методом агаровых лунок
|
Название штамма |
B.subtillis 534 |
B.cereus IP 5832 |
B.lichenoformis ВКПМ В 7048 |
B.subtillis ВКПМ В 7038 |
|
S. enteritidis |
11,0±0,58 |
8,7±0,33 |
10,3±0,33 |
9,3±0,67 |
Анализ экспериментальных данных (табл. 4) свидетельствует о том, что выраженной антагонистической активностью в отношении тест-организмов обладает штамм B. subtillis 534, а наименее выраженной - B. cereus. Зона подавления роста тест-организмов находится в прямой зависимости от концентрации вырабатываемых антибиотических соединений бактериями рода Bacillus. При применении метода с наложением дисков также были получены диаметры зон подавления роста тест-организмов, были получены аналогичные результаты.
Эффективность совместного использования антибиотиков и пробиотиков на основе бактерий рода Bacillus. В этом случае можно установить явление синергизма (или аддитивность), когда происходит суммация антагонистического действия антибиотиков и пробиотиков, что имеет большую практическую значимость. Также можно зарегистрировать либо негативный эффект (антагонизм), когда антибиотикоподобные вещества, вырабатываемые бактериями, могут блокировать мишени действия антибиотиков, либо отсутствие какого-либо эффекта.
В связи с этим, учитывая результаты определения антибиотикорезистентности бактерий рода Bacillus к антибиотикам, мы провели опыт по изучению эффективности совместного действия антибиотических препаратов и пробиотических штаммов на условно-патогенные микроорганизмы (рис. 2).
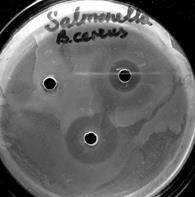
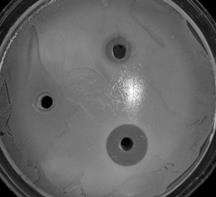
Рис. 2. Метод по совместному применению антибиотика и пробиотика на основе бактерий рода Bacillus: 1 – фильтрат, 2 – антибиотик, 3 – антибиотик + фильтрат
На рис. 2 показан результат совместного применения антибиотика цефиксима (левый рисунок) и B. cereus при подавлении Salmonella enteritidis, пенициллина (правый рисунок) и B. lichenoformis ВКПМ В 7048 при действии на Salmonella enteritidis.
Далее представлена обобщающая табл. 5 по эффективности совместного применения антибиотиков и пробиотиков на основе бактерий рода Bacillus.
Представленные в табл. 5 данные позволяют нам выделить пару антибиотик и пробиотик, которая подавляет тест-организм Salmonella enteritidis in vitro и, следовательно, дальнейшее использование этой пары in vivo при лечении сальмонеллеза.
Таблица 5
Экспериментальная оценка эффективности комплексного применения антибиотиков и пробиотиков на основе бактерий рода Bacillus
|
Штамм |
Salmonella enteritidis |
||
|
Пенициллин |
Цефотаксим |
Хлорамфеникол |
|
|
B. subtillis 534 |
Н |
Н |
А |
|
B. cereus IP 5832 |
А |
Н |
О |
|
B. licheniformis ВКПМ В 7048 |
А |
А |
Н |
|
B. subtillis ВКПМ В 7038 |
Н |
А |
О |
|
Примечание: А – аддитивный эффект, Н – негативный эффект, О – отсутствие эффекта |
|||



