Сальмонеллез – кишечное зооантропонозное заболевание, вызываемое микроорганизмами рода сальмонелл, характеризующееся при манифестном течении отчетливо выраженной интоксикационной и гастроинтестинальной симптоматикой, а также возможностью развития в некоторых случаях генерализованной формы [3].
Восприимчивость к сальмонеллезной инфекции повышается при подавлении нормальной флоры кишечника. Заражающей дозой для иммунокомпетентного человека является доза 107 бактерий. Для развития заболевания у иммунокомпрометированных лиц инфицирующая доза может быть значительно меньшей.
Если интенсивность бактериолиза недостаточна, специфический иммунитет отсутствует, а факторы неспецифической защиты желудочно-кишечного тракта несовершенны, сальмонеллы преодолевают эпителиальный барьер тонкой кишки и проникают в толщу тканей (в энтероциты и собственный слой слизистой оболочки кишечника), где захватываются (фагоцитируются) нейтрофилами и макрофагами. Возникает воспалительный процесс во всех отделах ЖКТ (гастроэнтероколитическая форма) [7].
Для развития манифестных форм болезни обязательно проникновение в ЖКТ не только токсинов сальмонелл, но и живых возбудителей. Массивное поступление живых бактерий (при алиментарном пути заражения) сопровождается разрушением их в верхних отделах ЖКТ (в желудке и преимущественно в кишечнике), в результате чего высвобождается большое количество эндотоксина, который, всасываясь в кровь, обусловливает возникновение эндотоксического синдрома, определяющего клиническую картину начального периода заболевания. Сальмонеллы, попадая с током крови в различные органы и ткани, размножаются с формированием септических очагов поражения (септическая форма) [6].
Токсины сальмонелл вызывают активацию синтеза простагландинов и циклических нуклеотидов, что приводит к резкому усилению секреции жидкости и ионов калия и натрия в просвет желудочно-кишечного тракта. Развивается диарея с последующими нарушениями водно-электронного баланса. Общая реакция организма на эндотоксины характеризуется нарушением функционально-адаптивных процессов во многих органах и системах [4; 5].
В связи со снижением эффективности антибиотиков и химиопрепаратов, а также невысокой эффективностью действия пробиотиков в настоящее время чрезвычайно актуальным является сочетанное применение антибиотических и пробиотических препаратов.
Исходя из выше перечисленного перед нами была поставлена следующая цель исследования: определение эффективности совместного применения пробиотиков на основе бактерий рода Bacillus с антибиотиками при экспериментальной инфекции.
Эксперимент выполнялся с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных. В качестве биологического тест-объекта использовали белых половозрелых крыс массой от 180 до 200 граммов. Длительность эксперимента составила 10 дней. В соответствии с поставленными задачами животные разбивались на 14 групп по 9 животных в каждой группе.
Были сформированы группы лабораторных животных: К0 - обычный рацион; К1 - заражение S. enteritidis; К2 - Ветом 2; К3 - Споробактерин; К4 - Бактисубтил; О1 - заражение + Хлорамфеникол; О2 - заражение + Цефотаксим; О3 - заражение + Пенициллин; О4 - заражение + Ветом 2; О5 - заражение + Споробактерин; О6 - заражение + Бактисубтил; О7 - заражение + Ветом 2 + Цефотаксим; О8 - заражение + Споробактерин + Хлорамфеникол; О9 - заражение + Бактисубтил + пенициллин.
Убой животных проводился в количестве трех голов на каждой точке исследований для определения эффективности применения исследуемых препаратов. В качестве точек исследования были установлены следующие сроки: фоновое исследование перед применением препаратов, на пятый и на десятый день после начала эксперимента. Заражение лабораторных животных проводилось однократно перорально по 0,2 мл смыва суточной агаровой культуры возбудителя сальмонеллеза Salmonella enteritidis, содержащей 1,5 × 106 микробных клеток. Введение пробиотиков и антибиотиков проводилось в соответствии с аннотацией к препарату. Введение препаратов в опытных группах проводилось через 12 часов с момента заражения, утром задавались антибиотики, вечером пробиотики.
От исследуемых лабораторных животных брали кровь на морфологический анализ и определение лизоцимной и β-литической активности; экскременты для выделения бацилл и сальмонелл, органы-мишени (кишечник и селезенка) на гистологическое исследование.
Для определения влияния комплексного применения антибиотиков и пробиотиков на основе бактерий рода Bacillus на течение сальмонеллезной инфекции in vivo нами использовались следующие методы: определение колониеобразующих единиц из фекалий экспериментальных животных Bacillus и S. enteritidis; методы общего морфологического и биохимического анализа крови [2]; гистологический метод исследования органов и тканей лабораторных крыс [1].
Для выделения Bacillus из экскрементов применялась среда МПА. Предварительно исследуемый материал подвергался термической обработке путем кипячения в течение 10 минут при 100 °C. Для выделения Salmonella enteritidis использовалась среда ВСА. Данные представлены в таблицах 1 и 2.
Таблица 1
Результаты подсчета колониеобразующих единиц Bacillus в экскрементах лабораторных животных, КОЕ
|
Исследуемые группы |
Сроки исследования (2-10 день исследования от начала эксперимента) |
||||||||
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
К2 |
30 |
50 |
100 |
170 |
220 |
240 |
260 |
310 |
380 |
|
К3 |
24 |
31 |
67 |
82 |
131 |
157 |
204 |
260 |
301 |
|
К4 |
21 |
42 |
56 |
78 |
64 |
119 |
147 |
181 |
210 |
|
О4 |
31 |
44 |
74 |
107 |
138 |
202 |
240 |
290 |
320 |
|
О5 |
19 |
33 |
51 |
84 |
120 |
165 |
201 |
231 |
270 |
|
О6 |
17 |
34 |
42 |
57 |
91 |
110 |
136 |
181 |
201 |
|
О7 |
22 |
32 |
41 |
87 |
101 |
119 |
131 |
153 |
172 |
|
О8 |
18 |
25 |
39 |
43 |
62 |
94 |
118 |
131 |
141 |
|
О9 |
15 |
29 |
39 |
54 |
74 |
83 |
91 |
102 |
136 |
Из таблицы 1 видно, что наибольшее КОЕ Bacillus отмечалось в контрольных группах, где применялся Ветом 2 и Споробактерин, а также в группе О4, где производилось заражение и задавался Ветом 2.
Таблица 2
Результаты подсчета колониеобразующих единиц Salmonella enteritidis в экскрементах лабораторных животных, КОЕ
|
Исследуемые группы |
Сроки исследования (2-10 день исследования от начала эксперимента) |
||||||||
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
К1 |
31 |
43 |
57 |
87 |
96 |
150 |
212 |
261 |
286 |
|
О1 |
19 |
36 |
41 |
28 |
13 |
0 |
0 |
0 |
0 |
|
О2 |
28 |
37 |
48 |
31 |
22 |
8 |
0 |
0 |
0 |
|
О3 |
26 |
34 |
51 |
42 |
19 |
10 |
0 |
0 |
0 |
|
О4 |
23 |
29 |
49 |
33 |
18 |
7 |
0 |
0 |
0 |
|
О5 |
24 |
37 |
45 |
39 |
26 |
11 |
0 |
0 |
0 |
|
О6 |
22 |
29 |
44 |
51 |
31 |
22 |
9 |
0 |
0 |
|
О7 |
27 |
31 |
37 |
26 |
12 |
0 |
0 |
0 |
0 |
|
О8 |
25 |
33 |
42 |
29 |
23 |
14 |
0 |
0 |
0 |
|
О9 |
24 |
35 |
45 |
37 |
20 |
7 |
0 |
0 |
0 |
Наибольшее КОЕ наблюдается в контрольной группе, где проводилось только заражение. Что касается остальных групп, то КОЕ на 2-й и 3-й день во всех группах оставалось примерно одинаковое, а затем происходил подъем КОЕ в группе О1 (Споробактерин+заражение). К шестому, седьмому, восьмому, девятому дню показатели КОЕ в опытных группах уменьшаются по сравнению с контрольными значениями (К1).
Для гистологического исследования производили отбор образцов тонкого отдела кишечника и селезенки. Обработка гистоматериала, получение и окрашивание гистопрепаратов производили по традиционной методике.
В тонком кишечнике производились следующие замеры: диаметр гемокапилляров крипт и ворсинок, высота ворсинок, диаметр энтероцитов ворсинок, диаметр ядер энтероцитов ворсинок, диаметр крипт, диаметр энтероцитов крипт, диаметр ядер энтероцитов крипт. Полученные данные изменяются достоверно внутри группы относительно фонового значения [1].
В группах О4, О5, О6 патологические изменения в слизистой оболочке минимальны, сосудистая реакция сводится к полнокровию ее сосудов. Подслизистая основа слизистой оболочки инфильтрируется лимфоцитами, скопление которых происходит преимущественно вокруг сосудов. Строение ворсинок и крипт в норме.
В группах О1, О2 местами наблюдались отёк и кровоизлияния, повышенная секреция эпителия крипт, массовое слущивание эпителия, который скапливается в расширениях желез вместе со слизью и лейкоцитами. Местами наблюдается вакуолизация энтероцитов крипт. Ворсинки имеют характерное для нормы строение. В группе О3 изменения в слизистой минимальны. Сосудистая реакция сводится к полнокровию сосудов поверхностных слоёв слизистой оболочки, чаще в области ворсинок. В группе О7 изменения в слизистой минимальны. Признаки патологии отсутствовали. Целостность ворсинок сохранена. Крипты удлинённой формы без признаков отечности. Микрососуды имеют нормальные структуры и степень наполненности. В группе О8, О9 изменения в слизистой минимальны. Признаки патологии отсутствовали, имелся небольшой отёк стромы. Крипты незначительно расширены. Ворсинки имели нормальные размеры.
На пятый день исследования в группе К1 на всем протяжении слизистой оболочки кишечника выражены: гиперемия, кровоизлияния и периваскулярные отеки. Хорошо просматривались лимфоидные образования в подслизистом слое, в которых имеются точечные кровоизлияния и периваскулярные отеки [1].
В группах К2, К3, К4 признаки патологии отсутствовали. Сосудистая реакция сводится к полнокровию сосудов поверхностных слоев слизистой оболочки. Сохраняется целостность ворсинок, в которых хорошо развита соединительнотканная основа и микрососуды.
В опытных группах О4 изменения в слизистой оболочке кишечника минимальны. Сосудистая реакция сводится к полнокровию сосудов (венул) в области основания ворсинок. Сосуды паретически расширены, с тромбами. Ворсинки сохраняют нормальную структуру, численность бокаловидных энтероцитов в эпителии также в пределах нормы.
На финальном этапе исследования в опытных группах О1, О2 на всем протяжении слизистой оболочки выражены: отёки, кровоизлияния, гиперемия, поверхностный некроз и изъязвления слизистой оболочки. Лимфоидные образования слизистой хорошо выражены, полнокровны, имеют набухший вид. В области крипт повышенная секреция, слущивание эпителия.
В группах О7, О8, О9 изменения в слизистой оболочке минимальны. Сосудистая реакция сводится к полнокровию сосудов (венул) поверхностных слоев слизистой оболочки, чаще в области ворсинок. Последние имеют правильную структуру, все виды энтероцитов без признаков патологии. Крипты правильно удлинённой формы, имеют просветы. Признаков отёчности не наблюдается.
В группе К0 изменений не происходило. В группе К1 на всем протяжении слизистой оболочки кишечника отёк, кровоизлияния, гиперемия, поверхностный некроз и изъязвления слизистой оболочки. Лимфоидные образования слизистой хорошо выражены, имеют набухший вид, полнокровные сосуды, имеются точечные кровоизлияния. Ворсинки укороченные, основа их истончена. Регистрировалась массовая вакуолизация эпителия ворсинок и лизис мембран энтероцитов крипт. Наблюдалась слабая базофилия и выраженная вакуолизация энтероцитов крипт. В комплексе ворсинка-крипта нарушена регенерация эпителия.
На всех сроках исследования во всех исследуемых группах изменения в гистологии селезенки не были выявлены (рисунок А, Б). Во всех случаях селезенка полнокровна на всем поле препарата.
 А
А 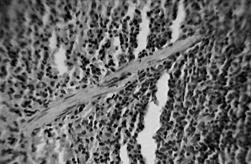 Б
Б
Селезенка (окрашивание гематоксилином):
А – тельце Мальпиги, Б – мышечная трабекула; увеличение в 600 раз
В селезенке проводились замеры (табл. 3): диаметра мальпигиевых телец, отношении красной пульпы к белой, диаметр трабекулы, диаметр эксцентричной артерии, толщина капсулы. Значения изменяются достоверно внутри группы относительно фонового значения.
При экспериментально созданной лабораторной инфекции, в частности сальмонеллезе, патоморфологические изменения в слизистой оболочке кишечника крыс эффективно снимает применение пробиотика биоспорина и его сочетания с антибиотиком цефотаксимом. Менее эффективно снимает применение пробиотика споробактерина и его сочетания с хлорамфениколом. Наименьший эффект оказывает применение пробиотика бактисубтила и его сочетания с пенициллином.
Таблица 3
Толщина капсулы селезенки лабораторных крыс, нанометры
|
Исследуемые группы |
Сроки исследования |
||
|
Фоновое |
Через 5 суток |
Через 10 суток |
|
|
Толщина капсулы |
|||
|
К0 |
28,33±0,621 |
28,36±0,639* |
28,87±1,007*** |
|
К1 |
22,08±1,496 |
20,08±0,964 |
19,50±0,625* |
|
К2 |
21,45±1,739 |
20,70±1,950** |
19,37±0,934 |
|
К3 |
23,25±1,332 |
23,11±1,516 |
24,59±1,964** |
|
К4 |
27,82±1,465 |
27,90±0,822 |
30,25±0,478 |
|
О1 |
27,98±1,463 |
27,68±0,899 |
20,94±0,780* |
|
О2 |
27,10±1,393 |
21,87±1,109** |
23,78±1,569*** |
|
О3 |
25,60±1,164 |
20,89±0,796 |
26,66±1,393* |
|
О4 |
27,54±0,658 |
26,15±1,104* |
18,69±0,457 |
|
О5 |
27,16±1,111 |
26,50±0,832 |
20,08±0,575** |
|
О6 |
25,67±1,678 |
22,70±1,652 |
20,35±0,400* |
|
О7 |
23,15±1,334 |
23,13±1,142* |
20,64±0,615 |
|
О8 |
25,07±1,675 |
27,02±1,865 |
22,32±1,251** |
|
О9 |
27,44±1,783 |
26,78±0,839* |
21,30±0,561** |
|
* Р < 0,050; ** Р < 0,010; *** Р < 0,001. |
|||
В ходе проведенных исследований крови было установлено, что наиболее значимые и достоверные изменения отмечаются со стороны таких морфологических и гематологических показателей, как лимфоциты, моноциты, лейкоциты, эритроциты [2].
На десятый день только в группе К1 регистрировалось превышение физиологических значений уровня лейкоцитов, данный показатель по отношению к фоновому исследованию был выше на 65,56%, а в группах О3, О4, О6, О9 в пределах верхней границы нормы.
СОЭ к десятому дню исследования превышала значения физиологической нормы и фоновые значения в группах К1, О2, О4, О5, О6 на 104,58, 85,77, 45,57, 92,39, 108,23% соответственно. СОЭ в группах О1, О3, О7, О8, О9 снижается и до пределов верхней границы физиологической нормы [2].
Применение пробиотических препаратов способствует активации показателей неспецифической резистентности, таких как лизоцим и β-лизин. Вскоре после приема исследуемых пробиотических препаратов начинают выделяться биологически активные вещества и функционировать системы микробных клеток, оказывающие как прямое действие на патогенные и условно патогенные микроорганизмы, так и опосредованное – путем активации специфических и неспецифических систем защиты макроорганизма [2].
В ходе проведенных исследований на основании подсчета КОЕ S. enteritidis в фекалиях экспериментальных животных установлено, что наиболее эффективным является совместное применения Ветом 2 с Цефотаксимом; на основании исследования морфологических и гематологических показателей крови было установлено, что комплексное применение антибиотиков и пробиотиков при лечении кишечной инфекции, вызванной S. enteritidis, является эффективным, так как во всех опытных группах исследуемые показатели к десятому дню имеют значения в переделах нормы в отличие от контрольной группы заражения; установлено стимулирующее действие исследуемых пробиотических штаммов на β-литическую и лизоцимную активность сыворотки крови; на основании гистологического исследования органов мишеней установлено, что применение пробиотиков при лечении кишечной инфекции, вызванной S. enteritidis, является эффективным, так как предотвращает развитие патологических изменений.



