До настоящего времени в современной хирургии проблема оптимизации регенерации тканей ран различных структур остается весьма актуальной [1, 3, 6]. Результаты, полученные при анализе рядом исследователей, показывают, что до сих пор в хирургии послеоперационные осложнения со стороны ран являются довольно частым явлением [8, 9]. Особенно острой стоит эта проблема в отягощенных условиях для физиологического течения репаративного процесса [10, 11]. Несомненно, проблема заживления ран является своеобразным «тормозом» развития хирургии [5, 7]. Поэтому углубленное изучение причин срыва репаративного процесса может явиться одним из важнейших путей поиска действенных способов индукции регенерации [2, 4, 12].
Цель исследования – в динамике перитонита (в отягощенных условиях) изучить морфологические, метаболические и функциональные характеристики регенерирующих структур тканей тонкой кишки и брюшной стенки.
Материалы и методы исследования. Работа базируется на экспериментальных данных, поскольку ряд исследований состояния тканей области швов сопряжен с биопсией, которую выполнить в клинике у больных не всегда представляется возможным. Использовали каловую модель перитонита. Под тиопентал-натриевым наркозом (0,04 г/кг массы) выполняли введение в брюшную полость животных (17 беспородных взрослых собак) 20 % каловой взвеси из расчета 0,5 мл на 1 кг массы. Через сутки после моделирования выполняли лапаротомию, брюшную полость санировали, резецировали часть тонкой кишки с последующим формированием двухрядного инвертированного анастомоза. Брюшная стенка ушивалась наглухо. В контрольные сроки (1, 3, 5 и 7 суток) производили повторную лапаротомию, в отягощенных перитонитом условиях осуществляли биопсию тканей зоны анастомоза и лапаротомной раны. Интраоперационно и в раннем послеоперационном периоде животным проводилась инфузионная (80 мл на 1 кг) и антибактериальная терапия.
В работе применялись следующие лабораторно-инструментальные методы: определяли уровень токсических продуктов гидрофильной и гидрофобной природы, из биоптатов экстрагировали и фракционировали липиды, оценивали активность фосфолипазы А2, выраженность оксидативных процессов определяли по уровню малонового диальдегида (МДА). Морфологическая оценка проводилась с использованием микроскопии. Изучали показатели микроциркуляции, трофики и электрогенеза тканей кишечного анастомоза и лапаротомной раны. Использовали пневмопрессию для оценки физической герметичности швов анастомоза. В работе применяли статистические методы обработки данных.
Результаты исследования и их обсуждение
Выбранная модель перитонита оказалась вполне адекватной для решения поставленной цели. У животных возникал острый распространенный серозно-фибринозный или гнойно-фибринозный перитонит. При определении уровня токсических продуктов в плазме крови было выявлено прогрессивное увеличение содержания молекул средней массы, на третьи сутки исследования регистрировали повышение данного показателя на 746,3 % (р<0,05) относительно нормы, с пятых суток исследования выявлялась тенденция к снижению уровня среднемолекулярных пептидов в плазме крови. Аналогичная динамика регистрировалась при определении индекса токсичности плазмы крови по альбумину. Данный показатель был выше нормы на 435,3 % (р<0,05) на третьи сутки исследования, когда достигал максимальных значений.
После проведения санационных мероприятий брюшной полости, резекции тонкой кишки и формирования межкишечного соустья в его тканевых структурах возникали выраженные биофизические и биохимические изменения (табл.), что, безусловно, явилось неблагоприятным фоном для течения репаративного процесса. Существенные, но менее значимые патофизиологические явления отмечены и в тканях брюшной стенки области швов лапаротомной раны.
Исследованиями в раннем послеоперационном периоде отмечено, что заживление исследованных тканей протекало замедленно: анастомоза – по типу вторичного натяжения с некрозом тканей внутреннего ряда швов; брюшной стенки – с выраженными воспалительными, а в ряде случаев и гнойными явлениями.
Динамика некоторых биохимических и биофизических показателей состояния регенерирующих тканевых структур кишечного анастомоза
|
Показатель |
Норма |
Санация |
Этапы раннего послеоперационного периода (сутки) |
|||
|
1 |
3 |
5 |
7 |
|||
|
ОВП тканей, мВ |
-37,12 |
-51,8 0,58* |
-66,3 0,78* |
-57,3 0,81* |
-53,1 0,42* |
-49,5 0,89* |
|
Кровенаполнение тканей, мкл/г |
436,5 15,1 |
654,91 7,07* |
899,84 6,89* |
636,07 7,52* |
551,18 4,98* |
510,06 7,03* |
|
МДА в тканях, мкмоль/г |
3,48 |
6,42 0,12* |
8,92 0,17* |
7,56 0,15* |
5,97 0,15* |
4,89 0,14 |
|
Активность фосфолипазы А2 в тканях, мкмоль/c/г белка |
0,91 |
1,38 |
3,12 |
2,89 |
2,11 |
1,74 |
|
Активность каталазы в тканях, мгН2О2/мин/г белка |
0,033 0,002 |
0,044 0,004* |
0,071 0,0008* |
0,058 0,0015* |
0,047 0,0017* |
0,051 0,0049* |
|
Пневмопрессия, кПа |
30,25 |
11,85 0,38* |
15,89 0,26* |
21,26 0,51* |
26,98 0,39* |
|
Примечание: * – достоверность отличия по отношению к норме при p<0,05.
Через сутки после операции зарегистрированы наиболее значимые нарушения трофики тканей по линии швов как области анастомоза, так и брюшной стенки. В первую очередь отметим нарушение процессов, связанных с энергообеспечением. Об этом свидетельствовало снижение окислительно-восстановительного (редокс) потенциала (ОВП) (рис. 1).
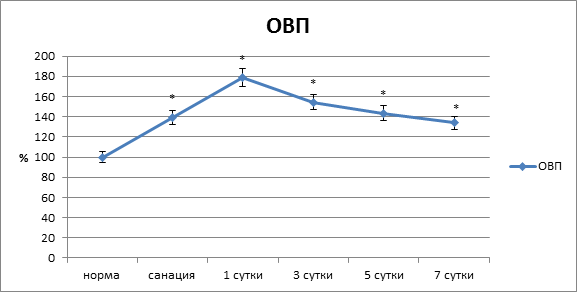
Рис. 1. Окислительно-восстановительный потенциал тканей по линии швов области анастомоза (* – достоверность изменений относительно нормы при р<0,05)
В тканях области соустья он падал на 78,4 % (p<0,05). При этом в регенерирующих структурах отмечено резкое повышение (на 106,1 %) объема крови, что свидетельствовало о выраженности воспалительного процесса. Отметим и резкую интенсификацию процессов перекисного окисления мембранных липидов и повышение фосфолипазной активности. В тканевых структурах анастомоза происходило увеличение содержания МДА на 156,3 % (p<0,05), активность фосфолипазы А2 повышалась на 242,9 % (p<0,05). Показатель пневмопрессии анастомоза – 11,85![]() 0,38 кПа (р<0,05).
0,38 кПа (р<0,05).
Во многом аналогичные явления в этот этап периода наблюдения отмечены и со стороны тканей лапаротомной раны области швов (рис. 2).
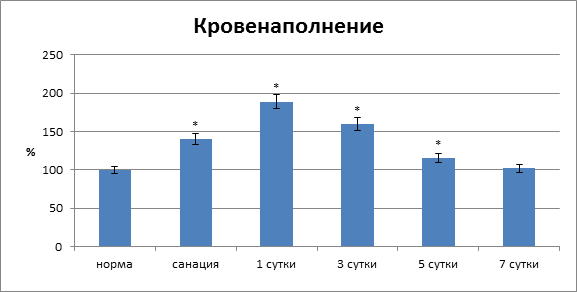
Рис. 2. Кровенаполнение тканей лапаротомной раны по линии швов
(* – достоверность изменений относительно нормы при р<0,05)
Существенные воспалительно-деструктивные явления в тканях по линии швов сохранялись и через трое суток после операции. Окислительно-восстановительный потенциал тканей соустья был ниже нормы на 54,4 % (р<0,01), что свидетельствовало о продолжающихся нарушениях метаболических процессов, связанных с энергообеспечением. Кровенаполнение в области соустья было выше нормы на 45,7 % (р<0,01), что было значительно меньше, чем в предыдущий контрольный этап и в целом могло свидетельствовать о начинающемся регрессе воспалительных явлений. Содержание МДА по линии анастомоза сохранялось повышенным и было выше нормы на 117,2 % (р<0,01), активность фосфолипазы А2 была выше нормы на 2,17,6 % (р<0,01) (рис. 3).
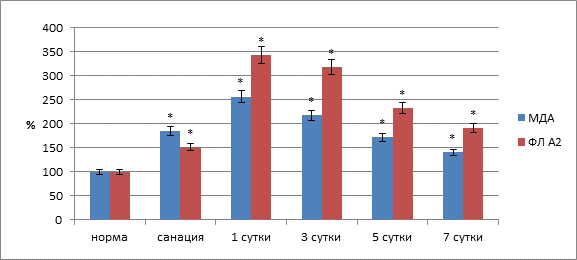
Рис. 3. Содержание малонового диальдегида и активность фосфолипазы А2 в тканях анастамоза по линии швов (* – достоверность изменений относительно нормы при р<0,05)
При пневмопрессии область анастомоза выдерживала давление 15,89![]() 0,26 кПа (р<0,01).
0,26 кПа (р<0,01).
При морфологической оценке в тканях шовного валика сохранялся выраженный воспалительный процесс, одним из проявлений чего была инфильтрация полиморфноядерными лейкоцитами, отмечались дисциркуляторные явления в виде венозного полнокровия и стаза, отека, очаговых и диффузных кровоизлияний.
В следующий этап периода наблюдения (5 суток после операции) зарегистрировано заметное уменьшение изменений биофизических и биохимических показателей тканевых структур анастомоза. Так, редокс-потенциал в области швов приближался к норме и был ниже на 43,1 % (р<0,05). Объем крови в тканях по линии швов был выше нормы только на 26,3 % (р<0,01), что подтверждало тенденцию к уменьшению воспалительного процесса. В тканевых структурах соустья отмечено снижение интенсивности перекисного окисления липидов (ПОЛ) и активности фосфолипазных систем. Содержание МДА в тканях по линии анастомоза было выше нормы на 71,6 % (p<0,05), активность фосфолипазы А2 – на 131,8 % (р<0,05). Нарушение герметичности анастомоза по тесту пневмопрессии происходило при давлении 21,26![]() 0,51 кПа (р<0,05) (рис. 4).
0,51 кПа (р<0,05) (рис. 4).
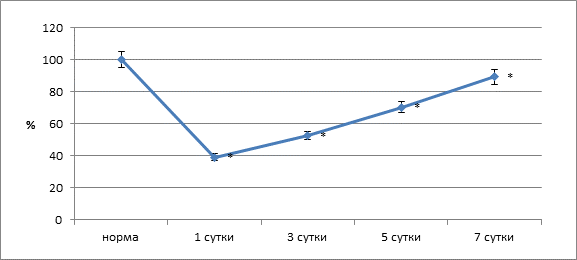
Рис. 4. Данные пневмопрессии в участке анастамоза
(* – достоверность изменений относительно нормы при р<0,05)
Через 7 суток после операции по линии швов процесс неполной репаративной регенерации близился к завершению. По линии швов имелись лишь единичные участки дефектов тканей, выполненных грануляционной тканью. В этот срок исследованные показатели трофики тканей по линии швов в участке анастамоза нормальных значений не достигали. В регенерирующих структурах отмечено стихание интенсивности процессов ПОЛ и активности фосфолипаз, хотя данные показатели оставались выше нормы на 40,5 и 91,2 % (p<0,05). Показатель пневмопрессии анастомоза – 26,9±1,8 кПа.
В этот срок во многом аналогичное состояние отмечено и со стороны тканей лапаротомной раны области швов. Исследованные биофизические и биохимические показатели восстанавливались.
По результатам исследования был проведен корреляционный анализ, который выявил сильную корреляционную связь (r=0,78) между выраженностью лейкоцитарной инфильтрации в тканях анастомоза области шва (по данным морфометрического исследования) и степенью интенсификации процессов оксидативного стресса (по уровню вторичных продуктов перекисного окисления липидов МДА).
Анализируя результаты лабораторно-инструментального исследования, предоставляется возможным сделать следующие выводы:
1. В отягощенных перитонитом условиях течение репаративного процесса тканей лапаротомной раны и межкишечного анастомоза замедляется.
2. Одним из факторов, снижающих темп репаративного процесса, является избыточная активность перекисного окисления липидов и фосфолипаз – мембранодестабилизирующих факторов в условиях воспаления. Это лежало в основе существенного снижения репаративного потенциала регенерирующих структурных в отягощенных условиях.
3. В активизации липопероксидации и фосфолипазных систем немаловажную роль играет значительная лейкоцитарная инфильтрация воспаленных тканей брюшины.



