Обзор литературы, посвященный препарату «Радиесс», широко используемому в эстетической медицине, со всей очевидностью подтверждает эффективность и безопасность этого филлера для контурной пластики лица [1-4; 7; 10]. Ответом на его введение может быть реактивное воспаление по типу «реакция ткани на инородное тело» [5; 11]. Однако получение лифтингового эффекта, увеличение объема экстрацеллюлярного матрикса дермы, достаточно пролонгированный период его действия - все это говорит в пользу целесообразности использования «Радиесса» в медицине [9]. Наблюдаемые в клинике осложнения после введения препарата весьма редки и чаще всего связаны с возможным риском миграции филлера из зоны его введения c последующим развитием гранулем [3; 4]. Считают, что одним из путей устранения осложнений подобного типа может быть разведение филлера анестетиком или физиологическим раствором. Это должно сделать более комфортной саму процедуру введения, а также обеспечить благоприятное течение постинъекционного периода [3]. Вместе с тем мы не встретили в литературе работ, касающихся реакции дермы на введение препарата «Радиесс» в условиях его разведения.
Целью настоящего исследования является морфологическое и гистохимическое изучение ответной реакции цитогенного компонента и экстрацеллюлярного матрикса дермы на эффект разведения препарата «Радиесс».
Материал и методы
Объектом исследования послужили беспородные крысы-самцы весом 200-250 г (25 особей). Эксперимент проводился с разрешения Этического комитета ФГБОУ ВО «КубГМУ» Минздрава России с соблюдением «Правил проведения работ с использованием экспериментальных животных». Животные были разделены на 4 группы. Первой группе вводили препарат «Радиесс» (Merz) в стандартной концентрации. Во второй группе препарат перед введением разбавляли стерильным физиологическим раствором в соотношении 1:2, в третьей группе разведение проведено в соотношении 1:6. Четвертой группе контрольных животных вводили стерильный физиологический раствор в той же дозе. Препарат вводили субдермально по принципу микропапул в обьеме 0,05 мл в заднюю часть шеи (холку) всем экспериментальным животным. Оценку результатов проводили спустя 2 и 4 месяца после инъекции филлера. Для морфологического изучения использовали кусочки кожи с заделкой материала в парафин. Полученные срезы окрашивали гематоксилином и эозином, а также с помощью реакции по Маллори, Ван Гизону и Массону. Для типирования фибриллярных структур дермы использовали окраску пикросириусом красным по Dayan et al. (1989) c последующим изучением микропрепаратов в поляризованном свете. Для избирательного выявления ДНК использовалась реакция Фельгена [10]. Полученные микропрепараты подвергали компьютерной морфометрии с использованием стандартизированных микрофотографий в формате TiF, полученных с цифровой камеры для микроскопии DCM 310. Анализ полученных изображений проводили по компьютерной программе Scion Image фирмы Scion Corporation, сертифицированной в 2000 году National Institute of Heals (USA). Числовые значения результатов измерений выражали в единицах, заданных программой Scion Image. Измерению подвергали диаметры ядер клеток дермы, оптическую плотность ядер, а также определяли объем ядерной массы, характеризующий количество ядерного материала, приходящееся на единицу объема исследуемой ткани. Диаметры ядер использовали для расчета индекса ядерной симметрии [8]. Все цифровые данные подвергали статистической обработке с использованием программы Microsoft Excel.
Полученные результаты и их обсуждение
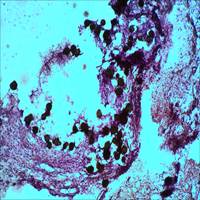
Изучение срезов в окраске стандартными гистологическими методами показало, что спустя 2 месяца после инъекции Радиесса в зоне его введения четко типируются микросферы, расположенные группами и поодиночке. Содержимое их окрашено очень слабо диффузно или не окрашено. Стенки микросфер четко контурируются за счет умеренно или интенсивно окрашенных фибрилл, между которыми удается рассмотреть интенсивно окрашенные уплощенные ядра (рис. 1 А, Б).
 А
А 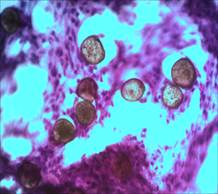 Б
Б
Рис. 1. А. Зона локализации микросфер (окраска гематоксилином и эозином. Об.10х, Ок.10х). Б. Зона локализации микросфер (окраска гематоксилином и эозином. Об.40х, Ок.10х)
Местами встречаются многоядерные клетки инородных тел, по размеру соответствующие микросферам, число ядер в них от 5 до 8. По периферии зоны инъекции типируются в единичные эпителиоидные гигантские клетки. Внутри зоны инъекции видны участки, заполненные круглоклеточным инфильтратом. Зона инъекции имеет четкие границы за счет сформировавшейся вокруг нее соединительнотканной капсулы. При этом одна часть капсулы, обращенная к дерме, представлена большим количеством интенсивно окрашенных коллагеновых волокон, а противоположная поверхность содержит более тонкие волокна и меньшее их число.
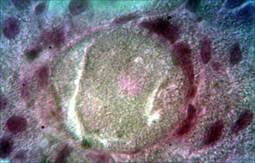
После разведения Радиесса 1:2 в обзорных микропрепаратах отчетливо видно по периферии зоны инъекции филлера большое число кровеносных сосудов, заполненных эритроцитами. Структура ткани, формирующей капсулу, может быть охарактеризована как рыхлая соединительная ткань с небольшим количеством клеточных элементов. Волокна экстрацеллюлярного матрикса тонкие, лежат неупорядоченно, участки аморфного оксифильно окрашенного матрикса вакуолизированы. От места инъекции к зоне локализации гранул можно увидеть небольшое количество плотных оксифильных волокон, они указывают на путь смещения введенного филлера от зоны инъекции к глубоким слоям. Микросферы окружены клетками, распластанными по их поверхности. Содержимое микросфер разрыхлено, местами отсутствует (рис. 2А).
 А
А 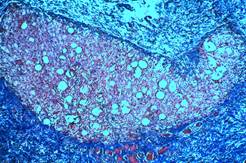 Б
Б
Рис. 2. Зона локализации микросфер (окраска гематоксилином и эозином: А. Об.100х, Ок.10х; Окраска по Массону. Б. Об.10х, Ок.10х)
Вокруг микросфер достаточно много клеток фибробластического ряда, преимущественно с гиперхромными ядрами. В дерме над участком введения Радиесса наблюдается увеличение числа коллагеновых волокон, при этом они широкие и плотно упакованы: и сосочковый и сетчатый слои выглядят одинаково, граница между ними нивелируется.
При изучении зоны инъекции филлера в разведении 1:6 отмечается более глубокое его погружение, это уже не субдермальная граница, а участок на границе с мышечной тканью.
Группы микросфер окружены более плотной соединительнотканной капсулой. Содержимое микросфер отличается рыхлостью, вокруг них сохраняется один ряд уплощенных клеток, формирующих капсулу. Между микросферами скапливается большое количество клеток типа фибробластов и макрофагов, отдельные клетки характеризуются наличием дисперсных ядер. Между микросферами появляются достаточно широкие прослойки рыхлой волокнистой соединительной ткани с большим количеством кровеносных капилляров, заполненных кровью (рис. 2Б).
Таким образом, при разведении филлера происходит погружение его с эффектом увеличения объема фиброзной ткани, формирующей для него капсулу, которая типируется в виде плотных коллагеновых тяжей, идущих от зоны дермы в глубину прилежащих к ней тканей.
Меняется и характер цитогенного компонента, окружающего микросферы. Так, при разведении Радиесса 1:6 появляются клеточные тяжи, а вокруг микросфер скапливается уже не один, а несколько, чаще два-три ряда клеток, где первый – это, вероятно, неактивные фибробласты: уплощенные клетки с гиперхромным ядром, скорее всего (фиброциты), а вокруг них - различного типа мононуклеары.
Не исключено, что выделяемые ими медиаторы инициируют эффект присутствия в зоне инъекции большого количества клеток. При этом число клеток в ряду: Радиесс – Радиесс 1:2 – Радиесс 1:6 нарастает. Во всяком случае увеличение числа клеток в зоне локализации филлера типично для эффекта его разведения.
Спустя 4 месяца после инъекции Радиесса при использовании стандартных гистологических реакций в микропрепаратах видна сохраняющаяся вокруг зоны инъекции капсула, образованная коллагеновыми фибриллами, между ними встречаются кровеносные сосуды, заполненные эритроцитами. Микросферы Радиесса чаще пустые и сохраняют на своей поверхности один слой фиброцитов. Однако между микросферами видны многоядерные клетки. Цитоплазма этих клеток пенистая, в ней выявляются мелкие точки, соответствующие фагоцитированным кристаллам гидроксиапатита. Не исключено, что здесь идет процесс их утилизации.
При разведении препарата Радиесс в соотношении 1:2 отмечается снижение числа микросфер. Содержимое их становится рыхлым, местами микросферы утрачивают фибриллярную оболочку. Однако между микросферами появляются участки, содержащие клетки с округлыми гиперхромными ядрами (лимфоциты). Местами встречаются гигантские многоядерные клетки. Измерение объема ядерной массы в зоне инъекции показало увеличение ее объема, особенно выраженное при разведении 1:6. Увеличение оптической плотности ядер при окраске по Фельгену в ряду: Радиесс без разведения, Радиесс 1:2 и Радиесс 1:6, составил 126,1+1,32; 142,36+6,6 и 151,06+3,0 соответственно, что свидетельствует о нарастании функциональной активности ДНК.
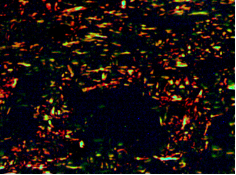
Изучение экстрацеллюлярного матрикса дермы после окрашивания пикросириусом красным в поляризованном свете показало, что спустя 2 месяца после инъекции Радиесса в стандартной концентрации вокруг микросфер визуализируются тонкие фибриллы, обнаруживающие зеленое свечение. Среди них встречаются более короткие широкие фибриллы, обнаруживающие желтое и красное свечение. В процентном соотношении объем этих волокон составил 50, 30 и 20% (рис. 3А).
Вне зоны инъекции участки дермы содержат широкие фибриллы различной длины с красным и оранжево-желтым свечением, зеленое свечение визуализируется в виде небольших коротких штрихов.
 А
А 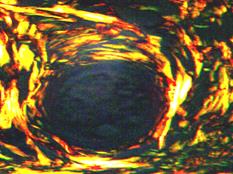 Б
Б
Рис. 3. Зона локализации микросфер. (Окраска пикросириусом красным. Поляризационная микроскопия. Об.40х; Ок.10х А, Б)
При разбавлении препарата 1:2 во всех образцах наблюдается довольно однообразная картина. Вокруг микросфер тонкие фибриллы обнаруживают зеленое свечение, их большинство – до 80%, среди них встречаются в виде штрихов структуры, обнаруживающие желтое свечение – до 20%; структуры, обнаруживающие красное свечение, практически отсутствуют. Вне зоны инъекции участки дермы содержат фибриллы различной длины с красным и оранжево-желтым свечением, зеленое свечение визуализируется в виде коротких штрихов.
В зоне введения препарата Радиесс, разбавленного 1:6, вокруг микросфер преобладают фибриллы с зеленым свечением, их до 60%, остальные фибриллы обнаруживают оранжево-красное свечение. Есть участки, где зеленое свечение практически отсутствует, здесь превалируют фибриллы, обнаруживающие красное свечение, которые имеют вид тонких волокон, окружающих пустые микросферы.
Таким образом, оказалось, что спустя 2 месяца после инъекции разбавленного препарата Радиесс в соотношении 1:2 процесс неоколлагеногенеза сдвигается в сторону синтеза коллагена III типа. С увеличением дозы разведения 1:6 происходит активация неоколлагеногенеза со сдвигом в сторону завершения внеклеточного этапа его синтеза с образованием до 40% общего объема фибриллярного компонента коллагена I типа.
Изучение экстрацеллюлярного матрикса дермы после окраски пикросириусом красным с последующей поляризационной микроскопией показало, что через 4 месяца после инъекции препарата Радиесс микросферы сохраняют тонкую фибриллярную капсулу, обнаруживающую преимущественно красное свечение за счет коллагена I типа, среди которого встречаются единичные «штрихи» фибрилл зеленого цвета – это коллаген III типа.
Спустя 4 месяца после инъекции Радиесса в разведении 1:6 видно, что филлер погружен вглубь ткани за пределами дермы. При поляризационной микроскопии стенка микросфер содержит волокна, обнаруживающие оранжево-красное и зеленое свечения, число этих волокон находится в одинаковом соотношении, что указывает на наличие двух типов коллагенов: I и III. В зоне вне соединительнотканного тяжа превалирует зеленое свечение за счет коллагена III типа (рис. 3Б).
Сравнительное изучение клеток и экстрацеллюлярного матрикса дермы в ответ на введение препарата Радиесс показало, что эффект разведения проявляется: формированием соединительнотканной капсулы и появлением в зоне локализации сохранившихся микросфер значительного количества клеток, формирующих клеточный инфильтрат. Не исключено, что эти изменения являются результатом разведения препарата физраствором с образованием более подвижной массы инъекционного препарата, которая не удерживается в субдермальной зоне, а смещается в более глубокие слои.
Проведенное нами исследование объема ядерной массы показало, что в условиях разведения он действительно нарастает, составляя 27,2+1,3 в контроле и 31+1,6 (p<0,01) и 36,9+1,5 (p<0,001) при разведении 1:2 и 1:6 соответственно. Следует отметить, что при разведении филлера 1:6 преобладают гиперхромные ядра, причем увеличение дозы разведения до 1:6 привело к нарастанию массы гиперхромных ядер почти в 2 раза (рис. 4).
Однако форма ядер цитогенного компонента, являющаяся по современным представлениям прогностическим показателем неопластических изменений, в условиях использованного разведения не менялась, индекс ядерной симметрии составлял в среднем 2,0+0,18 и 1,95+0,13 (р>0,05) (при исходном статусе для Радиесса без разведения 1,83+0,12 р>0,05) [8]. Характерным для этих ядер является нарастание их оптической плотности, выявляемой в препаратах, окрашенных реакцией Фельгена. Это нарастание оптической плотности является результатом высвобождения большого числа альдегидных групп в процессе кислотного гидролиза, что может указывать на повышение функциональной активности ДНК, необходимой клеткам дифферона фибробласта для активации синтеза коллагена.
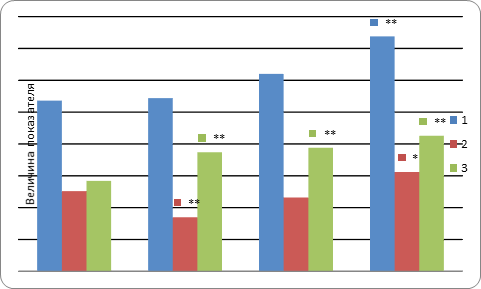
Рис. 4. Характеристика ядер клеточного компонента дермы спустя 4 месяца после введения филлера: 1 - ядерная масса; 2 - гиперхромные ядра; 3 - гипохромные ядра; * - P<0,01; ** - P<0,001
Выводы
Итак, введение разведенного препарата Радиесс приводит к ряду структурных изменений в дерме. При разведении 1:2 и 1:6 в сроки наблюдения, соответствующие 2 и 4 месяцам, происходит активация клеточного компонента дермы и вокруг сохранившихся микросфер появляется оболочка, состоящая из 2-3 клеточных рядов. Процесс неоколлагеногенеза при разведении 1:2 в первые 2 месяца наблюдения сдвигается в сторону синтеза коллагена III типа. С увеличением дозы разведения до 1:6 внеклеточный фибриллогенез завершается образованием коллагена I типа. Пролонгирование периода наблюдения до 4 месяцев подтверждает активацию неоколлагеногенеза I типа. При разведении Радиесса в соотношении 1:6 наблюдается эффект «погружения филлера», а вокруг зоны его введения формируется соединительнотканная капсула.



