В настоящее время во многих лабораториях ведутся интенсивные исследования физиологических и биохимических процессов, которые происходят в организме животных во время зимней спячки. Однако многие вопросы остаются пока неясными. Так, например, неизвестно, какие молекулярные механизмы лежат в основе клеточной пролиферации при гибернации и гипотермии и насколько они отличаются друг от друга. Насколько активно идет синтез ДНК в межбаутном состоянии, способны ли входить клетки гибернирующих животных в митотический цикл и завершить его. Установление общности механизмов регуляции клеточной пролиферации у гомойотермных и гетеротермных животных может иметь большое значение в теоретической и практической медицине. Подтверждением этого может стать детальное изучение премитотического периода, где синтез РНК, а затем и белков продолжается, в частности синтез белка тубулина для микротрубочек веретена деления; центриоли достигают размеров дефинитивных органелл, и накапливается необходимое количество АТФ для последующего митоза [2]. Продолжительность клеточного цикла зависит от вида клетки, возраста животного, нейрогуморального статуса и других факторов. Также в различных тканях отличается и скорость деления клеток, которая зависит не только от длительности каждого периода, но и от прохождения критических точек цикла – точек рестрикции [7]. Кроме того, клеточный цикл контролируется специфическими регуляторами – комплексами циклинов и циклинзависимых киназ [1]. Исследования в области физиологии животных в настоящее время не ограничиваются уровнем целого организма. Методов биохимии, биофизики и тем более морфологии недостаточно для интерпретации явлений и механизмов, а именно, их молекулярных основ, происходящих в животной клетке. Молекулярные методы стали неотъемлемой и составной частью при изучении биологии растений и животных. В основе таких исследований лежит метод ПЦР и его модификация ОТ-ПЦР – метод полимеразной цепной реакции после обратной транскрипции, характеризующийся высокой чувствительностью и позволяющий оценить экспрессию генов на уровне мРНК. Начальным этапом этой трудоемкой методики является подбор праймеров к определенному гену, необходим опыт работы с информационными базами данных, нуклеотидными последовательностями и знание основ методики подбора праймеров[8]. Необходимо иметь две пары праймеров – к целевому и контрольному гену, в качестве которых используются конститутивные гены, экспрессия которых является относительно постоянной вне зависимости от внешних условий, что позволяет оценить изменение экспрессии целевых генов [5,6].
Целью настоящей работы является конструирование праймеров и оптимизация параметров полимеразной цепной реакции для анализа экспрессии уровня мРНК методом ОТ -ПЦР в различных тканях при гипотермии у гомойотермных и гетеротермных животных.
Методы исследования
Поиск последовательностей генов, к которым необходимы были праймеры, проводили в биоинформационной базе данных NСBI [10], который является национальным центром биотехнологической информации, где представлены сведения о структуре генома живых организмов – нуклеотидные и аминокислотные последовательности. Доступ к данному интернет-ресурсу является бесплатным и неограниченным, что является, безусловно, положительным моментом [9]. В данной работе для подбора праймеров и условий проведения ПЦР с ними использовали программу «Oligoanalyse». Условия проведения ПЦР оптимизировали на образцах тканей лабораторных крыс. Выделение ДНК проводили по модифицированной методике, предложенной Dellaportaet.al. [8]. Реакцию проводили с помощью амплификатора Light Cycler.
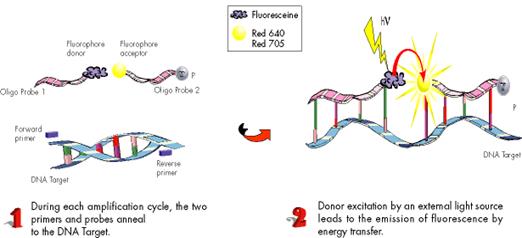
Рис. 1. Принцип Light Cycler
Принцип данной методики заключается в использовании двух проб, меченных флюоресцентной меткой, где с одного флюорофора, на 3Iконце первой пробы переносится энергия ко второму флюорофору, находящегося на 5Iконце второй пробы, если расстояние между флюорофорами не превышает 3 нуклеотидов.
Результаты исследования
Для того чтобы определить где и когда экспрессируются данные гены, используют ОТ-ПЦР, для оценки транскрипции их на уровне мРНК. Как известно, молекулы РНК нестабильны, поэтому работа с РНК сопряжена с риском получения ложноотрицательных результатов. Перед обычной ПЦР проводят на матрице мРНК синтез с помощью ревертазы одноцепочечной молекулы ДНК, которая используется в качестве матрицы для последующей реакции. Чем больше ПЦР продуктов образовалось в результате реакции, тем, следовательно, больше мРНК изучаемого гена находилось в пробе [3,4,11]. Один из ключевых моментов в исследовании – это правильный подбор праймеров – коротких нуклеотидных последовательностей (18-22 п.о.), которые служат затравкой для синтеза копий фрагмента ДНК за счет наличия свободного 3I конца. Праймеров должно быть два – прямой и обратный, комплементарных противоположным концам разных цепей исследуемого нами участка ДНК [5,11]. После денатурации молекулы ДНК, фермент (ДНК-полимераза), используя праймер в качестве затравки, синтезирует дочернюю нить ДНК, присоединяя нуклеотиды к 3Iконцу комплементарно матричной цепи. В данной работе приведена последовательность действий при подборе праймеров для генов, кодирующих белок тубулин у крыс, где кодирование тубулина имеет олигогенный характер. Поэтому подбор осуществляли таким образом, чтобы праймеры подходили к нескольким генам, кодирующим разные цепи данного белка (альфа- и бета-) у представителей крыс. Для начала в базе NCBI – nucleotide находили мРНК целевых генов, на приведенном рисунке – β-6 цепи тубулина крыс (рис. 2). После необходимо определить кодирующие последовательности (рис. 3), и именно их в дальнейшем использовали как матрицы для подбора праймеров.
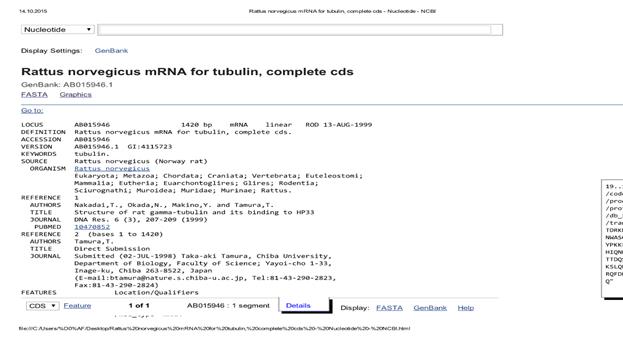
Рис.1. Интерфейс поискового окна

Рис. 2. Кодирующая последовательность целевого гена
В программе «OligoAnalyzer 3.1» создали новую молекулу (File → Createnewsequence → Usingsequenceeditor DNA/RNA) (рис. 4).
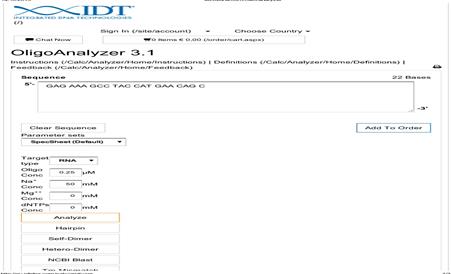
Рис. 3. Конструирование молекулы в программе «OligoAnalyzer 3.1»
После чего была выделена последовательность, для которой необходимо подобрать праймеры и приступить к их моделированию (Primerdesign → Find PCR primers insideselection). В появляющемся диалоговом окне можно задавать необходимые условия – температура отжига (рекомендуется от 56 до 68 ºС), длина праймеров (не длиннее 18–25 нуклеотидов), длина продукта (желательно выбирать в диапазоне от 200 до 600 нуклеотидов), качественное и количественное соотношение нуклеотидов, разница температур плавления (не более 2 ºС) и другие параметры. В этой же программе можно определить температуру отжига, шпильки, гомо- и гетеродимеры, с помощью стандартных настроек, которые при желании можно подкорректировать. Необходимо учесть, что на конце должен находиться аденин или тимин, и нежелательно наличие повторяющихся подряд нуклеотидов – четырех С, G или трех А или Т. Результатом поиска программы будет список предлагаемых продуктов, которые располагаются в порядке уменьшения их рейтинга, который вычисляется автоматически и отражает соответствие заданным параметрам. Нижняя допустимая граница – 140, в случае если рейтинг ниже 140 – категорически нельзя использовать праймер. Самый высокий рейтинг – 171.
Выбор высокорейтинговой позиции не является заключительным этапом. Подходящую пару праймеров необходимо проверить на возможность образования шпилек, димеров (Analyses Thermodynamicproperties-Dimersandloops) и дуплексов (Analyses-Oligoduplexes), где основным критерием отбора является величина энергии Гиббса (dG), при этом эта величина должна быть выше нуля. Проверка и отбор праймеров по этому критерию добавит работу исследователю, но значительно снизит вероятность получения некорректных результатов при проведении ПЦР. Для этого необходимо добавить оба праймера в список олигонуклеотидов, щелкнув правой кнопкой мыши и включив его в список (Addselectiontooligolist).В данной работе, пошагово используя биоинформационный ресурс, была выбрана и синтезирована следующая последовательность праймеров к участку гена, кодирующего белок тубулин у крыс.
|
Tbp |
5'-AGGAGCCAAGAGTGAAGAAC-3' |
5'-CTC TAA CTT TAG CAC CTG TTA-3' |
|
EEF1α1 |
5'-GCT CCA GTC AAT GTA ACA ACT-3' |
5'-GGA TAA TCA CCT GAG CAG TGA-3' |
|
α-tubulin |
5'-GAG AAA GCC TAC CAT GAA CAG C-3' |
5'-ATG CCA ACC TTG AAG CCA GTG-3' |
|
α-tubulin |
5'-CTT TGA GCC AGC CAA CCA GAT-3' |
5'-TGC CAA CCT TGA AGC CAG TG-3' |
На втором этапе проводили тотальное выделение РНК из тканей печени и сердца крысы. Синтезировали кДНК, далее при оптимизированных условиях была проведена ПЦР и проверены конструированные праймеры (рис. 5).
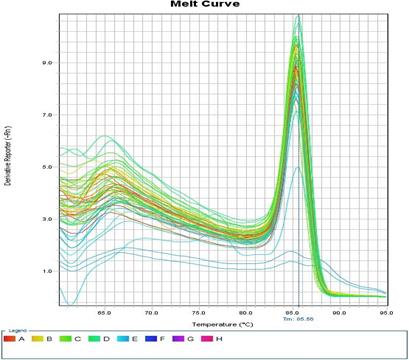
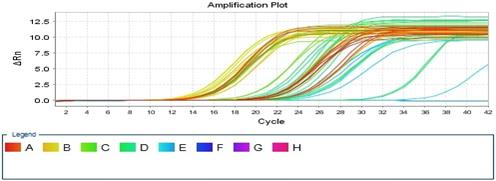
Рис.5
В данной работе приведенная последовательность действий при подборе праймеров не является универсальной или эталонной и основана на личном опыте авторов. Дорожная карта, приведенная в статье, вполне приемлема для успешного подбора праймеров исследователем при проведении молекулярных исследований в отсутствии на биотехнологическом рынке сертифицированных тест-систем и наборов. Однако для оптимизации работы и расширения знаний необходимо изучать биоинформационные программы и интернет-ресурсы, помимо глубокого анализа современных источников литературы.



