В настоящее время во многих лабораториях ведутся интенсивные исследования физиологических и биохимических процессов, которые происходят в организме животных во время зимней спячки. Однако многие вопросы остаются пока неясными. Так, например, неизвестно, какие молекулярные механизмы лежат в основе клеточной пролиферации при гибернации и гипотермии и насколько они отличаются друг от друга. Насколько активно идет синтез ДНК в межбаутном состоянии, способны ли входить клетки гибернирующих животных в митотический цикл и завершить его. Установление общности механизмов регуляции клеточной пролиферации у гомойотермных и гетеротермных животных может иметь большое значение в теоретической и практической медицине. Подтверждением этого может стать детальное изучение премитотического периода, где синтез РНК, а затем и белков продолжается, в частности синтез белка тубулина для микротрубочек веретена деления; центриоли достигают размеров дефинитивных органелл, и накапливается необходимое количество АТФ для последующего митоза [2]. Продолжительность клеточного цикла зависит от вида клетки, возраста животного, нейрогуморального статуса и других факторов. Также в различных тканях отличается и скорость деления клеток, которая зависит не только от длительности каждого периода, но и от прохождения критических точек цикла – точек рестрикции [7]. Кроме того, клеточный цикл контролируется специфическими регуляторами – комплексами циклинов и циклинзависимых киназ [1]. Исследования в области физиологии животных в настоящее время не ограничиваются уровнем целого организма. Методов биохимии, биофизики и тем более морфологии недостаточно для интерпретации явлений и механизмов, а именно, их молекулярных основ, происходящих в животной клетке. Молекулярные методы стали неотъемлемой и составной частью при изучении биологии растений и животных. В основе таких исследований лежит метод ПЦР и его модификация ОТ-ПЦР – метод полимеразной цепной реакции после обратной транскрипции, характеризующийся высокой чувствительностью и позволяющий оценить экспрессию генов на уровне мРНК. Начальным этапом этой трудоемкой методики является подбор праймеров к определенному гену, необходим опыт работы с информационными базами данных, нуклеотидными последовательностями и знание основ методики подбора праймеров[8]. Необходимо иметь две пары праймеров – к целевому и контрольному гену, в качестве которых используются конститутивные гены, экспрессия которых является относительно постоянной вне зависимости от внешних условий, что позволяет оценить изменение экспрессии целевых генов [5,6].
Целью настоящей работы является конструирование праймеров и оптимизация параметров полимеразной цепной реакции для анализа экспрессии уровня мРНК методом ОТ -ПЦР в различных тканях при гипотермии у гомойотермных и гетеротермных животных.
Методы исследования
Поиск последовательностей генов, к которым необходимы были праймеры, проводили в биоинформационной базе данных NСBI [10], который является национальным центром биотехнологической информации, где представлены сведения о структуре генома живых организмов – нуклеотидные и аминокислотные последовательности. Доступ к данному интернет-ресурсу является бесплатным и неограниченным, что является, безусловно, положительным моментом [9]. В данной работе для подбора праймеров и условий проведения ПЦР с ними использовали программу «Oligoanalyse». Условия проведения ПЦР оптимизировали на образцах тканей лабораторных крыс. Выделение ДНК проводили по модифицированной методике, предложенной Dellaportaet.al. [8]. Реакцию проводили с помощью амплификатора Light Cycler.
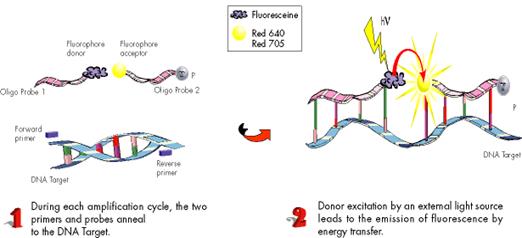
Рис. 1. Принцип Light Cycler
Принцип данной методики заключается в использовании двух проб, меченных флюоресцентной меткой, где с одного флюорофора, на 3Iконце первой пробы переносится энергия ко второму флюорофору, находящегося на 5Iконце второй пробы, если расстояние между флюорофорами не превышает 3 нуклеотидов.
Результаты исследования
Для того чтобы определить где и когда экспрессируются данные гены, используют ОТ-ПЦР, для оценки транскрипции их на уровне мРНК. Как известно, молекулы РНК нестабильны, поэтому работа с РНК сопряжена с риском получения ложноотрицательных результатов. Перед обычной ПЦР проводят на матрице мРНК синтез с помощью ревертазы одноцепочечной молекулы ДНК, которая используется в качестве матрицы для последующей реакции. Чем больше ПЦР продуктов образовалось в результате реакции, тем, следовательно, больше мРНК изучаемого гена находилось в пробе [3,4,11]. Один из ключевых моментов в исследовании – это правильный подбор праймеров – коротких нуклеотидных последовательностей (18-22 п.о.), которые служат затравкой для синтеза копий фрагмента ДНК за счет наличия свободного 3I конца. Праймеров должно быть два – прямой и обратный, комплементарных противоположным концам разных цепей исследуемого нами участка ДНК [5,11]. После денатурации молекулы ДНК, фермент (ДНК-полимераза), используя праймер в качестве затравки, синтезирует дочернюю нить ДНК, присоединяя нуклеотиды к 3Iконцу комплементарно матричной цепи. В данной работе приведена последовательность действий при подборе праймеров для генов, кодирующих белок тубулин у крыс, где кодирование тубулина имеет олигогенный характер. Поэтому подбор осуществляли таким образом, чтобы праймеры подходили к нескольким генам, кодирующим разные цепи данного белка (альфа- и бета-) у представителей крыс. Для начала в базе NCBI – nucleotide находили мРНК целевых генов, на приведенном рисунке – β-6 цепи тубулина крыс (рис. 2). После необходимо определить кодирующие последовательности (рис. 3), и именно их в дальнейшем использовали как матрицы для подбора праймеров.
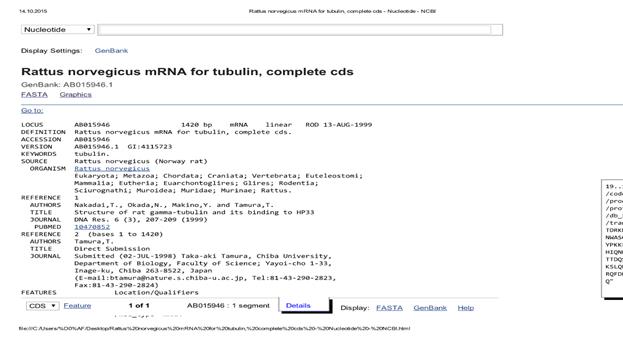
Рис.1. Интерфейс поискового окна

Рис. 2. Кодирующая последовательность целевого гена
В программе «OligoAnalyzer 3.1» создали новую молекулу (File → Createnewsequence → Usingsequenceeditor DNA/RNA) (рис. 4).
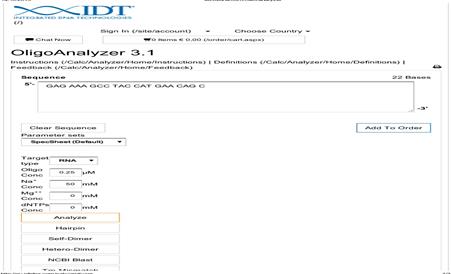
Рис. 3. Конструирование молекулы в программе «OligoAnalyzer 3.1»
После чего была выделена последовательность, для которой необходимо подобрать праймеры и приступить к их моделированию (Primerdesign → Find PCR primers insideselection). В появляющемся диалоговом окне можно задавать необходимые условия – температура отжига (рекомендуется от 56 до 68 ºС), длина праймеров (не длиннее 18–25 нуклеотидов), длина продукта (желательно выбирать в диапазоне от 200 до 600 нуклеотидов), качественное и количественное соотношение нуклеотидов, разница температур плавления (не более 2 ºС) и другие параметры. В этой же программе можно определить температуру отжига, шпильки, гомо- и гетеродимеры, с помощью стандартных настроек, которые при желании можно подкорректировать. Необходимо учесть, что на конце должен находиться аденин или тимин, и нежелательно наличие повторяющихся подряд нуклеотидов – четырех С, G или трех А или Т. Результатом поиска программы будет список предлагаемых продуктов, которые располагаются в порядке уменьшения их рейтинга, который вычисляется автоматически и отражает соответствие заданным параметрам. Нижняя допустимая граница – 140, в случае если рейтинг ниже 140 – категорически нельзя использовать праймер. Самый высокий рейтинг – 171.
Выбор высокорейтинговой позиции не является заключительным этапом. Подходящую пару праймеров необходимо проверить на возможность образования шпилек, димеров (Analyses Thermodynamicproperties-Dimersandloops) и дуплексов (Analyses-Oligoduplexes), где основным критерием отбора является величина энергии Гиббса (dG), при этом эта величина должна быть выше нуля. Проверка и отбор праймеров по этому критерию добавит работу исследователю, но значительно снизит вероятность получения некорректных результатов при проведении ПЦР. Для этого необходимо добавить оба праймера в список олигонуклеотидов, щелкнув правой кнопкой мыши и включив его в список (Addselectiontooligolist).В данной работе, пошагово используя биоинформационный ресурс, была выбрана и синтезирована следующая последовательность праймеров к участку гена, кодирующего белок тубулин у крыс.
|
Tbp |
5'-AGGAGCCAAGAGTGAAGAAC-3' |
5'-CTC TAA CTT TAG CAC CTG TTA-3' |
|
EEF1α1 |
5'-GCT CCA GTC AAT GTA ACA ACT-3' |
5'-GGA TAA TCA CCT GAG CAG TGA-3' |
|
α-tubulin |
5'-GAG AAA GCC TAC CAT GAA CAG C-3' |
5'-ATG CCA ACC TTG AAG CCA GTG-3' |
|
α-tubulin |
5'-CTT TGA GCC AGC CAA CCA GAT-3' |
5'-TGC CAA CCT TGA AGC CAG TG-3' |
На втором этапе проводили тотальное выделение РНК из тканей печени и сердца крысы. Синтезировали кДНК, далее при оптимизированных условиях была проведена ПЦР и проверены конструированные праймеры (рис. 5).
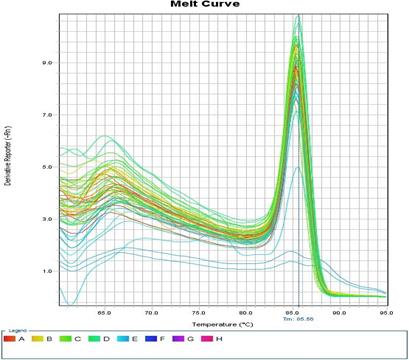
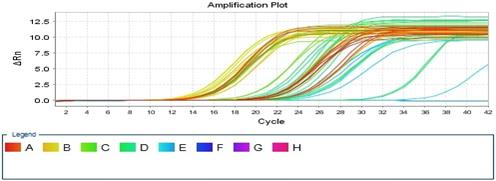
Рис.5
В данной работе приведенная последовательность действий при подборе праймеров не является универсальной или эталонной и основана на личном опыте авторов. Дорожная карта, приведенная в статье, вполне приемлема для успешного подбора праймеров исследователем при проведении молекулярных исследований в отсутствии на биотехнологическом рынке сертифицированных тест-систем и наборов. Однако для оптимизации работы и расширения знаний необходимо изучать биоинформационные программы и интернет-ресурсы, помимо глубокого анализа современных источников литературы.
Библиографическая ссылка
Адиева А.А., Израилова Г.Р., Халилов Р.А., Меджидова М.Г., Умарова Ю.А. ИСПОЛЬЗОВАНИЕ БИОИНФОРМАЦИОННЫХ МЕТОДОВ ПРИ КОНСТРУИРОВАНИИ ПРАЙМЕРОВ КОНСТИТУТИВНОГО ГЕНА, КОДИРУЮЩЕГО БЕЛОК ТУБУЛИН ДЛЯ ПРОВЕДЕНИЯ ОТ-ПЦР // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25687 (дата обращения: 06.02.2026).



