Центральная нервная система млекопитающих обладает очень ограниченной способностью к регенерации. Это является серьезным препятствием для восстановления нормального функционирования мозга после повреждения в результате травм или нейродегенеративных заболеваний. Показано, что нейротрансплантация в поврежденный мозг кусочков фетальной ткани или нейральных клеток-предшественников оказывает позитивное воздействие на его регенеративные способности. Недифференцированные трансплантированные клетки продолжают свое развитие, воспроизводят основные морфологические и физиологические свойства, интегрируются с мозгом реципиента и замещают поврежденные структуры [2, 6, 10]. Ранее мы показали, что воспроизведение органотипических характеристик донорских тканей сохраняется даже при интраокулярной трансплантации [1]. Однако морфологическая и функциональная изоляция трансплантатов от других структур мозга приводит к формированию в них патологической электрофизиологической активности [5]. Аномалии функциональных процессов в трансплантированной ткани могут зависеть от нарушения соотношения возбудительных и тормозных нейронов. Общеизвестно, что основным тормозным медиатором в ЦНС млекопитающих является гамма-аминомасляная кислота (ГАМК). Целью настоящей работы было изучение числовой плотности тормозных ГАМК-ергических нейронов в неокортикальных трансплантатах, а также оценка их соотношения с нейронами другой нейромедиаторной природы.
Материалы и методы исследования
Эксперименты были выполнены на крысах породы Вистар с соблюдением требований к работе с животными (ГОСТ Р ИСО 10993-2-2009). Материалом для трансплантации служили эмбриональные закладки соматосенсорного неокортекса, выделенные из мозга 17-дневных плодов крыс. Для извлечения плодов самке-донору под глубоким нембуталовым наркозом (40 мг/кг) делали кесарево сечение. В качестве реципиентов использовали половозрелых крыс-самцов той же породы (n = 5), которым также делали общий нембуталовый наркоз и дополнительно локальную анестезию новокаином. Трансплантацию производили через отверстие в кости черепа в области первичной соматосенсорной коры и прокол в твердой мозговой оболочке. С помощью туберкулинового шприца со стеклянным наконечником в отверстие вводили кусочек эмбриональной ткани объемом около 1 мм³. Через 6 месяцев после трансплантации животных транскардиально перфузировали фиксирующим раствором (смесь 2.5% параформальдегида и 1% глутаральдегида на 0.1 М фосфатном буфере при pH 7.2). Интрамозговые трансплантаты выделяли из мозга вместе с окружающим неокортексом, который служил в качестве контроля. Затем материал постфиксировали в 1% растворе четырехокиси осмия и заливали в эпоксидную смолу Эпон 812 по общепринятой методике. На ультрамикротоме из каждого эпонового блока через 50 мкм приготавливали пары полутонких срезов толщиной 1 мкм, один из которых окрашивали толуидиновым синим для рутинной гистологии и для подсчета общего числа нейронов, а следующий срез подвергали иммуноцитохимическому окрашиванию на ГАМК. Для количественной оценки плотности и размеров ГАМК-положительных (ГАМК+) и ГАМК-отрицательных (ГАМК-) клеток в трансплантатах и в контрольном неокортексе использовали компьютерную программу UTHSCSA Image Tool. Подсчет и измерение диаметров ядер и перикарионов производили на 10 случайно выбранных участках каждого среза. Числовую плотность клеток в единице объема (1 мм³) вычисляли по формуле, предложенной Вайбел с соавторами для эллипсоидов [9]. Такой стереологический подход для подсчета клеток применялся нами ранее; в настоящей работе использованы некоторые цифровые данные, полученные в предыдущем исследовании [4]. Статистическую значимость различий определяли по t-критерию Стьюдента.
Результаты исследования и их обсуждение
Визуальный и микроскопический анализ через 6месяцев после операции показал, что трансплантаты сохранились у всех оперированных животных. На гистологических срезах было видно, что все трансплантаты увеличили свои размеры; нервные клетки содержали выраженные ядра и дифференцированную цитоплазму. Однако нейроны располагались диффузно, без типичной для неокортекса колончатой организации клеточных элементов (рис.1).
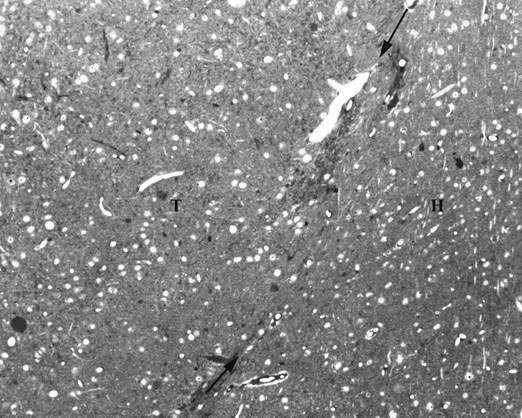
Рис. 1. Полутонкий гистологический срез с эпонового блока через интранеокортикальный трансплантат (Т) и окружающий неокортекс реципиента (Н). Стрелки указывают на границу между трансплантатом и мозгом. Окраска толуидиновым синим
Граница между самим трансплантатом и соседним неокортексом реципиента хорошо идентифицировалась благодаря проникающим в эту зону кровеносным сосудам. Кроме того, окружающая неокортикальная ткань выделялась более упорядоченным расположением нейронов и параллельно расположенным апикальным дендритам, направленным к поверхности мозга. Нарушением органотипической клеточной организации неокортикальные трансплантаты отличались от изученных нами ранее трансплантатов зубчатой извилины гиппокампа, в которых при идентичном типе трансплантации формировался выраженный слой гранулярных нейронов [1, 10].
После проведения иммунохимической реакции на ГАМК в срезах, содержащих нейротрансплантат и окружающий его неокортекс, были выявлены ГАМК-позитивные нейроны. Общая микроскопическая оценка препаратов показала, что ГАМК-ергических нейронов в трансплантатах значительно меньше, чем в интактной неокортикальной ткани. Иммунореактивные нейроны имели овальную, мультиполярную или пирамидоподобную форму. Метка коричневого цвета была гомогенно распределена по всему клеточному телу; ядра выглядели более светлыми. В план среза некоторых нейрональных перикарионов входили позитивно окрашенные нервные отростки. Кроме того, были видны ГАМК(+) фрагменты отростков, перерезанные в разных направлениях, которые выглядели как точечные включения или прерывистые и изогнутые линии. Яркие иммунопозитивные вкрапления также обнаруживались на поверхности ГАМК(-) нервных клеток и их дендритов (рис. 2).
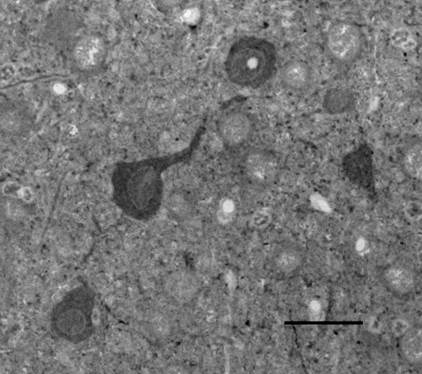
Рис. 2. Группа ГАМК-иммунопозитивных нейронов в неокортикальном трансплантате. Масштаб: 25 мкм.
По-видимому, ГАМК(+) микроструктуры в виде точек могут представлять собой синаптические окончания тормозных интернейронов. Интенсивность реакции в разных ГАМК-ергических нейронах несколько варьировала, что, по-видимому, было следствием их разного биохимического или функционального состояния. Известно, что в процессе развития нейронов, а также при пластических и некоторых патологических состояниях биосинтез ГАМК в нейронах может изменяться за счет активации альтернативных изоформ синтезирующих ферментов [8].
Количественный анализ общей числовой плотности нейронов, проведенный на гистологических препаратах, окрашенных толуидиновым синим, показал, что в кубическом миллиметре трансплантированной ткани содержится нервных клеток достоверно больше, чем в контрольном неокортексе реципиента (75393 ±9127 и 41708±7816, соответственно; различия при p ≤ 0.0001). В то же время количество ГАМК-ергических нейронов, наоборот, в трансплантатах было значительно меньше (959±674 против 5605±1353, p ≤ 0.0001). По-видимому, помимо высоких ростовых потенций эмбриональной ткани, для развития нейрохимического фенотипа нервных клеток требуются и другие факторы, такие как соответствующее микроокружение и адекватная иннервация. Возможное объяснение нарушения дифференцировки ГАМК-позитивных клеток может заключаться и в том, что их предшественники более чувствительны к временной гипоксии во время процедуры трансплантации.
При сравнительном морфометрическом исследовании размеров нейронов и их ядер в неокортикальных трансплантатах и контрольном неокортексе также были прослежены интересные закономерности. Размеры ГАМК-отрицательных клеток анализировали лишь по ядрам, так как в материале, залитом в эпоксидную смолу, определить границы цитоплазмы не представлялось возможным. Измерения диаметров ядер ГАМК-отрицательных клеток не дали различий по этому параметру между двумя типами изученных тканей; их средние значения были практически одинаковыми (8.5±0.7 мкм в трансплантатах и 8.6±0.5 мкм в соседнем неокортексе). Однако ядра ГАМК-позитивных нейронов в трансплантированной ткани достоверно отличались от таковых в ткани реципиента бóльшими размерами. Если в трансплантатах они равнялись 11.9±1.4 мкм, то в контрольных образцах они достигали лишь 9.5±1.5 мкм (p ≤ 0.005). В таком же соотношении были различия и в поперечных размерах тел ГАМК(+) клеток (21.1±1.9 мкм в трансплантатах и 16.7±1.6 мкм в коре реципиента (p ≤ 0.005). По-видимому, увеличение размеров ГАМК-ергических нейронов в условиях трансплантации является некой компенсацией снижения их числа.
Значительное уменьшение числа ГАМК-ергических клеток в интрамозговых нейротрансплантатах, несомненно, отражается на функционировании сформированных в них нейрональных сетей. ГАМК-содержащие клетки в неокортексе являются тормозными интернейронами. По данным литературы в разных отделах мозга грызунов они составляют 10 - 25% от всех нервных клеток, что гарантирует физиологический баланс между возбуждением и торможением [7]. Наши результаты показали, что на долю тормозных нейронов в трансплантатах приходится лишь 1.4%. Снижение тормозных процессов в нейротрансплантатах может сопровождаться гипервозбуждением и развитием патологической эпилептической активности. По-видимому, к снижению числа ГАМК(+) нейронов приводит недостаток нормальных афферентно-эфферентных связей между трансплантатами и мозгом реципиента. Ранее мы показали, что в снижении возбуждающего действия глютаминовой кислоты при формировании синаптических взаимодействий между нейротрансплантатом и мозгом участвуют нейропептидные котрансмиттеры [3].
Заключение
В работе проведено гистологическое и иммунохимическое исследование клеточного состава трансплантатов неокортекса и ткани мозга реципиента, окружающей их. Обнаружено, что в трансплантатах не воспроизводится колончатая архитектоника, свойственная соматосенсорной области коры. Сравнительный количественный анализ показал значительное увеличение общей числовой плотности нейронов и, наоборот, снижение количества тормозных нейронов, содержащих в качестве нейротрансмиттера ГАМК, в трансплантированной ткани. Это, несомненно, может приводить к нарушению тормозных процессов в трансплантированной ткани. Во избежание того, чтобы нейротрансплантат стал источником гипервозбуждения и фокусом эпилептической активности, при использовании трансплантации в медицинской практике необходимо учитывать результаты, полученные в настоящем исследовании.



