В настоящее время одной из важнейших медико-социальных проблем в офтальмологии является патология сетчатки, связанная с неоваскуляризацией, которая приводит к значительному снижению зрения, слепоте и инвалидности. При разработке современных антиангиогенных стратегий терапевтической мишенью на сегодняшний день в основном является эндотелиальный сосудистый фактор роста (Vascular Endothelial Growth Factor - VEGF) [20; 22]. В связи с многофакторностью патогенетического механизма формирования патологического ангиогенеза анти-VEGF терапия, блокирующая биологическое действие VEGF, не всегда бывает эффективной. Результаты исследований последних лет свидетельствуют, что еще одной из возможных терапевтических мишеней при патологии, связанной с формированием неоваскуляризации, могут являться PPARs.
PPARs (Peroxisome Proliferator-Activated Receptors) - ядерные рецепторы, активируемые пероксисомным пролифератором и регулирующие экспрессию генов. Идентифицировано 3 изоформы PPARs: альфа, гамма и дельта (бета) с различным числом аминокислотных остатков, обладающих различными функциями [3]. Экспрессируются PPARs в тканях с высоким уровнем митохондриального окисления жирных кислот - в печени, почках, сердце, скелетных мышцах и сетчатке, присутствуют в моноцитах, макрофагах и эндотелиальных клетках [3; 6; 7; 17]. В сетчатке PPARs интенсивно экспрессируются во всех слоях [12], только в клетках пигментного эпителия выявлены представители всех типов PPARs - PPARа, PPARβ/б1, PPARβ/б2, PPARγ1 и PPARγ2 [9].
При экспрессии в эндотелиальных клетках PPARα, PPARβ/δ и PPARγ регулируют процессы клеточной пролиферации, ангиогенеза, адгезии, агрегации и воспаления. PPARα и PPARγ обладают преимущественно антиангиогенными свойствами (увеличивают экспрессию антиангиогенных и ингибируют экспрессию проангиогенных факторов). PPAR β/δ обладают проангиогенными свойствами, участвуют в процессах клеточной пролиферации, ангиогенеза и воспаления [4].
К PPAR-α-агонистам относятся препараты фармакологической группы фибраты - Фенофибрат, Трайкор и др. с основным механизмом действия гиполипидемическим.
Установлено, что в результате активации PPAR-α с помощью PPAR-α-агонистов блокируется VEGF-индуцированная пролиферация эндотелиальных клеток пупочной вены человека за счет снижения экспрессии VEGFR2 - рецептора VEGF [19].
При активации PPAR-α блокируется VEGF-индуцированная неоваскуляризация роговицы за счет повышения продукции антиангиогенных факторов (тромбоспондин-1, эндостатин) и ингибирования фактора роста фибробластов, обладающих проангиогенными свойствами [23].
При культивировании клеток пигментного эпителия сетчатки с добавлением фенофиброевой кислоты значительно снижается индуцированное нарушение плотности клеточного монослоя и, соответственно, его гиперпроницаемость [26; 27]. Wang S. с соавт. [29] было установлено, что при культивировании клеток пигментного эпителия в условиях высокой концентрации глюкозы и гипоксии снижается экспрессия генов окклюдина и клаудина-1. Однако результаты перечисленных работ свидетельствуют о возможности предотвращения нарушения проницаемости только внешнего гематоретинального барьера.
В исследовании Lu B. с соавт. [18] было установлено, что при использовании фенофибрата в инстилляциях его концентрация и концентрация его активного метаболита - фенофиброевой кислоты, активирующей рецепторы PPARα, была значительно выше, чем при пероральном применении. Авторами было также установлено, что применение фенофибрата в инстилляциях является безопасным и эффективным. Роговица остается прозрачной, слезная пленка сохраняет свои физико-химические свойства, активность апоптоза в клетках сетчатки не отличается от контроля. Установлено, что при инстилляциях фенофибрата в течение 4 недель у крыс со стрептозотоциновым диабетом достоверно ниже уровень лейкостаза в сосудах сетчатки и их проницаемость. В результате проведения клинических исследований было выявлено, что при использовании фенофибрата - агониста экспрессии PPARa течение диабетической ретинопатии носит более благоприятный характер [8; 15].
Определенный интерес на сегодняшний день представляет препарат пиоглитазон из группы тиазолидиндионов (глитазонов) - селективных агонистов ядерных рецепторов PPARγ с гипогликемическим и гиполипидемическим фармакологическим механизмом действия, используется при сахарном диабете 2 типа.
На экспериментальной модели индуцированной хориоидальной неоваскуляризации выявлено, что пиоглитазон, активируя экспрессию PPARγ в сетчатке животных, блокирует проангиогенные эффекты bFGF (фактора роста фибробластов) и предотвращает активное формирование неоваскуляризации [1]. При применении пиоглитазона на модели кислород-индуцированной ретинопатии было выявлено, что уменьшаются площадь неоваскуляризации и площадь облитерированных сосудов сетчатки и увеличивается площадь физиологической васкуляризации [13].
При индуцированном подавлении экспрессии PPARγ в сетчатке, развивающейся у животных с экспериментальным диабетом и кислород-индуцированной ретинопатией, наоборот, нарушается барьерная функция эндотелия и активно начинает формироваться неоваскуляризация [25; 28].
Кроме того, PPARγ обладают нейропротективным действием, предотвращая накопление жирных кислот в сетчатке [10]. При активации PPARγ повышается экспрессия и активируются ферменты антиоксидантной системы - супероксиддисмутазы и глутатионпероксидазы [5]. При диабетической ретинопатии пиоглитазон корригирует дисбаланс между NO и эндотелином [16; 21; 24].
Однако данный препарат пациентам с сахарным диабетом 2 типа рекомендуется назначать с осторожностью в связи с возможностью формирования отечного синдрома. По результатам исследования одних авторов, макулярный отек в группах пациентов с сахарным диабетом 2 типа, использующих тиазолидиндионы в комплексном лечении, развивается в 1,3%, не использующих тиазолидиндионы - в 0,2% случаев [11; 14]. По результатам другого исследования, наличие связи между макулярным отеком у пациентов с сахарным диабетом 2 типа и применением тиазолидиндионов выявлено не было [2].
Полученные результаты позволяют предположить, что данные препараты могут быть реальными претендентами на роль ингибиторов неоангиогенеза в офтальмологии. Для подтверждения этого предположения необходимо провести более детальные, всесторонние исследования.
Цель исследования
На экспериментальной модели кислород-индуцированной ретинопатии провести анализ эффективности применения фенофибратной композиции и пиоглитазона.
Материал и методы исследования
Работа проведена на 60 крысах (120 глаз) линии albino Wistar, выращенных в питомнике лабораторных животных «Столбовая» Российской академии медицинских наук. Исследования проводились в соответствии с Руководством по содержанию и использованию лабораторных животных (National Academy press, 1996).
Экспериментальная модель кислород-индуцированной ретинопатии
С 7-го по 12-й день жизни животные вместе с кормящими матерями находились в условиях гипероксии - в инкубаторе, подключенном к кислородному концентратору Atmung 5L-I с непрерывной подачей 100%-ного кислорода под давлением (насыщенность кислорода в инкубаторе составляла 75±5%). Для предотвращения формирования респираторного дистресс-синдрома у самок производилась их замена; с этой целью для подкорма и проведения очистительных работ инкубатор ежедневно открывался не более чем на 5 минут. В комнатные условия - условия относительной гипоксии (содержание кислорода 21%) - животные переводились на 12-е сутки.
Инстилляции фенофибратной композиции (фенофибрат, натрия лаурилсульфат, гиалуроновая кислота и дрю, рН = 6,7) производили в течение 5 дней (12-17-й день жизни животного), четыре раза в день, в контроле использовали аналогичную композицию без фенофибрата. Режим закапывания был определен в связи с данными, полученными Lu B. с соавт. [18]: максимальная концентрация фенофиброевой кислоты - активного метаболита фенофибрата в сетчатке авторами была зарегистрирована в интервале времени 4-6 часов после закапывания, через 12 часов ее концентрация была минимальной.
Пиоглитазон 0,2 мкл (100 мкмоль/л) растворяли в 0,1%-ном диметилсульфоксиде (ДМСО) и вводили интравитреально на 12-е сутки жизни, в контроле вводили 0,1% ДМСО без пиоглитазона.
Анализ уровня содержания ФНО-α, ICAM-1 и VEGF проводился на 15-е и 18-е постнатальные сутки, уровня содержания мембранных белков плотных контактов и площади ретинальной неоваскуляризации - на 18-е сутки; в каждую из 4 опытных групп - применение фенофибратной композиции, пиоглитазона, комбинированного их применения и ранибизумаба, группу экспериментальных и интактных животных было включено 10 животных, по 5 животных на каждый день исследования (15-е и 18-е сутки).
Для проведения исследования животные были подвергнуты эвтаназии согласно требованиям «Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и научных целей» (Страсбург, 1986). Энуклеация проводилась по стандартному протоколу.
Для определения содержания белков клеточных контактов – окклюдина, клаудина -1, -2 и -5 проводили Вестерн-блот анализ с использованием крысиных антител (Zymed Laboratories, США) к белкам плотных контактов, клаудину-5 (1:5000), окклюдину и клаудину-1 (1:2000) и клаудину-2 (1:1000). Денситометрический анализ Вестерн-блот сигналов проводили с использованием программного обеспечения ImageJ.
Определение уровней содержания ФНО-α, ICAM1 и VEGF и в гомогенатах сетчатки проводилось иммуноферментным методом с использованием наборов Rat TNF-alpha ELISA kit, Rat ICAM1 ELISA kit, Rat VEGF DuoSet ELISA kit, фирмы R&D Systems, Inc., USA, в соответствии с инструкциями изготовителя. Общую концентрацию белка в гомогенатах сетчатки определяли с помощью анализа Брэдфорда.
Методика приготовления и исследования тотальных препаратов сетчатки
После энуклеации глаза препарировали под бинокулярным микроскопом. Извлеченную сетчатку фиксировали в 4%-ном растворе параформальдегида в течение суток при температуре +4 °C. После тщательной промывки в фосфатном буфере сетчатку погружали в раствор биотинилированного изолектина B4 Griffonia simplicifolia (Vector Laboratories, США) в разведении 1:100 в физиологическом растворе с фосфатным буфером (PBS) pH 7,2-7,4 в течение 12 часов при +4 оС. В дальнейшем сетчатку погружали в раствор стрептавидина, конъюгированного с флуоресцентными красителями Cy3 или FITC (Jackson ImmunoResearch, Великобритания) на 1 час при комнатной температуре для визуализации сосудистой сети. После трехкратной промывки в фосфатном буфере сетчатку помещали на предметное стекло, покрывали глицерином и покровным стеклом.
Компьютерный анализ цифровых изображений сосудов сетчатки.
Производили компьютерный анализ изображений сетчатки, полученных с помощью инвертированного микроскопа Olimpus KX-100 с цифровой фотокамерой Olympus DP72 и объективами 10х, 20х, 40х в свете флуоресценции Су3 и FITC. С помощью автоматизированного программного обеспечения SWIFT_NV была проведена количественная оценка средней площади васкуляризации в пределах поверхностного ретинального слоя.
Результаты
В группе экспериментальных животных выявлено достоверное снижение уровня содержания мембранных белков плотных контактов - окклюдина, клаудина -1, -2 и -5, что свидетельствует о нарушении проницаемости гематоретинального барьера. В группах животных с применением фенофибратной композиции и комбинированным ее применением с пиоглитазоном уровень содержания белков плотных контактов был выше (р<0,05), чем в экспериментальной группе; в группе с комбинированным применением препаратов уровень клаудина-5 составлял 89 ± 3,2%, окклюдина - 85 ± 4,3%, клаудина-2 и клаудина-1 - 78 ± 7,2% и 74 ± 6,1% соответственно (рисунок).

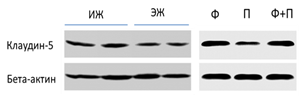
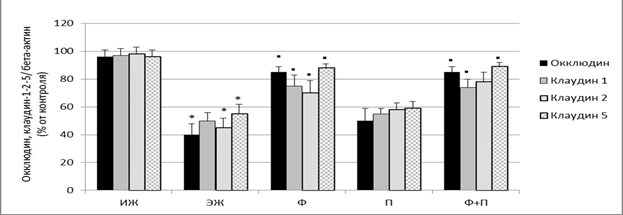
Мембранные белки плотных контактов (окклюдин, клаудин -1-2-5) у животных с кислород-индуцированной ретинопатией при инстилляции фенофибратной композиции и интравитреальном введении пиоглитазона
Примечание: * p<0,05 - достоверность различий в группах ЭЖ и ИЖ
▪ p<0,05 - достоверность различий с группой ЭЖ
Полученные результаты свидетельствуют о том, что применение фенофибрата в используемой композиции позволяет предотвратить резкое нарушение проницаемости гематоретинального барьера.
Уровень содержания ФНО-α на 15-е сутки во всех группах животных с использованием фенофибратной композиции и пиоглитазона был достоверно ниже, чем в группе экспериментальных животных, в группе с комбинированным применением препаратов его уровень был снижен в 2,8 раза и достоверно отличался от групп с изолированным применением. Уровень содержания ФНО-α на 18-е сутки при использовании фенофибратной композиции и комбинированного применения препаратов достоверно не отличался от уровня его содержания в интактной группе и был достоверно ниже, чем в группе с интравитреальным введением пиоглитазона (табл. 1).
Таблица 1
Уровень содержания ФНО-α (пг/мг) у животных с кислород-индуцированной ретинопатией при инстилляциях фенофибратной композиции и интравитреальном введении пиоглитазона
|
Группы животных |
Сутки наблюдения |
|
|
15 |
18 |
|
|
Фенофибрат |
115,4 ± 4,17* |
68,13 ± 1,23* |
|
Пиоглитазон |
145,3 ± 5,21* |
82,23 ± 4,23*† |
|
Фенофибрат + Пиоглитазон |
75,21 ± 6,23*† |
61,12 ± 3,23* |
|
Экспериментальные животные |
207,19 ± 18,32 |
121,31 ± 10,12 |
|
Интактные животные |
54,53 ± 8,08 |
53,02 ± 9,91 |
*p<0,05 - достоверность различий с ЭЖ
†p<0,05 - достоверность различий между группами с применением препаратов
Во всех группах животных с использованием фенофибрата и пиоглитазона на 15-е и 18-е сутки уровень содержания молекулы клеточной адгезии ICAM-1 был достоверно ниже, чем в группе экспериментальных животных, достоверной разницы между группами выявлено не было (табл. 2).
Таблица 2
Уровень содержания ICAM-1 (пг/мг) у животных с кислород-индуцированной ретинопатией при инстилляциях фенофибратной композиции и интравитреальном введении пиоглитазона
|
Группы животных |
Сутки наблюдения |
|
|
15-е |
18-е |
|
|
Фенофибрат |
241,4 ± 7,37* |
215,4 ± 6,37* |
|
Пиоглитазон |
251,1 ± 6,65* |
230,3 ± 9,21* |
|
Фенофибрат + пиоглитазон |
243,5 ± 5,48* |
225,2 ± 7,27* |
|
Экспериментальные животные |
309,2 ± 6,13 |
280,8 ± 5,23 |
|
Интактные животные |
165,1 ± 4,45 |
150,9 ± 4,27 |
*p<0,05 - достоверность различий с ЭЖ
Уровень содержания VEGF на 15-е и 18-е сутки во всех группах был достоверно ниже, чем в группе экспериментальных животных, на 15-е сутки в группе животных с комбинированным применением был ниже, чем при изолированном их применении (р<0,05) и во всех группах достоверно выше, чем в группе сравнения c интравитреальным введением ранибизумаба (табл. 3).
Таблица 3
Уровень содержания VEGF (пг/мг) у животных с кислород-индуцированной ретинопатией при инстилляциях фенофибратной композиции и интравитреальном введении пиоглитазона
|
Группы животных |
Сутки наблюдения |
|
|
15-е |
18-е |
|
|
Фенофибрат |
28,32 ± 0,34 * V |
3,65 ± 0,08* |
|
Пиоглитазон |
25,78 ± 1,23* V |
3,21 ± 0,07* |
|
Фенофибрат + пиоглитазон |
23,31 ± 0,18*† V |
3,12 ± 0,02* |
|
Ранибизумаб |
19,12 ± 0,15* |
2,93 ± 0,05* |
|
Экспериментальные животные |
37,15 ± 16,45 |
5,0 ± 0,04 |
|
Интактные животные |
10,05 ± 1,08 |
2,53 ± 0,09 |
*p<0,05 - достоверность различий с ЭЖ
†p<0,05 - достоверность различий между группами с применением препаратов
?Vp<0,05 - достоверность различий с группой сравнения
Площадь ретинальной неоваскуляризации в группах с изолированным и комбинированным применением фенофибратной композиции и пиоглитазона была достоверно меньше, чем в экспериментальной группе, достоверной разницы между группами выявлено не было (табл. 4).
Таблица 4
Площадь ретинальной неоваскуляризации у животных с кислород-индуцированной ретинопатией при инстилляциях фенофибратной композиции и интравитреальном введении пиоглитазона (18-е сутки)
|
Группы животных |
Площадь ретинальной неоваскуляризации (%) |
|
Фенофибрат |
1,6 ± 0,03* |
|
Пиоглитазон |
1,8 ± 0,03* |
|
Фенофибрат + Пиоглитазон |
1,3 ± 0,02* |
|
Ранибизумаб |
1,7 ± 0,04* |
|
Экспериментальные животные |
4,9 ± 0,21* |
*p<0,05 - достоверность различий с ЭЖ
Между уровнем содержания ФНО-а, VEGF и площадью ретинальной неоваскуляризации при использовании препаратов агонистов PPARа и PPARγ выявлено наличие средней корреляционной зависимости (r = 0,54; р<0,05 и r = 0,61; р<0,05 соответственно), что свидетельствует о наличии у представителей этих групп препаратов других ангиогенных механизмов.
Выводы:
1. При использовании фенофибратной композиции в виде инстилляций у животных с кислород-индуцированной ретинопатией сохраняется более высокий (р<0,05), чем в экспериментальной группе, уровень содержания мембранных белков плотных контактов – окклюдина и клаудина-1, -2 и - 5 в ретинальной ткани, что свидетельствует о предотвращении резкого нарушения проницаемости гематоретинального барьера.
2. При использовании фенофибратной композиции и пиоглитазона у животных с кислород-индуцированной ретинопатией достоверно снижается уровень содержания ФНО-α, наиболее выраженный результат (р<0,05) наблюдается на 15-е сутки при комбинированном их применении.
3. При изолированном и комбинированном применении фенофибрата и пиоглитазона без достоверной разницы у животных с кислород-индуцированной ретинопатией на 15-е сутки снижается (р<0,05) уровень содержания ICAM-1.
4. Уровень содержания VEGF на 15-е и 18-е сутки во всех группах животных с применением фенофибрата и пиоглитазона достоверно ниже, чем в группе экспериментальных животных, наиболее выраженный результат наблюдается в группе животных с комбинированным их применением на 15-е сутки. Во всех группах животных на 15-е сутки уровень содержания VEGF достоверно выше, чем в группе c интравитреальным введением Ранибизумаба.
5. Площадь ретинальной неоваскуляризации в группах с изолированным и комбинированным применением фенофибратной композиции и пиоглитазона достоверно меньше, чем в экспериментальной группе.
6. Между уровнем содержания ФНО-а, VEGF и площадью ретинальной неоваскуляризации при использовании препаратов агонистов PPARа и PPARγ наблюдается наличие средней корреляционной зависимости, что свидетельствует о наличии у представителей этих групп препаратов других ангиогенных механизмов.
Наличие при использовании фенофибрата и пиоглитазона более высокого уровня содержания VEGF, чем при применении ранибизумаба, может иметь определенное положительное значение. При их применении одновременно с анти-VEGF препаратами, количество использования последних может быть ограничено и могут быть предотвращены, соответственно, их возможные неблагоприятные эффекты - апоптоз эндотелиальных клеток и ишемия (используемые на сегодняшний день анти-VEGF препараты не являются селективными).
Полученные результаты свидетельствуют о возможности и эффективности применения агонистов PPARа и PPARγ при патологии, связанной с формированием патологической неоваскуляризации; с целью уточнения механизмов их действия необходимо проведение дальнейших исследований.



