Травма костей скелета и уравнивание длины врожденно укороченной конечности относятся к стресс-факторам чрезвычайной интенсивности.
Половая функция – комплекс процессов, включающий созревание половых клеток, формирование половых мотиваций, половое поведение, половой акт, процессы оплодотворения и последующее воспитание потомства.
Ключевую роль в регуляции половой функции осуществляет нейроэндокринный комплекс «гипоталамус – гипофиз – половые железы». Среди половых гормонов ведущую роль в регуляции мужской половой функции отводят андрогенам [3]. В свою очередь из андрогенов наиболее активен тестостерон.
Одним из стресс-факторов, влияющих на половую функцию мужчин, является травма [13; 14]. Еще Г. Селье отмечал, что стрессоры вызывают, как правило, снижение секреции гонадотропных гормонов и тем самым угнетение функции половых желез. В дальнейшем работы многих исследователей подтвердили данное положение. Экспериментальные исследования показывают, что функционирование половых желез в большей степени зависит от контролирующего влияния соответствующих аденогипофизарных гормонов, чем функционирование коры надпочечников и щитовидной железы.
Причина реципрокных отклонений в уровне гормонов, характеризующих состояние стресса, с одной стороны, ФСГ и ЛГ — с другой, объясняется тем, что центральные регуляторные звенья как гипоталамо-гипофизарно-гонадной, так и симпатоадреналовой систем локализованы в одних и тех же структурах головного мозга и функционально объединены однородностью медиаторного обеспечения [8; 9]. Поэтому при стрессе первичные изменения в симпатоадреналовой системе вызывают изменения нейрогуморальной регуляции репродуктивной функции [10]. Большинство гормонов, нейромедиаторов и биогенных аминов опосредуют ингибирующее действие длительного и кратковременного стресса на половую функцию, действуя на уровне мозга [15]. В частности, адреналин оказывает опосредуемое через гипоталамус тормозящее действие на секрецию гонадотропных гормонов [17].
О наличии стрессовой ситуации при переломах костей нижних конечностей свидетельствует повышенная концентрация АКТГ, кортикостероидов и соматотропина [4]. Подобная ситуация поддерживает возбуждение в лимбической системе, снижает продукцию кортиколиберинов. В результате тормозится деятельность структур гипоталамуса и меньше вырабатывается гонадотропинов [6]. Следствием недостаточной продукции, в частности ЛГ, снижалась деятельность гландулоцитов яичка (клеток Лейдига), продуцирующих тестостерон. Развивался гипогонадотропный синдром (вторичный гипогонадизм), истощались резервные возможности гонад, что было доказано пробой с гонадотропином хорионическим [12].
Угнетение секреции гонадотропных гормонов при стрессе вызывает подавление стероидогенной и сперматогенной функции тестикул.
Избыток пролактина также оказывает ингибирующее влияние на состояние половых желез, нарушая биосинтез андрогенов путем торможения превращения тестостерона в его активную форму – 5α-дигидротестостерон, что приводит к снижению биологической активности андрогенов [16]. Кроме того, пролактин блокирует действие гонадотропинов на половые железы [18]. В некоторых случаях при гиперпролактинемии происходят подавление полового влечения и нарушение эрекции, обусловленное снижением секреции тестостерона.
В период угнетения сперматогенеза продуцируется морфологически измененная сперма. В механизме угнетения активности сперматогенного эпителия андрогенами существенную роль играет подавление секреции гонадотропинов [11].
Представленные данные свидетельствуют о том, что функциональные сдвиги сперматогенеза и секреторной активности добавочных половых желез обусловлены угнетением гипоталамо-гипофизарно-гонадной системы [12].
Материал и методы исследования
Сведения о состоянии копулятивного компонента половой функции собирали по специально составленной анкете. Забор эякулята производился методом виброэякуляции в стаканчик с пробкой через 4–5 дней после предыдущей эякуляции. Объем его измерялся в узком измерительном цилиндре емкостью 10 мл. Индикаторной бумагой определяли pH. Эякулят хранили при температуре 36–37,5оС. Исследования начинали через 30–60 мин после получения эякулята. Подсчет числа сперматозоидов производили в счетных камерах для форменных элементов крови. Использовали обычный микроскоп при увеличении в 125 раз. Подсчет общего числа сперматозоидов и определение процента патологических форм в эякуляте производили по методике А.А. Рубенкова (1959) в модификации М.А. Кунина (1973).
Препараты для суждения о подвижности сперматозоидов просматривали при увеличении в 400 раз. Поле зрения делили на четыре части. Подсчитывали сперматозоиды до числа 100, фиксируя число хорошо подвижных, малоподвижных и неподвижных. Сперматозоиды с очень большими и маленькими головками считали патологически измененными. Скорость движения сперматозоидов определяли по методикам Hynie и Беглашвили [1; 2]. Определение фруктозы, щелочной и кислой фосфатаз проводили по методикам Б.Т. Старковой [7]. Под величиной фруктолиза понимали разницу между первым и вторым определением ее концентрации через несколько часов.
О степени выраженности стресса судили по концентрации гормонов – АКТГ, кортизола, альдостерона, соматотропина, цАМФ, которые определяли в сыворотке крови методом радиоиммунологического анализа и радиоконкурентным методом. Определяли содержание гонадотропинов (ФСГ, ЛГ) и ПЛ, а также половых гормонов.
Результаты исследований. Наличие стрессовых реакций на перелом подтверждалось увеличением концентрации гормонов стресс-группы. Так, на 7-й день концентрация АКТГ увеличивалась в 4,2 раза, кортизола — в 1,3 раза, альдостерона – в 1,9 раза. Через две недели содержание этих гормонов начинало постепенно снижаться, но оставалось выше нормы в течение всего лечения (табл. 1).
Таблица 1
Концентрация гормонов, характеризующих состояние травматического стресса (M±SD)
|
Гормоны |
Норма |
Дни после перелома |
|
|
7-е сутки |
14-е сутки |
||
|
ДОФА (мкг) |
20,2±1,6 |
59,0*±3,81 |
51,2*±2,19 |
|
Дофамин (мкг) |
170±11,8 |
382,2*±10,51 |
341,7*±9,36 |
|
Норадреналин (мкг) |
23,4±1,3 |
46,01*±2,34 |
37,32*±1,75 |
|
Адреналин (мкг) |
5,17±0,22 |
8,75*±0,27 |
8,34*±0,29 |
|
Соматотропин (пг/мл) |
1,54±0,41 |
2,73*±0,21 |
6,73*±0,17 |
|
Пролактин (нг/мл) |
4,98±0,28 |
6,81*±0,48 |
7,02*±0,36 |
|
АКТГ (пг/мл) |
28,3±1,18 |
118,86*±12,3 |
109,32*±3,16 |
|
Кортизол (нг/мл) |
152,8±3,25 |
198,64*±12,8 |
163±1,86 |
|
Альдостерон (пг/мл) |
58,4±2,36 |
110,9*±8,4 |
84,2*±1,17 |
|
цАМФ (пм/мл) |
11,3±1,17 |
31,18*±1,43 |
19,06*±1,53 |
|
цГМФ (пм/мл) |
1,57±0,06 |
3,09*±0,11 |
3,42*±0,47 |
Примечание «*» – величины статистически достоверны (p<0,05).
Травмированная ткань приводит к афферентной импульсации, формирующей очаг стойкого возбуждения в коре головного мозга и поддерживающей высокий уровень стресс-реакции, что неизбежно отражается на половой функции, так как снижается концентрация половых гормонов (рис. 1).
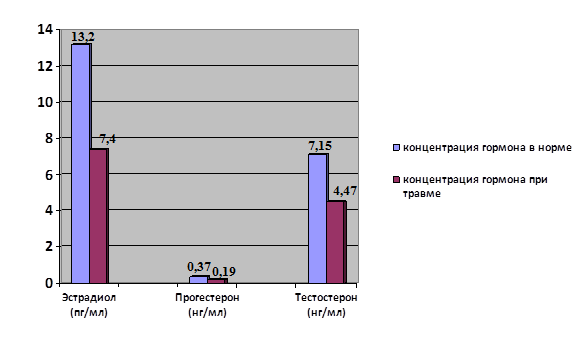
Рис. 1. Концентрация половых гормонов у мужчин при переломе нижних конечностей
У мужчин, поступивших в отдел травмы, наблюдалось снижение концентрации ФСГ и ЛГ (рис. 2). Уменьшение концентрации ФСГ приводило к нарушению сперматогенеза, медленнее происходили дифференцировка и пролиферация клеток Сертоли и ослаблялись поздние стадии сперматогенеза. Снижение содержания ЛГ приводило к уменьшению синтеза тестостерона в клетках Лейдига.
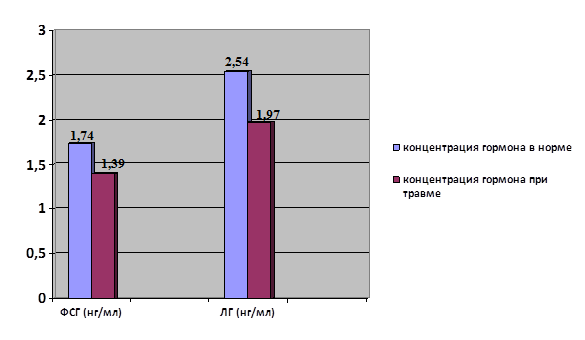
Рис. 2. Концентрация ФСГ и ЛГ у мужчин при переломе нижних конечностей
Функциональное состояние клеток Лейдига, продуцирующих тестостерон, мы определяли по четырем показателям:
-
количество фруктозы, образуемой под влиянием тестостерона в семенных пузырьках, снижение ее количества было признаком нарушения функции клеток Лейдига, так как отсутствовали признаки изменения со стороны семенных пузырьков;
-
величина фруктолиза характеризовала интенсивность обмена веществ в сперматозоидах и их жизнеспособность;
-
фосфатный индекс и концентрация лимонной кислоты уменьшались в период травмы.
Существенные изменения возникали в количестве и качестве сперматогенеза при травме. Изменения сводились к уменьшению общего числа сперматозоидов и их подвижности, а также к незначительному увеличению числа патологических форм. Через 6 ч после получения число активных сперматозоидов уменьшалось до 30–39% (в норме их больше 40%).
Анализ анкет показал, что изменения копулятивного компонента у мужчин сводились к снижению либидо, половой предприимчивости, частоты эякуляций, они наступали преждевременно, что приводило к отсутствию положительных эмоций как в ранние стадии копулятивного цикла (предшествующие половому акту), так и после его осуществления. На фоне сниженной концентрации половых гормонов у лиц, находящихся в условиях длительного стресса, происходило уменьшение МПК. В результате снижения андрогенов в печени меньше синтезируется альбуминов, снижается их уровень в крови и изменяется обмен веществ. Больше выводится азота, калия, кальция, фосфора, креатинина, уменьшается масса тела, что, естественно, отражается на скорости роста регенерата и времени его минерализации. Поэтому следует не только внимательно следить за местом травмы, но и нормализовать половую функцию, чтобы репаративный процесс протекал в самых благоприятных условиях [5].
Для защиты половой функции при травме нижней конечности необходимо применять заместительную терапию гонадотропином хорионическим. При этом не будет наблюдаться ослабления эрекции, ускорения эякуляции и изменения объема эякулята. Количество сперматозоидов, их активность и скорость движения будут близки к норме. Полное восстановление половой функции при травме наблюдается только через 2–3 года после завершения лечения. Немаловажная роль принадлежит психоэмоциональной коррекции, осуществляемой психологом, для повышения психологической адаптации испытуемых к новым условиям существования, обусловленных наличием аппарата на конечности.
Рецензенты:
Свешников А.А., д.м.н., профессор кафедры биологии и географии с методикой преподавания ФГБОУ ВПО «Шадринский государственный педагогический институт», г. Шадринск;
Астапенков Д.С., д.м.н., профессор кафедры травматологии и ортопедии ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения РФ, г. Челябинск.



