Проблема гнойной инфекции и сепсиса актуальна в хирургической практике. По данным разных авторов у больных тяжёлым сепсисом уровень летальности составляет более 30%, а при развитии септического шока – 50% [1,7]. По данным исследования EPIC-II заболеваемость больных инфекционными осложнениями мочевых путей составляет 31,4% от всех клинических форм данного заболевания [8]. За последние десятилетия летальность при грамотрицательном сепсисе возросла в 2 раза в сравнении с грамположительным сепсисом [2].
В настоящее время в лечении сепсиса активно используются сорбционные методики, основанные на селективном удалении основного триггера септического каскада – эндотоксина грамотрицательных микроорганизмов. В 2012 году в Европе были опубликованы результаты исследований по применению селективной адсорбции эндотоксина при тяжелом сепсисе и септическом шоке указывающие на то, что применение данного метода экстракорпоральной детоксикации приводит к уменьшению уровня 28-дневной смертности на 25% в сравнении с больными, получавшими стандартное лечение [3].
Цель исследования
Изучение влияния селективной адсорбции эндотоксина с использованием картриджа TORAYMYXIN-20R на течение септического процесса у онкологических больных, послеоперационный период которых осложнился развитием уросепсиса.
Материал и методы
В исследование вошло 20 онкологических больных, послеоперационный период которых осложнился развитием уросепсиса. Все больные были разделены на 2 группы – основную и контрольную. Основную группу составили 10 человек, комплекс интенсивного лечения которых был дополнен проведением экстракорпоральной гемоперфузией с использованием адсорбера с иммобилизованным полимиксином В. В контрольную группу вошли 10 больных, получавших стандартную терапию сепсиса в соответствие с международными рекомендациями EAU (European Association of Urology) в редакции 2012 года.
Группы больных по полу, возрасту, наличию сопутствующих соматических заболеваний, локализации онкологического процесса, объему и характеру выполненных хирургических вмешательств были однородны, тяжести течения септического процесса были однородны.
Средний возраст больных в группах исследования составил 60,3±7,6 года. У 19 человек (95%) были выявлены клинически значимые сопутствующие заболевания. В обеих группах исследования преобладали больные III стадией онкологического процесса – 15 из 20 человек (75%).
Всем больным были выполнены обширные хирургические вмешательства. В 5 (25%) случаях – цистпростатвезикулэктомия с различными вариантами кишечной пластики, в 4 (20%) – чрезбрюшинная резекция мочевого пузыря с пересадкой одного из мочеточников in situ, в 6 (30%)– нефрадреналэктомия с лимфаденэктомией, в 5 (25%) – радикальная простатэктомия с тазовой лимфаденэктомией. Таким образом, у всех исследуемых больных исходно выявлены факторы высокого риска развития послеоперационных гнойно-воспалительных осложнений: преобладание лиц пожилого возраста, III стадия онкологического процесса; наличие клинически значимых сопутствующих соматических заболеваний; проведение обширных травматичных и длительных по времени хирургических вмешательств.
В целях оценки эффективности селективной адсорбции эндотоксина клинико-лабораторные исследования проводили до начала интенсивного лечения сепсиса (1 этап исследования) и через 24 часа после 2 процедуры (2 этап исследования) у больных основной группы и в сопоставимые сроки в контрольной группе (через 72 часа от начала интенсивного лечения сепсиса).
У всех больных в исходном состоянии был диагностирован комплекс симптомов, характеризующий развитие генерализованного воспаления: более 3 признаков синдрома системного воспалительного ответа (ССВО) при наличии источника инфекции. Стойкую гипертермию 39,1±0,6°С наблюдали у всех 20 больных обеих групп исследования. Лейкоцитоз составлял 18,9х109±6,4х109 при сдвиге лейкоцитарной формулы вплоть до миелоцитов и нейтрофилезе 86,44±3,78%. У всех больных наблюдали тахикардию до 112,67±12,11 уд./мин. У 19 (95%) больных диагностировали развитие тяжелого сепсиса. Степень тяжести критического состояния у исследуемых больных по шкале APACHE II варьировала в диапазоне от 20 до 26 баллов, по шкале SOFA – от 8 до 16 баллов. Во всех случаях наблюдали развитие почечной дисфункции (National Kidney Foundation: K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification and Stratification, 2002).
Распределение больных в группах исследования по стадиям развития острого повреждения почек по шкале RIFLE представлено на рисунке 1.
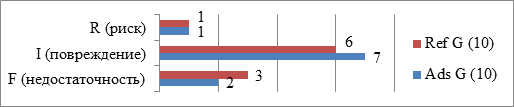
Рис. 1. Распределение больных в основной (Ads G) и контрольной (Ref G) группах исследования по стадиям развития ОПП (RIFLE) (исходный статус)
Развитие ОПП сопровождалось повышением уровня креатинина крови>175 мкмоль/л и/или снижением темпа почасового диуреза<30 мл/час. Одновременно у этих больных отмечали статистически значимое повышение относительно здоровых людей концентрации IL-18 крови, что в настоящее время рассматривают в качестве специфичного маркера развития острого почечного повреждения [4, 5] (таблица 1).
Таблица 1
Показатели почечной дисфункции (M+m) у больных основной и контрольной
групп исследования (исходный статус)
|
Показатель |
Группы исследования |
||
|
Здоровые люди (n=10) |
Основная (n=10) |
Контрольная (n=10) |
|
|
Креатинин крови, мкмоль/л, встречаемость (абс.) |
138±12,1 |
386,9±144,3* (10/10) |
365,7±173,1* (10/10) |
|
Диурез, мл/час, встречаемость (абс.) |
78,4±6,2 |
25,6±6,9* (9/10) |
29,7±7,2* (9/10) |
|
Сроки развития, часы |
- |
14,6±7,3 |
13,1±4,5 |
|
IL-18, пг/мл |
4,7±0,84 |
536,7±88,9* |
502,3±67,5* |
|
Показания к заместительной почечной терапии (абс.) |
- |
(5/10) |
(6/10) |
Примечание: * – P<0,05 в сравнении со здоровыми людьми
Микробиологическое подтверждение сепсиса получено в 17 из 20 (85%) наблюдений (у 8 больных основной и у 9 больных контрольной группы). При этом были идентифицированы как грамотрицательные, так и грамположительные микроорганизмы (рисунок 2).
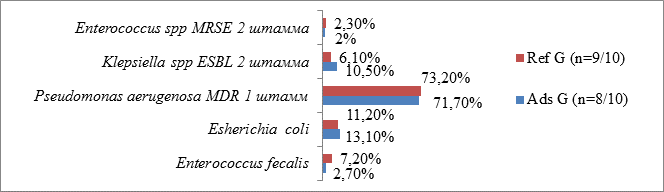
Рис. 2. Данные микробиологического исследования у больных основной (Ads G) и контрольной (Ref G) групп исследования (исходный статус)
Как видно на рисунке 2, грамотрицательная инфекция преимущественно была представлена Pseudomonas aerugenosa. и Escherichia coli. В исходе существенная разница между двумя группами отсутствовала. У 16 больных (80%) диагностировали инфекционный процесс смешанной этиологии.
Анализ исходных результатов ЕАА-теста показал, что активность эндотоксина в исследуемых группах больных составляла 0,75±0,31, что предполагало наличие грамотрицательной этиологии септического процесса.
Полученные результаты и их обсуждение
После включения в комплексе интенсивного лечения уросепсиса у онкологических больных гемоперфузий с полимиксином В получены следующие результаты.
У всех 10 больных основной группы отмечен выраженный регресс признаков ССВО, тогда как у больных контрольной группы аналогичные результаты в сопоставимые сроки исследования были достигнуты только в 4 из 10 случаев (40%).
Анализ динамики основных признаков ССВО у больных исследуемых групп свидетельствует, что в основной группе больных через 24 часа после завершения 2 процедуры селективной адсорбции эндотоксина регистрировали купирование стойкого суточного фебрилитета от 38,7+0,3°С до 37,4+0,4°С, наблюдали регресс степени выраженности лейкоцитоза и нейтрофилеза от 27,5+10,4 до 9,5+2,9 х109/л и от 88,3+3,7 до 75,5+3,1% (р<0,05). У больных контрольной группы в сопоставимые сроки статистически значимых изменений показателей ССВО не наблюдали. В основной группе через 72 часа от начала проведения интенсивного лечения сепсиса ∆ SOFA составляла 5,6+2,1 баллов (от 11,9+2,6 баллов до 6,3+2,4 баллов, p>0,05), тогда как в контрольной эти показатели составили 2,6+2,2 балла (от 12,7+3,2 баллов до 10,0+2,7 баллов, p>0,05). Динамика показателей почечных функций в группах исследования представлена в таблице 2.
Таблица 2
Динамика показателей почечных функций (M+m) у больных основной и контрольной групп
|
Показатель |
Этапы исследования |
Группы исследования |
|
|
Основная (n=10) |
Контрольная (n=10) |
||
|
Креатинин, мкмоль/мл |
1 |
386,9±144,3 |
365,7±171 |
|
2 |
246±21,8* |
476±95,3 |
|
|
Темп диуреза, мл/час |
1 |
25,6±6,9 |
29,7±7,2 |
|
2 |
76,4±5,2* |
29,4±5,7 |
|
|
IL-18, пг/мл |
1 |
536,7±88,9 |
502,3±67,5 |
|
2 |
221,1±67,1* |
324,1±88,7 |
|
|
Показания к заместительной почечной терапии (абс.) |
1
|
(1/10) |
(4/10) |
|
2 |
Примечание: * - p<0,05 в сравнении с исходными показателями
Наряду с ОПП у больных обеих групп регистрировали нарушение: метаболизма (у 19 из 20 больных), гемодинамического профиля (у 15 из 20 больных), развитие печёночной дисфункции (у 5 из 20 больных, нарушение ментального статуса (у 8 из 20 больных).
После завершения 2 процедуры экстракорпорального удаления эндотоксина улучшение показателей метаболического статуса в основной группе регистрировали у 8 из 10 больных (80%) с исходно выявленными нарушениями, тогда как в контрольной группе такие результаты были диагностированы только у 5 из 10 больных (50%). После применения гемоперфузии с полимиксином В у всех 10 больных (100%) отмечена нормализация показателей гемодинамического профиля, тогда как в контрольной группе схожие результаты регистрировали только у 4 из 10 больных (40%). Улучшение ментального статуса диагностировали у 4 (40%) больных основной и 2 (20%) контрольной групп.
В основной группе активность эндотоксина снизилась от 0,61±0,12 до 0,36±0,10 (р<0,05), в контрольной группе значения этого показателя существенных изменений не претерпевали.
Статистическую обработку результатов проводили с использованием программы «Statistica 6.0» с вычислением критерия достоверности Стъюдента (t). Достоверным считалось различие при p<0,05.
Заключение
Таким образом, представленные выше результаты исследования свидетельствуют о положительном влиянии гемоперфузии с полимиксином В на характер течения септического процесса, что способствует регрессу и блокированию патогенетических механизмов прогрессирования системных и органных нарушений. Это согласуется с данными других проведенных нами исследований [9].
Рецензенты:
Николаева Н.В., д.м.н., врач-онколог отделения онкогематологии ФГБУ «РНИОИ», Ростов-на-Дону;
Каймакчи О.Ю., д.б.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.



