Сердечно-сосудистые заболевания являются основной причиной смертности населения в России [5]. Наиболее часто в основе сердечно-сосудистых заболеваний лежит атеротромбоз – процесс патологического тромбообразования, ведущий к инфаркту миокарда и инсульту. Существуют разные методы профилактики и лечения процессов тромбообразования, в том числе создание новых эффективных антиагрегационных препаратов. В образовании тромба значимую роль играют гликопротеиновые рецепторы тромбоцитов. Именно связывание фибриногена с активированными GP IIb/IIIa-рецепторами тромбоцитов является конечным звеном в агрегации последних. Ингибиторы GP IIb/IIIa-рецепторов тромбоцитов являются мощными антитромбоцитарными препаратами [1, 3]. Антагонисты GP IIb/IIIa рецепторов тромбоцитов представлены разными классами химических соединений, среди которых существенный интерес представляют вещества, имеющие пептидную природу [2].
Известно также, что ингибирование процессов тромбообразования происходит под воздействием оксида азота [6, 7]. Инициирование агрегации тромбоцитов приводит к активации фермента – растворимой гуанилатциклазы (рГЦ) и накоплению циклического гуанозинмонофосфата (цГМФ). В свою очередь цГМФ дает сигнал к дезагрегации тромбоцитов. Активаторы фермента рГЦ, в том числе оксид азота, равно как и его доноры, могут явиться ценными лекарственными веществами для ослабления агрегации тромбоцитов, а тем более ее профилактики. Один из классов химических соединений, производные которых являются донорами оксида азота – фуроксаны [5].
Актуальным является создание новых эффективных ингибиторов агрегации тромбоцитов с двумя различными механизмами воздействия на агрегацию тромбоцитов, состоящих из двух фармакофор: пептидной – ингибиторы GP IIb/IIIa-рецепторов тромбоцитов и фуроксановой – доноры оксида азота.
Цель исследования
Разработка новогоантиагрегационного лекарственного средства на основе гетеромерного пептида как в форме лиофилизата для инъекционного введения, так и в виде пролонгированной лекарственной формы – лиофилизата наночастиц биологически активного вещества с полилактидной оболочкой.
Материал и методы исследования
При проведении исследований использовали вспомогательные вещества и реактивы, разрешенные к медицинскому применению и отвечающие требованиям действующих нормативных документов (общих и частных фармакопейных статей ГФ XI, ГФ XII изданий, ГОСТов, ТУ, ФСП).
Для разработки лекарственных форм использовали гетеромерный пептид – Fur-Lys-His-Ala-Asp-Asp(шифр ИБДФ-П-46), где «Fur» –карбоксиметилимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксан [1].
Результаты исследования и их обсуждение
Разработка технологии получения лиофилизата гетеромерного пептида для приготовления раствора для инъекции
Получение лиофилизата гетеромерного пептида. Для разработки технологии получения лекарственной формы выбрали дозу 8 мг. Для подбора оптимального состава лекарственной формы, удовлетворяющей показателям качества, приготовили пять составов по 5 серий в каждой с различным содержанием вспомогательных веществ (ВВ): ПВС(поливиниловый спирт) (15, 20, 30 мг), ПВП(поливинилпирролидон) (15, 20, 30 мг), D-маннитол (15, 20, 30 мг). В результате составы с ПВС имели неудовлетворительные показатели: прозрачность, цветность, растворимость. Для получения стабильной лекарственной формы раствор пептида с ПВП и D-маннитоломлиофилизировали. Для выбора оптимальных условий лиофилизации определяли режимы замораживания и лиофилизации раствора. По окончанию процесса оценивали показатели качества: внешний вид, остаточная влажность, растворимость в растворителе для инъекций, прозрачность 0,1 % раствора, рН, количественное содержание. Для каждого режима использовали 5 серий препаратов по 5 штук в каждой серии.
Подбор режима замораживания. Для исследования влияния режима замораживания варьировали скорость заморозки – быстрое и медленное замораживание. Полученные лиофилизаты гетеромерных пептидов анализировали с помощью ВЭЖХ. Анализ показал, что в составах с ПВП неудовлетворительное содержание пептида (менее 90 %). Лиофилизаты с использованием в качестве криопротектора – D-маннитол, полностью соответствовали всем показателям качества. Концентрация D-маннитола не оказывала влияния на качество лиофилизата, поэтому концентрация 0,015 мг является оптимальной. Режим замораживания не повлиял на качество лиофилизатов, поэтому в целях экономии затрат на электроэнергию использовали быстрое замораживание.
Разработка режима лиофильной сушки. Для исследования влияния режимов лиофилизации раствор гетеромерного пептида лиофилизировали, варьируя изменение температуры полки лиофильной сушилки (таблица 1).
Таблица 1
Сравнение режимов лиофилизации гетеромерного пептида
|
Температура, °C |
Режим лиофилизации гетеромерного пептида и скорость нагрева полки лиофильной сушилки (°C/ч) |
|||
|
№1 |
№2 |
№3 |
№4 |
|
|
–50 |
Выдержка в течение 5 часов и давлении в камере 0,01 мБар |
|||
|
от –50 до –10 |
8 |
4 |
5 |
4 |
|
от –10 до 0 |
4 |
5 |
||
|
от 0 до +20 |
5 |
4 |
3 |
2 |
|
+20 |
Выдержка в течение 4 часов и давлении в камере 0,01 мБар |
|||
В результате показатели качества режимов №1, 2 и 4 соответствовали нормам для инъекционных лекарственных форм. При использовании режима № 3 растворимость в растворителе для инъекций и прозрачность 0,1 % раствора не соответствовали требованиям НТД. В целях экономии электроэнергии режим № 1 был признан наиболее целесообразным.
Технология получения лиофилизированного порошка. Технологическая схема производства (рисунок 1) состоит из следующих этапов: приготовление раствора пептида, стерильная фильтрация раствора, наполнение ампул, лиофилизация, фасовка, упаковка и маркировка готового продукта.
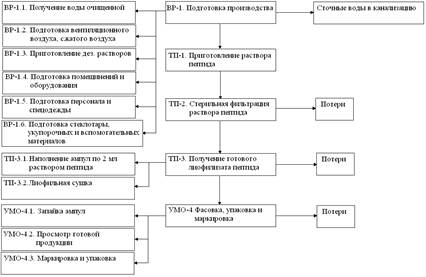
Рис.1. Технологическая схема производства
Таким образом, разработана и оптимизирована технология получения лиофилизата гетеромерного пептида для приготовления раствора для инъекции.
Разработка технологии получения лиофилизата гетеромерного пептида в наночастицах для приготовления суспензии для инъекции
Получение лиофилизата. В качестве пути доставки вещества возможно использование наночастиц. На основании того, что гетеромерный пептид мало растворим в воде, практически нерастворим в хлороформе и дихлорметане, в качестве метода создания наночастиц выбрали метод двойного эмульгирования с диффузией органического растворителя в водную фазу.
Выбор вспомогательных веществ. Для создания наночастиц необходимо вспомогательное вещество, которое должно быть биодеградируемым. Поэтому выбрали сополимер молочной и гликолевой кислот (PLGA). Влияние PLGA 50/50 на включение гетеромерного пептида в наночастицы исследовали в диапазоне соотношения гетеромерный пептид : PLGA 50/50 от 1:0,25 до 1:6. В результате оптимальное соотношение – 1 : 4 (наибольшее включение гетеромерного пептида). Для получения вторичной эмульсии гетеромерного пептида рассматривали: ПВС, МЦ(метилцеллюлоза), ПВП в соотношениях ИБДФ-П-46: ВВ – 1:1, 1:3, 1:5. В результате исследований влияния вспомогательных веществ на устойчивость эмульсии выявили, что эмульсия устойчива при соотношении ПВС – 1 : 3 и 1 : 5. Для создания эмульсии использовали 1 : 3 для экономии реактивов.
Подбор органического растворителя. Исследовали хлороформ, дихлорметан, дихлорэтан по показателям токсичности и температуре кипения. Учитывая низкую токсичность и температуру кипения (хорошая летучесть), выбрали дихлорметан, как наиболее технологичный растворитель.
Дополнительное диспергирование. Для повышения устойчивости суспензии проводили дополнительную гомогенизацию двойной эмульсии с помощью ультразвука (ультразвуковой гомогенизатор BandelinSonopulsHD 3100 c рабочей частотой 20 кГц). Двойные эмульсии анализировали с помощью ВЭЖХ (контрольные точки: 1, 2, 5, 10, 30 мин). Анализ показал, что количественное содержание гетеромерного пептида не изменялось. Дополнительная гомогенизация позволила повысить устойчивость до 30 минут.
Подбор режима лиофилизации. Раствор наночастиц гетеромерного пептида лиофилизировали, используя режимы, в которых варьировали изменение температуры полки лиофильной сушилки во времени (таблица 2). Для каждого режима готовили 5 серий препаратов по 5 штук.
Таблица 2
Сравнение режимов лиофилизации гетеромерного пептида в наночастицах
|
Температура, °C |
Режим лиофилизации гетеромерного пептида в наночастицах и скорость нагрева полки лиофильной сушилки (°C/ч) |
||
|
№1 с быстрым замораживанием |
№2 с быстрым замораживанием |
№3 с медленным замораживанием |
|
|
–50 |
Выдержка в течение 5 часов и давлении в камере 0,01 мБар |
||
|
от –50 до –10 |
5 |
5 |
5 |
|
от –10 до 0 |
4 |
4 |
|
|
от 0 до +20 |
3 |
3 |
|
|
+20 |
Выдержка в течение 4 часов и давлении в камере 0,01 мБар |
||
По окончании процесса лиофилизации оценивали влияние режима заморозки и лиофильной сушки по следующим показателям оценки качества: внешний вид, растворимость в растворителе для инъекций, прозрачность 0,1% раствора, рН, остаточная влажность, размеры частиц, суспендируемость, количественное содержание. В результате проведенных исследований режимы №1, 2 соответствуют нормам показателей качества, однако при лиофилизации режимом № 3 суспензия начинала разрушаться в процессе лиофилизации и не соответствует по показателю качества суспендируемость. В целях экономии затрат на электроэнергию целесообразно использовать режим № 1 для лиофилизации гетеромерного пептида.
Технология получения лиофилизата гетеромерного пептида в наночастицах. Технологическая схема производства (рисунок 2) состоит из следующих этапов: приготовление растворов поливинилового спирта, пептида, полимера PLGA 50/50, D-маннитола, приготовление одинарной эмульсии и двойной эмульсии, дополнительное диспергирование, удаление органического растворителя, фильтрование реакционной смеси и смешивание с D-маннитолом, стерильная фильтрация, наполнение ампул, лиофилизация, фасовка, упаковка и маркировка готового продукта.
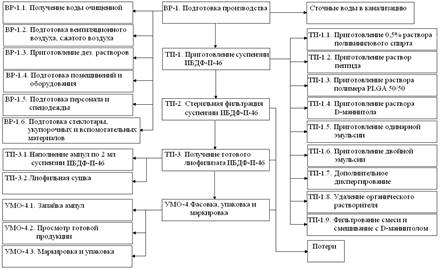
Рис.2. Технологическая схема производства
Таким образом, в результате проведенных исследований разработана и оптимизирована технология получения лиофилизата гетеромерного пептида в наночастицах для приготовления суспензии для инъекции.
Оценка качества готовых лекарственных форм
Готовые лекарственные препараты соответствовали всем показателям качества через 6, 12, 18 и 24 месяца. На основании полученных данных установили срок годности – 2 года. В результате проведенных исследований разработаны предварительные показатели качества (таблица 3).
Таблица 3
Показатели качества лиофилизатов гетеромерного пептида Fur-Lys-His-Ala-Asp-Asp (ИБДФ-П-46) для приготовления растворов для инъекции
|
Показатели |
Полученные данные |
Методы анализа |
||
|
Лиофилизат ИБДФ-П-46
|
Лиофилизат ИБДФ-П-46 в наночастицах |
|||
|
Внешний вид |
Масса белого цвета, высота 22 мм, диаметр 8 мм |
Масса белого цвета, высота 52 мм, диаметр 8 мм |
Визуально метод |
|
|
Растворимость |
Прозрачный раствор |
ОФС 42-0049-07 ГФ XII, часть 1, с. 92 |
||
|
Подлинность |
Хроматограмма соответствует РСО |
ВЭЖХ |
||
|
Однородность дозирования |
0,023 г/амп, ±10% |
0,09 г/амп, ±10% |
ОФС 42-0129-09 ГФ XII, часть 2, стр. 386 |
|
|
Прозрачность 0,1% раствора |
Прозрачный раствор |
ОФС 42-0051-07 ГФ XII, часть 1, стр. 98 |
||
|
Цветность |
Бесцветный раствор |
ОФС 42-0050-07 ГФ XII, часть 1, стр. 93 |
||
|
рН |
6,5 – 7,0 |
ОФС 42-0048-07 ГФ XII, часть 1, стр. 85 |
||
|
Посторонние примеси |
Не обнаружено |
ВЭЖХ |
||
|
Количественное содержание |
0,0079 – 0,0081 г/амп |
ВЭЖХ |
||
|
Размеры частиц (диаметр), нм |
–– |
304,5±4,20 |
Метод динамического светорассеяния |
|
|
Суспендируемость |
–– |
Удовлетворительная, устойчивость в течение 10 мин. |
Визуально |
|
|
Содержание действующего вещества, % |
–– |
10,0±0,1 |
ВЭЖХ |
|
|
Потеря массы при высушивании |
Не более 3% |
ГФ XI, часть 1, стр. 176 |
||
|
Механические включения |
Не обнаружены |
РД 42-501-98 «Инструкция по контролю на механические включения инъекционных лекарственных средств» |
||
|
Стерильность |
Стерилен |
ОФС 42-0066-07 ГФ XII, часть 1, стр. 150 |
||
|
Пирогенность |
Апирогенен |
ОФС 42-0061-07 ГФ XII, часть 1, стр. 125 |
||
|
Бактериальные эндотоксины |
Не содержит |
ОФС 42-0062-07 ГФ XII, часть 1, стр. 128 |
||
|
Хранение |
В сухом защищенном от света месте при температуре -20 °C. |
|||
|
Срок годности |
2 года |
|||
Таким образом, в результате приведенных исследований разработаны предварительные показатели качества. Исследована стабильность и установлены сроки годности готовых лекарственных форм.
Выводы
1. Разработаны технологии получения стабильных при хранении лиофилизированных лекарственных форм: гетеромерный пептид, лиофилизат для приготовления раствора для инъекции 8 мг и гетеромерный пептид в наночастицах, лиофилизат для приготовления эмульсии для инъекции 8 мг.
2. Оптимизирована заморозка и лиофилизация гетеромерного пептида.
3. На серии лиофилизированных лекарственных форм гетеромерного пептида установлено сохранение показателей качества в течение 2 лет.
Рецензенты:
Раменская Г.В., д.фарм.н., профессор, заведующая кафедрой фармацевтической и токсикологической химия ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, г. Москва;
Козин С.В., д.б.н., ведущий научный сотрудник лаборатории биологически активных соединений НИИ фармации ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, г. Москва.



