Сердечно-сосудистые заболевания являются основной причиной смертности населения в России [5]. Наиболее часто в основе сердечно-сосудистых заболеваний лежит атеротромбоз – процесс патологического тромбообразования, ведущий к инфаркту миокарда и инсульту. Существуют разные методы профилактики и лечения процессов тромбообразования, в том числе создание новых эффективных антиагрегационных препаратов. В образовании тромба значимую роль играют гликопротеиновые рецепторы тромбоцитов. Именно связывание фибриногена с активированными GP IIb/IIIa-рецепторами тромбоцитов является конечным звеном в агрегации последних. Ингибиторы GP IIb/IIIa-рецепторов тромбоцитов являются мощными антитромбоцитарными препаратами [1, 3]. Антагонисты GP IIb/IIIa рецепторов тромбоцитов представлены разными классами химических соединений, среди которых существенный интерес представляют вещества, имеющие пептидную природу [2].
Известно также, что ингибирование процессов тромбообразования происходит под воздействием оксида азота [6, 7]. Инициирование агрегации тромбоцитов приводит к активации фермента – растворимой гуанилатциклазы (рГЦ) и накоплению циклического гуанозинмонофосфата (цГМФ). В свою очередь цГМФ дает сигнал к дезагрегации тромбоцитов. Активаторы фермента рГЦ, в том числе оксид азота, равно как и его доноры, могут явиться ценными лекарственными веществами для ослабления агрегации тромбоцитов, а тем более ее профилактики. Один из классов химических соединений, производные которых являются донорами оксида азота – фуроксаны [5].
Актуальным является создание новых эффективных ингибиторов агрегации тромбоцитов с двумя различными механизмами воздействия на агрегацию тромбоцитов, состоящих из двух фармакофор: пептидной – ингибиторы GP IIb/IIIa-рецепторов тромбоцитов и фуроксановой – доноры оксида азота.
Цель исследования
Разработка новогоантиагрегационного лекарственного средства на основе гетеромерного пептида как в форме лиофилизата для инъекционного введения, так и в виде пролонгированной лекарственной формы – лиофилизата наночастиц биологически активного вещества с полилактидной оболочкой.
Материал и методы исследования
При проведении исследований использовали вспомогательные вещества и реактивы, разрешенные к медицинскому применению и отвечающие требованиям действующих нормативных документов (общих и частных фармакопейных статей ГФ XI, ГФ XII изданий, ГОСТов, ТУ, ФСП).
Для разработки лекарственных форм использовали гетеромерный пептид – Fur-Lys-His-Ala-Asp-Asp(шифр ИБДФ-П-46), где «Fur» –карбоксиметилимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксан [1].
Результаты исследования и их обсуждение
Разработка технологии получения лиофилизата гетеромерного пептида для приготовления раствора для инъекции
Получение лиофилизата гетеромерного пептида. Для разработки технологии получения лекарственной формы выбрали дозу 8 мг. Для подбора оптимального состава лекарственной формы, удовлетворяющей показателям качества, приготовили пять составов по 5 серий в каждой с различным содержанием вспомогательных веществ (ВВ): ПВС(поливиниловый спирт) (15, 20, 30 мг), ПВП(поливинилпирролидон) (15, 20, 30 мг), D-маннитол (15, 20, 30 мг). В результате составы с ПВС имели неудовлетворительные показатели: прозрачность, цветность, растворимость. Для получения стабильной лекарственной формы раствор пептида с ПВП и D-маннитоломлиофилизировали. Для выбора оптимальных условий лиофилизации определяли режимы замораживания и лиофилизации раствора. По окончанию процесса оценивали показатели качества: внешний вид, остаточная влажность, растворимость в растворителе для инъекций, прозрачность 0,1 % раствора, рН, количественное содержание. Для каждого режима использовали 5 серий препаратов по 5 штук в каждой серии.
Подбор режима замораживания. Для исследования влияния режима замораживания варьировали скорость заморозки – быстрое и медленное замораживание. Полученные лиофилизаты гетеромерных пептидов анализировали с помощью ВЭЖХ. Анализ показал, что в составах с ПВП неудовлетворительное содержание пептида (менее 90 %). Лиофилизаты с использованием в качестве криопротектора – D-маннитол, полностью соответствовали всем показателям качества. Концентрация D-маннитола не оказывала влияния на качество лиофилизата, поэтому концентрация 0,015 мг является оптимальной. Режим замораживания не повлиял на качество лиофилизатов, поэтому в целях экономии затрат на электроэнергию использовали быстрое замораживание.
Разработка режима лиофильной сушки. Для исследования влияния режимов лиофилизации раствор гетеромерного пептида лиофилизировали, варьируя изменение температуры полки лиофильной сушилки (таблица 1).
Таблица 1
Сравнение режимов лиофилизации гетеромерного пептида
|
Температура, °C |
Режим лиофилизации гетеромерного пептида и скорость нагрева полки лиофильной сушилки (°C/ч) |
|||
|
№1 |
№2 |
№3 |
№4 |
|
|
–50 |
Выдержка в течение 5 часов и давлении в камере 0,01 мБар |
|||
|
от –50 до –10 |
8 |
4 |
5 |
4 |
|
от –10 до 0 |
4 |
5 |
||
|
от 0 до +20 |
5 |
4 |
3 |
2 |
|
+20 |
Выдержка в течение 4 часов и давлении в камере 0,01 мБар |
|||
В результате показатели качества режимов №1, 2 и 4 соответствовали нормам для инъекционных лекарственных форм. При использовании режима № 3 растворимость в растворителе для инъекций и прозрачность 0,1 % раствора не соответствовали требованиям НТД. В целях экономии электроэнергии режим № 1 был признан наиболее целесообразным.
Технология получения лиофилизированного порошка. Технологическая схема производства (рисунок 1) состоит из следующих этапов: приготовление раствора пептида, стерильная фильтрация раствора, наполнение ампул, лиофилизация, фасовка, упаковка и маркировка готового продукта.
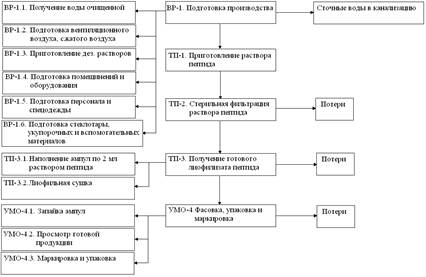
Рис.1. Технологическая схема производства
Таким образом, разработана и оптимизирована технология получения лиофилизата гетеромерного пептида для приготовления раствора для инъекции.
Разработка технологии получения лиофилизата гетеромерного пептида в наночастицах для приготовления суспензии для инъекции
Получение лиофилизата. В качестве пути доставки вещества возможно использование наночастиц. На основании того, что гетеромерный пептид мало растворим в воде, практически нерастворим в хлороформе и дихлорметане, в качестве метода создания наночастиц выбрали метод двойного эмульгирования с диффузией органического растворителя в водную фазу.
Выбор вспомогательных веществ. Для создания наночастиц необходимо вспомогательное вещество, которое должно быть биодеградируемым. Поэтому выбрали сополимер молочной и гликолевой кислот (PLGA). Влияние PLGA 50/50 на включение гетеромерного пептида в наночастицы исследовали в диапазоне соотношения гетеромерный пептид : PLGA 50/50 от 1:0,25 до 1:6. В результате оптимальное соотношение – 1 : 4 (наибольшее включение гетеромерного пептида). Для получения вторичной эмульсии гетеромерного пептида рассматривали: ПВС, МЦ(метилцеллюлоза), ПВП в соотношениях ИБДФ-П-46: ВВ – 1:1, 1:3, 1:5. В результате исследований влияния вспомогательных веществ на устойчивость эмульсии выявили, что эмульсия устойчива при соотношении ПВС – 1 : 3 и 1 : 5. Для создания эмульсии использовали 1 : 3 для экономии реактивов.
Подбор органического растворителя. Исследовали хлороформ, дихлорметан, дихлорэтан по показателям токсичности и температуре кипения. Учитывая низкую токсичность и температуру кипения (хорошая летучесть), выбрали дихлорметан, как наиболее технологичный растворитель.
Дополнительное диспергирование. Для повышения устойчивости суспензии проводили дополнительную гомогенизацию двойной эмульсии с помощью ультразвука (ультразвуковой гомогенизатор BandelinSonopulsHD 3100 c рабочей частотой 20 кГц). Двойные эмульсии анализировали с помощью ВЭЖХ (контрольные точки: 1, 2, 5, 10, 30 мин). Анализ показал, что количественное содержание гетеромерного пептида не изменялось. Дополнительная гомогенизация позволила повысить устойчивость до 30 минут.
Подбор режима лиофилизации. Раствор наночастиц гетеромерного пептида лиофилизировали, используя режимы, в которых варьировали изменение температуры полки лиофильной сушилки во времени (таблица 2). Для каждого режима готовили 5 серий препаратов по 5 штук.
Таблица 2
Сравнение режимов лиофилизации гетеромерного пептида в наночастицах
|
Температура, °C |
Режим лиофилизации гетеромерного пептида в наночастицах и скорость нагрева полки лиофильной сушилки (°C/ч) |
||
|
№1 с быстрым замораживанием |
№2 с быстрым замораживанием |
№3 с медленным замораживанием |
|
|
–50 |
Выдержка в течение 5 часов и давлении в камере 0,01 мБар |
||
|
от –50 до –10 |
5 |
5 |
5 |
|
от –10 до 0 |
4 |
4 |
|
|
от 0 до +20 |
3 |
3 |
|
|
+20 |
Выдержка в течение 4 часов и давлении в камере 0,01 мБар |
||
По окончании процесса лиофилизации оценивали влияние режима заморозки и лиофильной сушки по следующим показателям оценки качества: внешний вид, растворимость в растворителе для инъекций, прозрачность 0,1% раствора, рН, остаточная влажность, размеры частиц, суспендируемость, количественное содержание. В результате проведенных исследований режимы №1, 2 соответствуют нормам показателей качества, однако при лиофилизации режимом № 3 суспензия начинала разрушаться в процессе лиофилизации и не соответствует по показателю качества суспендируемость. В целях экономии затрат на электроэнергию целесообразно использовать режим № 1 для лиофилизации гетеромерного пептида.
Технология получения лиофилизата гетеромерного пептида в наночастицах. Технологическая схема производства (рисунок 2) состоит из следующих этапов: приготовление растворов поливинилового спирта, пептида, полимера PLGA 50/50, D-маннитола, приготовление одинарной эмульсии и двойной эмульсии, дополнительное диспергирование, удаление органического растворителя, фильтрование реакционной смеси и смешивание с D-маннитолом, стерильная фильтрация, наполнение ампул, лиофилизация, фасовка, упаковка и маркировка готового продукта.
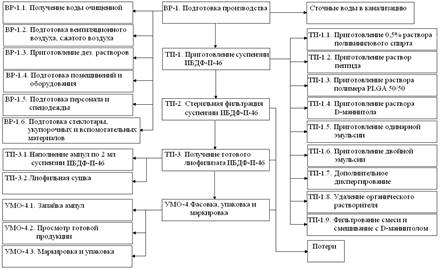
Рис.2. Технологическая схема производства
Таким образом, в результате проведенных исследований разработана и оптимизирована технология получения лиофилизата гетеромерного пептида в наночастицах для приготовления суспензии для инъекции.
Оценка качества готовых лекарственных форм
Готовые лекарственные препараты соответствовали всем показателям качества через 6, 12, 18 и 24 месяца. На основании полученных данных установили срок годности – 2 года. В результате проведенных исследований разработаны предварительные показатели качества (таблица 3).
Таблица 3
Показатели качества лиофилизатов гетеромерного пептида Fur-Lys-His-Ala-Asp-Asp (ИБДФ-П-46) для приготовления растворов для инъекции
|
Показатели |
Полученные данные |
Методы анализа |
||
|
Лиофилизат ИБДФ-П-46
|
Лиофилизат ИБДФ-П-46 в наночастицах |
|||
|
Внешний вид |
Масса белого цвета, высота 22 мм, диаметр 8 мм |
Масса белого цвета, высота 52 мм, диаметр 8 мм |
Визуально метод |
|
|
Растворимость |
Прозрачный раствор |
ОФС 42-0049-07 ГФ XII, часть 1, с. 92 |
||
|
Подлинность |
Хроматограмма соответствует РСО |
ВЭЖХ |
||
|
Однородность дозирования |
0,023 г/амп, ±10% |
0,09 г/амп, ±10% |
ОФС 42-0129-09 ГФ XII, часть 2, стр. 386 |
|
|
Прозрачность 0,1% раствора |
Прозрачный раствор |
ОФС 42-0051-07 ГФ XII, часть 1, стр. 98 |
||
|
Цветность |
Бесцветный раствор |
ОФС 42-0050-07 ГФ XII, часть 1, стр. 93 |
||
|
рН |
6,5 – 7,0 |
ОФС 42-0048-07 ГФ XII, часть 1, стр. 85 |
||
|
Посторонние примеси |
Не обнаружено |
ВЭЖХ |
||
|
Количественное содержание |
0,0079 – 0,0081 г/амп |
ВЭЖХ |
||
|
Размеры частиц (диаметр), нм |
–– |
304,5±4,20 |
Метод динамического светорассеяния |
|
|
Суспендируемость |
–– |
Удовлетворительная, устойчивость в течение 10 мин. |
Визуально |
|
|
Содержание действующего вещества, % |
–– |
10,0±0,1 |
ВЭЖХ |
|
|
Потеря массы при высушивании |
Не более 3% |
ГФ XI, часть 1, стр. 176 |
||
|
Механические включения |
Не обнаружены |
РД 42-501-98 «Инструкция по контролю на механические включения инъекционных лекарственных средств» |
||
|
Стерильность |
Стерилен |
ОФС 42-0066-07 ГФ XII, часть 1, стр. 150 |
||
|
Пирогенность |
Апирогенен |
ОФС 42-0061-07 ГФ XII, часть 1, стр. 125 |
||
|
Бактериальные эндотоксины |
Не содержит |
ОФС 42-0062-07 ГФ XII, часть 1, стр. 128 |
||
|
Хранение |
В сухом защищенном от света месте при температуре -20 °C. |
|||
|
Срок годности |
2 года |
|||
Таким образом, в результате приведенных исследований разработаны предварительные показатели качества. Исследована стабильность и установлены сроки годности готовых лекарственных форм.
Выводы
1. Разработаны технологии получения стабильных при хранении лиофилизированных лекарственных форм: гетеромерный пептид, лиофилизат для приготовления раствора для инъекции 8 мг и гетеромерный пептид в наночастицах, лиофилизат для приготовления эмульсии для инъекции 8 мг.
2. Оптимизирована заморозка и лиофилизация гетеромерного пептида.
3. На серии лиофилизированных лекарственных форм гетеромерного пептида установлено сохранение показателей качества в течение 2 лет.
Рецензенты:
Раменская Г.В., д.фарм.н., профессор, заведующая кафедрой фармацевтической и токсикологической химия ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, г. Москва;
Козин С.В., д.б.н., ведущий научный сотрудник лаборатории биологически активных соединений НИИ фармации ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, г. Москва.
Библиографическая ссылка
Алексеев А.А., Павлова Л.А., Королев В.Л., Лоторев Д.С. РАЗРАБОТКА ТЕХНОЛОГИИ ПОЛУЧЕНИЯ ГОТОВЫХ ЛЕКАРСТВЕННЫХ ФОРМ ГЕТЕРОМЕРНОГО ПЕПТИДА // Современные проблемы науки и образования. 2015. № 1-2. ;URL: https://science-education.ru/ru/article/view?id=19778 (дата обращения: 26.02.2026).



