Гесперидин – (5,3'-диокси-4'-метокси-7-О-глюкорамнозид) флавоноид группы флаванонов, применяемый в медицинской практике как венотропное средство, уменьшает клинические симптомы хронической венозной недостаточности и улучшает тонус вен путем лимфатического дренажа [1, 4, 8]. Доступным сырьевым источником для получения гесперидина является чаще всего кожура апельсинов и мандаринов, хотя в последнем его содержание гораздо выше [3, 7, 9].
Принимая во внимание широкий фармакологический спектр флавоноидов, необходимо отметить, что получение полусинтетических производных путем модификации молекул природных флавоноидов позволит значительно расширить арсенал фармакологических средств. Так, по данным литературы [1, 2, 6] известно, что оксимы флавоноидов характеризуются более выраженными антиоксидантными свойствами, чем исходные соединения.
Благодаря своим структурным особенностям флавоноиды вступают в различные реакции как с электрофильными, так и с нуклеофильными реагентами, а также реакции окисления и восстановления [5]. Реакции оксимирования и гидразонирования целесообразно использовать для введения азотсодержащих функциональных групп.
Целью нашего исследования является получение оксима гесперетина и изучение его физико-химических характеристик.


Рис. 1. Структура гесперетина и оксима гесперетина
Материалы и методы
Гесперидин, представляющий собой гесперетин-7-О-рамноглюкозид, выделен из кожуры мандарина (С. reticulata) [8]. В реакциях нуклеофильного замещения, к которым относится оксиминирование, агликоны флаванонов являются более активными, чем флавонов, что подтверждается зарядным распределением. Следующим шагом наших исследований является получение агликона по методике, изложенной в работе [3]. Оптимальной системой для гидролиза 7-О-рамноглюкозида гесперетина с целью получения агликона является смесь СН3СООН:Н2SО4:С2Н5ОН (1:1:9) с выходом 98% [3].
Электронные спектры поглощения измерены на спектрофотометре СФ-103 в кварцевых кюветах с рабочей длиной 1 см. ИК-спектры – на Фурье-спектрометре ФСМ 1201 в диапазоне 4000–500 см-1 в виде суспензии в вазелиновом масле. Спектры 1Н-ЯМР регистрировали в DMSO – D6, на приборе Brucker-300 Mhz при 20 °С.
Экспериментальная часть
Получение оксима гесперетина: 0,5 г гесперетина растворяли в этаноле, добавляли 0,2 г гидроксиламина солянокислого и 0,2 г ацетата натрия. Реакционную смесь нагревали в течение 5 ч на водяной бане, затем выливали на лед. Получали бледно-желтые ромбические кристаллы с выходом 85%.
Результаты и их обсуждение
Физические свойства оксима гесперетина
Полученный оксим представляет собой бледно-желтые кристаллы ромбической формы с температурой плавления 233 °С. Растворим в EtOH, ДМСО (диметилсульфоксиде), CHCL3 и не растворим в воде.
УФ-спектроскопические характеристики
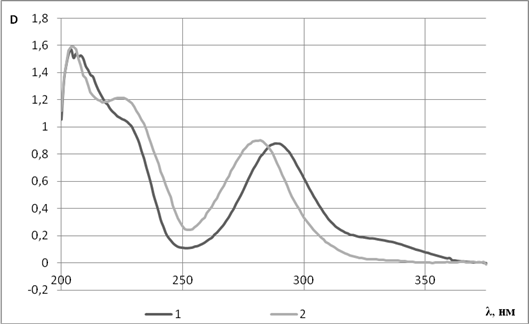
Рис. 2. УФ-спектры 1-гесперетина и 2-оксима гесперетина
УФ-спектры гесперетина и оксима гесперетина в EtOH представлены на рисунке 2. Гесперетин, как большинство флавонов и флаванонов, проявляет две полосы поглощения: при 289 нм (I полоса), обусловленная кольцом В, и при 336 нм (II полоса) – кольцом А.
Наличие в молекуле =N—ОН группы обусловливает значительное гипсохромное смещение полос поглощения по сравнению с незамещенным флаваноном вследствие взаимодействия неподеленной электронной пары атома азота с электронами бензольного кольца, максимумы поглощения составляют 282 нм и 330 нм.
ИК-спектроскопия
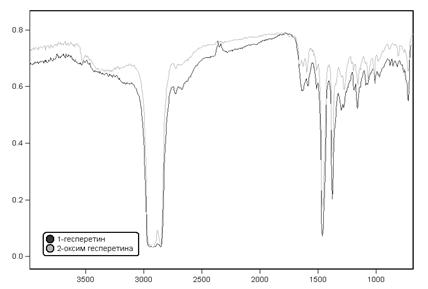
Рис. 3. ИК-спектры гесперетина и его оксима
В ИК-спектрах в области около 3400 см-1 наблюдается интенсивная широкая полоса поглощения ассоциированной ОН-группы у гесперетина и 3330 у оксима. ν (С=С) и ν (С-О-С) прописывается в области 1590 сом-1 и 1247 см-1 соответственно, для оксима гесперетина эти полосы проявляются при 1590 см-1 и 1240 см-1 . Для гесперетина в области 1647 см-1 проявляется ν (С=О), в оксиме при 1637 проявляется С=N связь группы =N-ОН (рис. 3).
13С- и 1Н -ЯМР спектроскопия
Таблица 1
Данные спектроскопии ЯМР 13С и 1Н для гесперетина и оксима гесперетина
|
Атом |
Гесперетин |
Оксим гесперетина |
||
|
δ 13С, м.д. |
δ 1Н, м.д.(600 MHz,DMSO-d6) |
δ 13С, м.д |
δ 1Н, м.д. (600 MHz,DMSO-d6) |
|
|
С-2 |
82,43 |
5,44 |
79,73 |
5,03 |
|
С-3ax |
44,31 |
2,65 |
44,30 |
2,75 |
|
С-3eq |
|
3,18 |
|
3,27 |
|
С-4 |
200,39 |
|
157,26 |
|
|
С-5 |
167,02* |
12,11 |
161,90* |
12,12 |
|
С-6 |
100,01 |
5,89 |
100,59 |
5,89 |
|
С-7 |
167,69* |
10,76 |
163,29* |
11,18 |
|
С-8 |
99,20 |
5,89 |
99,41 |
5,87 |
|
С-9 |
163,85 |
|
164,52 |
|
|
С-10 |
106,04 |
|
101,27 |
|
|
С-11 |
135,04 |
|
136,43 |
|
|
С-21 |
116,29 |
6,94 |
116,30 |
6,94 |
|
С-31 |
150,72 |
9,05 |
150,70 |
9,79 |
|
С-41 |
152,12 |
|
151,87 |
|
|
С-51 |
118,29 |
6,86 |
118,08 |
6,84 |
|
С-61 |
121,87 |
6,94 |
121,59 |
6,94 |
|
O-СН3 |
59,93 |
3,76 |
59,92 |
3,77 |
|
N-OH |
|
|
|
11,20 |
* — отнесение сигналов можно инвертировать
Выводы: получено новое соединение оксим гесперетина и доказана его структура с помощью современных методов анализа.
Рецензенты:
Оганесян Э.Т., д.фарм.н., профессор, заведующий кафедрой органической химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Кодониди И.П., д.фарм.н., доцент, профессор кафедры органической химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.



