В пятидесятых годах прошлого столетия в Ставропольском научно-исследовательском противочумном институте (СтавНИПЧИ) было организовано производство чумной живой вакцины, которое осуществляется до настоящего времени. Иммунобиологические препараты для диагностики особо опасных и других инфекций производили в Украине, Молдавии, Грузии, Казахстане. В результате известных геополитических событий Российская Федерация лишилась производственной базы этих препаратов. Это послужило основанием для организации их производства на территории РФ. В частности, к настоящему времени в ФКУЗ Ставропольский противочумный институт Роспотребнадзора разработаны и находятся на разных этапах внедрения более 20 медицинских иммунобиологических препаратов (МИБП). Организация рациональной системы контроля является важной составляющей производства. Некоторые вопросы, относящиеся к этой проблеме, рассматриваются в данной работе.
Предприятию, занимающемуся выпуском продукции, для успешной и устойчивой работы необходимо обеспечить выпуск запланированного ее объема, соблюсти установленные сроки, добиться низкой себестоимости и при этом обеспечить требуемый уровень качества. Трудность одновременного достижения всех этих целей заключается в том, что в обыденной практике они, как правило, противоречат друг другу. Тем не менее, улучшение качества может вызвать «цепную реакцию»: уменьшение потерь на брак и рекламации, снижение затрат, рост производительности труда, повышение доли на рынке. Подобная «цепная реакция» с существенными результатами возникает в случае удачно найденного решения по повышению качества, внедрение которого не требует больших затрат. Поскольку качество формируется в процессе создания продукции, первостепенное значение для управления им имеет качественная разработка самого продукта, знание технологии и организации производства, чтобы охватить весь производственный процесс, не оставив без контроля и воздействия ни одного этапа работ [5].
В рамках современных требований к организации производства диагностических препаратов необходимо руководствоваться Правилами GMP (Good Manufacturing Practice – правильно организованное производство), которые представляют собой систему требований, рекомендаций и мер, выполнение которых позволяет помочь предприятию организовать выпуск качественной продукции. В отличие от стандартов серии ИСО 9000, они детализованы и имеют конкурентную отраслевую направленность. Вобрав в себя многолетний опыт лучших компаний, Правила рассматривают многие, на первый взгляд, малозначимые детали, способные, однако, оказывать существенное и даже решающее влияние на качество продукции. Основное внимание Правила уделяют чистым условиям производства («clean room technology») и системе всех сопутствующих мероприятий для их поддерживания. Они также требуют от производителя осуществлять действия, позволяющие быть уверенным, что технологические процессы, основное и вспомогательное оборудование, средства и методы измерений функционируют в соответствии с установленными требованиями. К этим действиям относят работы по различным проверкам и испытаниям, называемым варификация, квалификация, валидация [1].
Валидация основана на проведении испытаний в реальных производственных условиях с необходимым числом повторений для обеспечения достоверности получаемых результатов. Поэтому она является наиболее сложным и дорогостоящим процессом, требующим значительных ресурсов предприятия. Правила GMP рекомендуют проводить валидацию, в первую очередь, для критических процессов. Под ними понимают процессы, оказывающие значительное влияние на конечный результат, то есть качество и безопасность конечного продукта. Выявление критических процессов производства позволяет именно на них сосредоточить, в первую очередь, людские и финансовые ресурсы. Это дает возможность получить лучшие результаты при меньших затратах. Однако Правила GMP не содержат метода определения того, какой процесс является критическим. Такой метод содержит система HACCP – Hazar Analysis Critical Control Points (система анализа риска в критических контрольных точках) [1; 9]. В России, по известным причинам, этот процесс пока в самом начале. В 1998 году во Всероссийском научно-практическом институте сертификации (ВНИИС) начались исследования по проблемам НАССР применительно к российской действительности, в результате чего были сформулированы основные требования к отечественной НАССР. В частности, предусматривалось при выборе потенциально опасных (i) факторов учитывать действующие государственные стандарты, санитарные нормы и правила, а при выборе критических контрольных точек процесса – традиционные схемы производственного и санитарного контроля.
Под критической контрольной точкой понимают любой этап жизни продукции: от сырья до получения готового продукта, его хранение, транспортировки и применения. Критические контрольные точки при производстве определяются технологическими операциями, каждая из которых имеет определенную степень риска получения недоброкачественной продукции [9]. Процесс определения критических точек можно максимально формализовать с помощью так называемого «Дерева принятия решений»- системы вопросов и ответов, позволяющих исключить ошибки при проведении этого процесса (рисунок 1).
Производство МИБП – это сложный многостадийный процесс, причем каждая стадия включает целый ряд манипуляций, требующих специальной подготовки и соблюдения определенных правил, а также технологических и методических требований. Основные требования к производству и контролю МИБП изложены в правилах и нормативных документах Минздрава России [2; 3; 4; 6; 7; 10]. Система обеспечения качества (Quality assurance system) представляет собой комплекс организационных и технических мер, обеспечивающих выпуск МИБП в соответствии с заданными требованиями (ГОСТ Р 52537-2006).
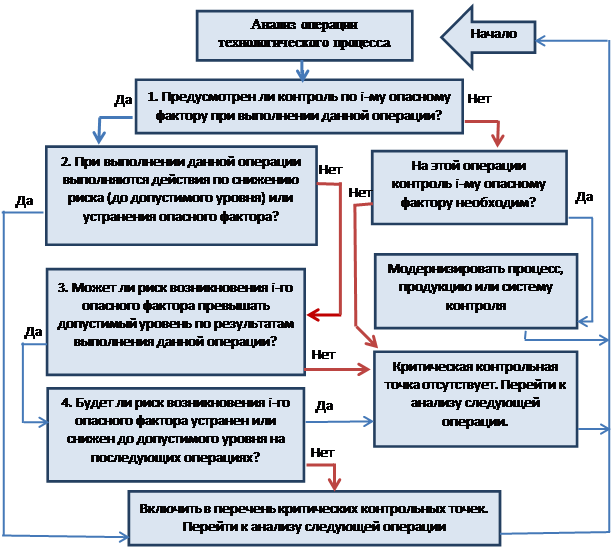 |
Рисунок 1. Алгоритм «Дерева принятия решений» (определение критических точек производства)
Политика в области качества, проводимая в ФКУЗ Ставропольский противочумный институт Роспотребнадзора, ориентирована на потребителя, направлена на обеспечение надлежащего производства и контроля качества на всех этапах производства МИБП и включает комплекс мероприятий, обеспечивающих соответствие качества препарата требованиям действующей нормативной документации (НД): использование в производстве исходных материалов, отвечающих требованиям промышленного регламента производства МИБП и фармакопейной статьи предприятия; производство МИБП в помещениях и на технологическом оборудовании, гарантирующие выпуск продукции в соответствии с заданными требованиями НД; надлежащая подготовка условий производства; соответствие персонала требованиям к профессиональной подготовке, личной гигиене, исполнительной дисциплине.
Для поэтапного введения в действие стандарта отрасли ОСТ 42-510-98 «Правила организации производства и контроля качества лекарственных средств (GMP)» в ФКУЗ Ставропольский противочумный институт Роспотребнадзора созданы комиссии с функциями самоинспекции производства МИБП. Проведенный анализ различных инспектирований, применяемых в таких производствах, выявил четыре их градации: 1- внешнее и внутреннее – по уровню инспектируемой организации; 2 – полное и сокращенное – по количеству проверяемых разделов производства; 3 – плановое и внеплановое – по времени проведения; 4 – процессов и элементов – по цели проведения. Внешнее инспектирование осуществляет Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Минздравсоцразвития России. Внутренне инспектирование проводят специалисты ФКУЗ Ставропольский противочумный институт Роспотребнадзора. Проведение внутреннего аудита в сокращенном объеме допустимо, когда условия производства соответствуют требованиям СП 3.3.2.1288-03 [7].
Системный подход к управлению качеством продукции основан на выявлении и понимании взаимосвязанных процессов, их управления как системой, повышении результативности и эффективности процесса производства МИБП. Функционирование системы обеспечения качества возможно при четкой систематизации производственной документации на три блока: НД на МИБП, технологическая документация, учетно-отчетная документация. Персонал является существенным разделом системы обеспечения качества, так как служит критическим моментом в производстве МИБП, источником возможных технологических нарушений, приводящих к браку продукции. В связи с этим в институте создана система работы с персоналом, которая включает в себя следующие элементы: разработку и документальное оформление требований к персоналу; подбор и расстановку персонала; создание системы обучения персонала (первичное, периодическое, специальное, внеочередное); аттестацию персонала; контроль выполнения персоналом требований должностных инструкций и стандартных операционных процедур; мониторинг за состоянием здоровья персонала [8].
Опираясь на вышеизложенные положения и собственный опыт организации производства, мы составили блок-схему (алгоритм) производственного процесса МИБП для диагностики и профилактики инфекционных заболеваний, выпускаемых в ФКУЗ Ставропольский противочумный институт Роспотребнадзора (рисунок 2). Пользуясь алгоритмом принятия решения, мы определили критические и контрольные точки производства. Выпуск серий МИБП различной направленности показал эффективность такого подхода, обеспечивающего высокое качество конечного продукта (МИБП) при экономии материальных средств и трудозатрат.
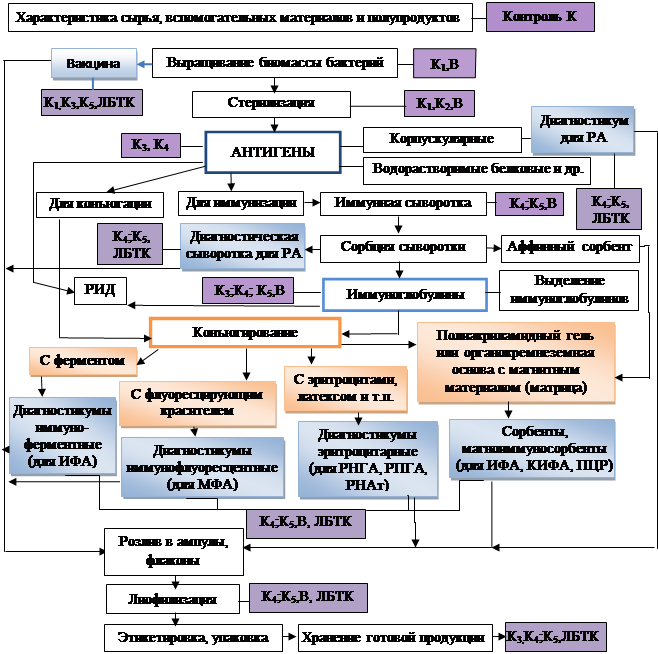
Рисунок 2. Схема процесса производства и контроля различных иммунобиологических диагностических препаратов
Обозначения: К-К5 - критические контрольные точки: К - входной контроль; К1 – контроль чистоты культуры; К2 – контроль специфичной стерильности; К3 – количественный контроль; К4 – контроль специфичности; К5 – контроль специфической активности и чувствительности; В – внутренний контроль подразделения; ЛБТК – контроль, производимый лабораторией биологического и технологического контроля предприятия; ИФА – иммуноферментный анализ; МФА – метод флуоресцирующих антител; РА – реакция агглютинации; МФА – метод флуоресцирующих антител; РИД – реакция иммунодиффузии (в агаровом геле); РНГА – реакция непрямой гемагглютинации; РНАт – реакция нейтрализации антител; РПГА – реакция пассивной гемагглютинации.
Однако, как показывает практика, в силу разных причин может произойти выпуск некачественной продукции. В этом случае действия персонала могут происходить по схеме, представленной на рисунке 3.

Рисунок 3. Блок-схема управления несоответствующей продукцией
Организационная структура системы обеспечения качества при производстве МИБП в ФКУЗ Ставропольский противочумный институт Роспотребнадзора включает директора института, заведующего лабораторией биологического и технологического контроля (ЛБТК) с сектором обеспечения качества, главного инженера, заведующего отделом материально-технического обеспечения, метролога, руководителя группы входного контроля ЛБТК, заведующего сектором обеспечения качества, руководителя рабочей группы по валидации и председателя комиссии по самоинспекции производства МИБП.
Инспектирование научно-производственных подразделений (научно-производственной лаборатории (НПЛ) препаратов для диагностики особо опасных и других инфекций, НПЛ чумных вакцин, лаборатории питательных сред для культивирования микроорганизмов I-IV групп патогенности, вивария, медицинского склада, склада готовой продукции) и ЛБТК, занятых в производстве и контроле МИБП, проводится по плану, утверждаемому директором института на текущий календарный год, в начале и в конце производственного цикла. Результаты инспектирования регистрируются в актах и обобщают в годовых отчетах комиссии по самоинспекции производства МИБП. Приказы, планы, отчеты и формы актов внутреннего инспектирования разрабатывает председатель комиссии по самоинспекции и утверждает директор института. При проведении аудита отмечают замечания, которые дифференцируют на критические, существенные и другие. На основании результатов инспектирования и выявленных недостатков разрабатывают План корректирующих мероприятий, который также утверждает директор института. Пакет документов по аудиту того или иного препарата хранят в ЛБТК в общедоступном месте.
Таким образом, действующая в ФКУЗ Ставропольский противочумный институт Роспотребнадзора система обеспечения качества при производстве МИБП нашла свое отражение в разработанной принципиальной модели, организационной схеме, системе работы с персоналом, систематизации производственной документации, что является основанием для совершенствования контроля за производством и качеством МИБП.
Рецензенты:
Таран Т.В., д.м.н., старший научный сотрудник, зав. лабораторией подготовки специалистов ФКУЗ Ставропольский противочумный институт Роспотребнадзора, г. Ставрополь;
Будыка Д.А., д.м.н., старший научный сотрудник, зав. научно-производственной лабораторией чумных вакцин ФКУЗ Ставропольский противочумный институт Роспотребнадзора, г. Ставрополь.



