В пятидесятых годах прошлого столетия в Ставропольском научно-исследовательском противочумном институте (СтавНИПЧИ) было организовано производство чумной живой вакцины, которое осуществляется до настоящего времени. Иммунобиологические препараты для диагностики особо опасных и других инфекций производили в Украине, Молдавии, Грузии, Казахстане. В результате известных геополитических событий Российская Федерация лишилась производственной базы этих препаратов. Это послужило основанием для организации их производства на территории РФ. В частности, к настоящему времени в ФКУЗ Ставропольский противочумный институт Роспотребнадзора разработаны и находятся на разных этапах внедрения более 20 медицинских иммунобиологических препаратов (МИБП). Организация рациональной системы контроля является важной составляющей производства. Некоторые вопросы, относящиеся к этой проблеме, рассматриваются в данной работе.
Предприятию, занимающемуся выпуском продукции, для успешной и устойчивой работы необходимо обеспечить выпуск запланированного ее объема, соблюсти установленные сроки, добиться низкой себестоимости и при этом обеспечить требуемый уровень качества. Трудность одновременного достижения всех этих целей заключается в том, что в обыденной практике они, как правило, противоречат друг другу. Тем не менее, улучшение качества может вызвать «цепную реакцию»: уменьшение потерь на брак и рекламации, снижение затрат, рост производительности труда, повышение доли на рынке. Подобная «цепная реакция» с существенными результатами возникает в случае удачно найденного решения по повышению качества, внедрение которого не требует больших затрат. Поскольку качество формируется в процессе создания продукции, первостепенное значение для управления им имеет качественная разработка самого продукта, знание технологии и организации производства, чтобы охватить весь производственный процесс, не оставив без контроля и воздействия ни одного этапа работ [5].
В рамках современных требований к организации производства диагностических препаратов необходимо руководствоваться Правилами GMP (Good Manufacturing Practice – правильно организованное производство), которые представляют собой систему требований, рекомендаций и мер, выполнение которых позволяет помочь предприятию организовать выпуск качественной продукции. В отличие от стандартов серии ИСО 9000, они детализованы и имеют конкурентную отраслевую направленность. Вобрав в себя многолетний опыт лучших компаний, Правила рассматривают многие, на первый взгляд, малозначимые детали, способные, однако, оказывать существенное и даже решающее влияние на качество продукции. Основное внимание Правила уделяют чистым условиям производства («clean room technology») и системе всех сопутствующих мероприятий для их поддерживания. Они также требуют от производителя осуществлять действия, позволяющие быть уверенным, что технологические процессы, основное и вспомогательное оборудование, средства и методы измерений функционируют в соответствии с установленными требованиями. К этим действиям относят работы по различным проверкам и испытаниям, называемым варификация, квалификация, валидация [1].
Валидация основана на проведении испытаний в реальных производственных условиях с необходимым числом повторений для обеспечения достоверности получаемых результатов. Поэтому она является наиболее сложным и дорогостоящим процессом, требующим значительных ресурсов предприятия. Правила GMP рекомендуют проводить валидацию, в первую очередь, для критических процессов. Под ними понимают процессы, оказывающие значительное влияние на конечный результат, то есть качество и безопасность конечного продукта. Выявление критических процессов производства позволяет именно на них сосредоточить, в первую очередь, людские и финансовые ресурсы. Это дает возможность получить лучшие результаты при меньших затратах. Однако Правила GMP не содержат метода определения того, какой процесс является критическим. Такой метод содержит система HACCP – Hazar Analysis Critical Control Points (система анализа риска в критических контрольных точках) [1; 9]. В России, по известным причинам, этот процесс пока в самом начале. В 1998 году во Всероссийском научно-практическом институте сертификации (ВНИИС) начались исследования по проблемам НАССР применительно к российской действительности, в результате чего были сформулированы основные требования к отечественной НАССР. В частности, предусматривалось при выборе потенциально опасных (i) факторов учитывать действующие государственные стандарты, санитарные нормы и правила, а при выборе критических контрольных точек процесса – традиционные схемы производственного и санитарного контроля.
Под критической контрольной точкой понимают любой этап жизни продукции: от сырья до получения готового продукта, его хранение, транспортировки и применения. Критические контрольные точки при производстве определяются технологическими операциями, каждая из которых имеет определенную степень риска получения недоброкачественной продукции [9]. Процесс определения критических точек можно максимально формализовать с помощью так называемого «Дерева принятия решений»- системы вопросов и ответов, позволяющих исключить ошибки при проведении этого процесса (рисунок 1).
Производство МИБП – это сложный многостадийный процесс, причем каждая стадия включает целый ряд манипуляций, требующих специальной подготовки и соблюдения определенных правил, а также технологических и методических требований. Основные требования к производству и контролю МИБП изложены в правилах и нормативных документах Минздрава России [2; 3; 4; 6; 7; 10]. Система обеспечения качества (Quality assurance system) представляет собой комплекс организационных и технических мер, обеспечивающих выпуск МИБП в соответствии с заданными требованиями (ГОСТ Р 52537-2006).
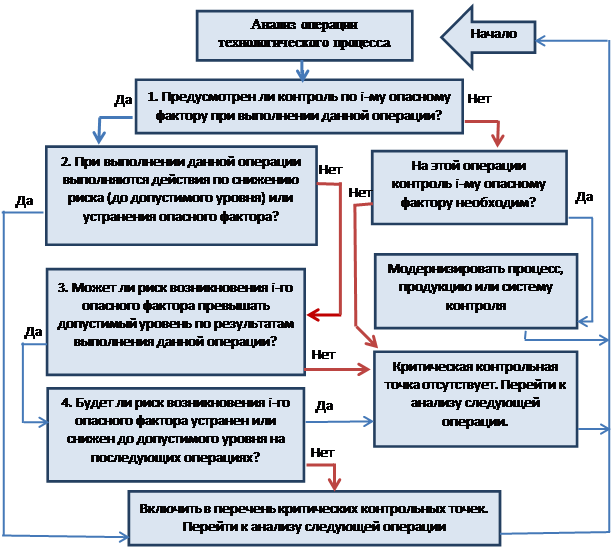 |
Рисунок 1. Алгоритм «Дерева принятия решений» (определение критических точек производства)
Политика в области качества, проводимая в ФКУЗ Ставропольский противочумный институт Роспотребнадзора, ориентирована на потребителя, направлена на обеспечение надлежащего производства и контроля качества на всех этапах производства МИБП и включает комплекс мероприятий, обеспечивающих соответствие качества препарата требованиям действующей нормативной документации (НД): использование в производстве исходных материалов, отвечающих требованиям промышленного регламента производства МИБП и фармакопейной статьи предприятия; производство МИБП в помещениях и на технологическом оборудовании, гарантирующие выпуск продукции в соответствии с заданными требованиями НД; надлежащая подготовка условий производства; соответствие персонала требованиям к профессиональной подготовке, личной гигиене, исполнительной дисциплине.
Для поэтапного введения в действие стандарта отрасли ОСТ 42-510-98 «Правила организации производства и контроля качества лекарственных средств (GMP)» в ФКУЗ Ставропольский противочумный институт Роспотребнадзора созданы комиссии с функциями самоинспекции производства МИБП. Проведенный анализ различных инспектирований, применяемых в таких производствах, выявил четыре их градации: 1- внешнее и внутреннее – по уровню инспектируемой организации; 2 – полное и сокращенное – по количеству проверяемых разделов производства; 3 – плановое и внеплановое – по времени проведения; 4 – процессов и элементов – по цели проведения. Внешнее инспектирование осуществляет Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Минздравсоцразвития России. Внутренне инспектирование проводят специалисты ФКУЗ Ставропольский противочумный институт Роспотребнадзора. Проведение внутреннего аудита в сокращенном объеме допустимо, когда условия производства соответствуют требованиям СП 3.3.2.1288-03 [7].
Системный подход к управлению качеством продукции основан на выявлении и понимании взаимосвязанных процессов, их управления как системой, повышении результативности и эффективности процесса производства МИБП. Функционирование системы обеспечения качества возможно при четкой систематизации производственной документации на три блока: НД на МИБП, технологическая документация, учетно-отчетная документация. Персонал является существенным разделом системы обеспечения качества, так как служит критическим моментом в производстве МИБП, источником возможных технологических нарушений, приводящих к браку продукции. В связи с этим в институте создана система работы с персоналом, которая включает в себя следующие элементы: разработку и документальное оформление требований к персоналу; подбор и расстановку персонала; создание системы обучения персонала (первичное, периодическое, специальное, внеочередное); аттестацию персонала; контроль выполнения персоналом требований должностных инструкций и стандартных операционных процедур; мониторинг за состоянием здоровья персонала [8].
Опираясь на вышеизложенные положения и собственный опыт организации производства, мы составили блок-схему (алгоритм) производственного процесса МИБП для диагностики и профилактики инфекционных заболеваний, выпускаемых в ФКУЗ Ставропольский противочумный институт Роспотребнадзора (рисунок 2). Пользуясь алгоритмом принятия решения, мы определили критические и контрольные точки производства. Выпуск серий МИБП различной направленности показал эффективность такого подхода, обеспечивающего высокое качество конечного продукта (МИБП) при экономии материальных средств и трудозатрат.
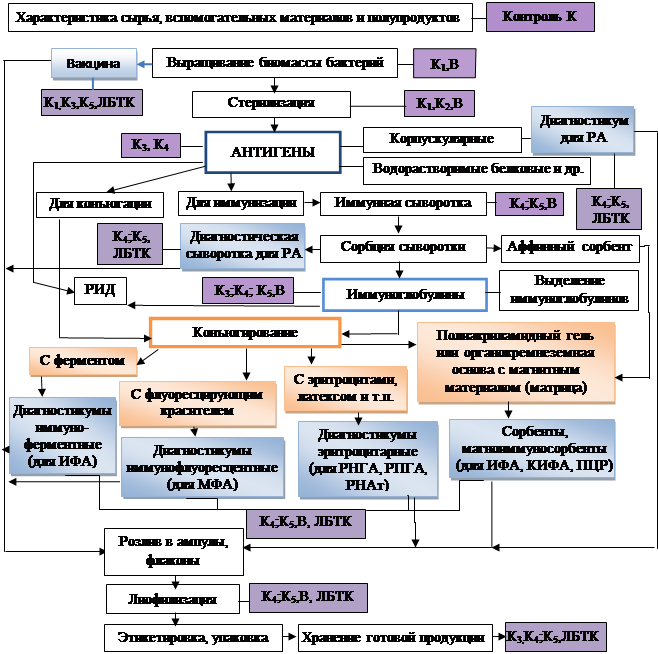
Рисунок 2. Схема процесса производства и контроля различных иммунобиологических диагностических препаратов
Обозначения: К-К5 - критические контрольные точки: К - входной контроль; К1 – контроль чистоты культуры; К2 – контроль специфичной стерильности; К3 – количественный контроль; К4 – контроль специфичности; К5 – контроль специфической активности и чувствительности; В – внутренний контроль подразделения; ЛБТК – контроль, производимый лабораторией биологического и технологического контроля предприятия; ИФА – иммуноферментный анализ; МФА – метод флуоресцирующих антител; РА – реакция агглютинации; МФА – метод флуоресцирующих антител; РИД – реакция иммунодиффузии (в агаровом геле); РНГА – реакция непрямой гемагглютинации; РНАт – реакция нейтрализации антител; РПГА – реакция пассивной гемагглютинации.
Однако, как показывает практика, в силу разных причин может произойти выпуск некачественной продукции. В этом случае действия персонала могут происходить по схеме, представленной на рисунке 3.

Рисунок 3. Блок-схема управления несоответствующей продукцией
Организационная структура системы обеспечения качества при производстве МИБП в ФКУЗ Ставропольский противочумный институт Роспотребнадзора включает директора института, заведующего лабораторией биологического и технологического контроля (ЛБТК) с сектором обеспечения качества, главного инженера, заведующего отделом материально-технического обеспечения, метролога, руководителя группы входного контроля ЛБТК, заведующего сектором обеспечения качества, руководителя рабочей группы по валидации и председателя комиссии по самоинспекции производства МИБП.
Инспектирование научно-производственных подразделений (научно-производственной лаборатории (НПЛ) препаратов для диагностики особо опасных и других инфекций, НПЛ чумных вакцин, лаборатории питательных сред для культивирования микроорганизмов I-IV групп патогенности, вивария, медицинского склада, склада готовой продукции) и ЛБТК, занятых в производстве и контроле МИБП, проводится по плану, утверждаемому директором института на текущий календарный год, в начале и в конце производственного цикла. Результаты инспектирования регистрируются в актах и обобщают в годовых отчетах комиссии по самоинспекции производства МИБП. Приказы, планы, отчеты и формы актов внутреннего инспектирования разрабатывает председатель комиссии по самоинспекции и утверждает директор института. При проведении аудита отмечают замечания, которые дифференцируют на критические, существенные и другие. На основании результатов инспектирования и выявленных недостатков разрабатывают План корректирующих мероприятий, который также утверждает директор института. Пакет документов по аудиту того или иного препарата хранят в ЛБТК в общедоступном месте.
Таким образом, действующая в ФКУЗ Ставропольский противочумный институт Роспотребнадзора система обеспечения качества при производстве МИБП нашла свое отражение в разработанной принципиальной модели, организационной схеме, системе работы с персоналом, систематизации производственной документации, что является основанием для совершенствования контроля за производством и качеством МИБП.
Рецензенты:
Таран Т.В., д.м.н., старший научный сотрудник, зав. лабораторией подготовки специалистов ФКУЗ Ставропольский противочумный институт Роспотребнадзора, г. Ставрополь;
Будыка Д.А., д.м.н., старший научный сотрудник, зав. научно-производственной лабораторией чумных вакцин ФКУЗ Ставропольский противочумный институт Роспотребнадзора, г. Ставрополь.
Библиографическая ссылка
Тюменцева И.С., Афанасьев Е.Н., Курчева С.А., Гаркуша Ю.Ю., Семирчева А.А., Старцева О.Л., Жданова Е.В. ОПТИМИЗАЦИЯ СИСТЕМЫ КОНТРОЛЯ БИОТЕХНОЛОГИИ ПРОИЗВОДСТВА МЕДИЦИНСКИХ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ, ВЫПУСКАЕМЫХ ФКУЗ СТАВРОПОЛЬСКИЙ ПРОТИВОЧУМНЫЙ ИНСТИТУТ РОСПОТРЕБНАДЗОРА // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16655 (дата обращения: 23.02.2026).



