Заболеваемость и смертность от сердечно-сосудистых заболеваний (ССЗ) стоит на первом месте во многих странах мира, в том числе и в России. Одним из основных направлений в профилактике ишемической болезни сердца (ИБС) является совершенствование технологий для выявления лиц высокого сердечно-сосудистого риска, в том числе и с бессимптомными формами коронарного атеросклероза с целью назначения ранних инвазивных диагностических мероприятий, а также проведения агрессивных методов профилактики, направленных на предупреждение прогрессирования заболевания.
В последние годы большое внимание уделяется проблеме ожирения как фактору риска (ФР) ИБС, что связано с его высокой распространенностью среди населения [4]. В первую очередь профилактические мероприятия проводятся в группах высокого коронарного риска. В последние годы изучена роль висцеральной жировой ткани и десятков адипокинов в риске развития и прогрессирования ССЗ [9; 16; 21]. Несмотря на это, шкалы для стратификации коронарного риска, которые применяются в настоящее время (Framingham, PROCAM, SCORE), не учитывают основные патогенетические механизмы, связывающие ожирение с сердечно-сосудистыми осложнениями [7; 8; 10; 24; 27].
Цель работы: создать шкалу риска субклинического коронарного атеросклероза у больных с ожирением (СКАБО).
Материалы и методы. В исследование было включено 67 мужчин, 40-65 лет, средний возраст 50,95±6,54 года, с отсутствием клиники стенокардии и клинических проявлений атеросклероза других локализаций. Все пациенты имели общее ожирение I-III степени, ИМТ 35,16±3,32 кг/м² и висцеральное ожирение по показателю тЭЖТ≥7 мм [3]. Из исследования были исключены пациенты с тяжелой сопутствующей патологией, сахарным диабетом 2 типа (СД 2 типа) и пациенты с плохой визуализацией на эхокардиографии (ЭХОКГ).
При включении в исследование измеряли рост и вес пациента, рассчитывали индекс массы тела (ИМТ) по формуле: вес (кг)/рост (м²). При ИМТ ≥ 30 кг/м² диагностировалось общее ожирение (ВНОК, 2009) [5]. У всех пациентов определяли уровень общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеидов высокой и низкой плотности (ЛПВП/ЛПНП), глюкозы. Определение липопротеина а (Лп(а)), аполипопротеина В (АпоВ) и аполипопротеина А1 (Апо А1) проводилось с использованием метода, основанного на измерении иммунопреципитации. Уровень лептина, адипонектина и резистина, а также концентрацию интерлейкина -6 (ИЛ- 6) и фактора некроза опухоли (ФНО) α в сыворотке крови определяли методом иммуноферментного анализа (наборы BioSource, Бельгия). С-реактивный белок (СРБ) определялся высокочувствительным методом иммунопреципитации с латексным усилением с помощью наборов Thermo Fisher Scientific (Финляндия). Эпикардиальное ожирение оценивалось с помощью трансторакальной ЭХОКГ в В-режиме на аппарате Vivid 5 (General Electrics, США) с механическим секторным датчиком 3,5 МГц. Регистрировались три сердечных цикла в парастернальной позиции по длинной оси левого желудочка. Толщина эпикардиальной жировой ткани (тЭЖТ) измерялась за свободной стенкой правого желудочка в конце систолы по линии максимально перпендикулярно фиброзному кольцу аортального клапана, которое использовалось как анатомический ориентир [14; 15]. Для оценки субклинического коронарного атеросклероза проводилась селективная коронароангиография (КАГ) на ангиографическом аппарате INNOVA 3100 (США) или мультиспиральная компьютерная томография коронарных артерий (МСКТ КА) на томографе Aquilion -64 «Toshiba» (Япония) с обработкой данных на рабочей станции VITREA. В результате КАГ или МСКТ были выделены 2 группы сравнения пациентов с эпикардиальным ожирением (ЭО): группу I (n=25) составили пациенты с наличием признаков коронарного атеросклероза, группу II (n=42) – пациенты с отсутствием признаков коронарного атеросклероза. Таким образом, у пациентов с ожирением субклинический коронарный атеросклероз был выявлен в 37% случаев.
Статистический анализ
Статистический анализ выполнялся с помощью статистических пакетов STATISTICA 10 и SPSS-21. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05. Проверка нормальности распределения количественных признаков в группах сравнения проводилась с использованием критериев Колмогорова-Смирнова, Шапиро-Уилка. Дескриптивные статистики в тексте представлены как M ± SD, где М – среднее, а SD-стандартное отклонение, при нормальном распределении признака, и как Med (ВКв; НКв) при ненормальном распределении признака. Для сравнения центральных параметров групп использовались параметрические и непараметрические методы: t-критерий Стьюдента или U-критерий Манна–Уитни. Для создания шкалы прогнозирования коронарного атеросклероза в качестве регрессионной модели была выбрана регрессия с оптимальным шкалированием (Regression with Optimal Scaling (CATREG)), которая реализована в статистической программе SPSS.
Результаты. Клиническая характеристика пациентов I и II групп представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов
|
Группы Показатель |
Группа I (n=25) |
Группа II (n=42) |
Р |
|
тЭЖТ, мм Med (Нкв;Вкв) |
10 (7,0;11,0) |
7,5(7,0;8,0) |
0,042 |
|
Возраст, лет, M±SD |
53,52±6,08 |
49,42±6,39 |
0,012 |
|
Артериальная гипертония, n(%) из них I стадия II стадия гипотензивная терапия, n(%) |
22(88) 2(9) 20(91) 11(50) |
26(62) 7(27) 19(73) 14(54) |
0,021 0,114 0,114 0,790 |
|
Нарушение углеводного обмена, n(%) |
8(32) |
5(12) |
0,044 |
|
Табакокурение, n(%) |
20(80) |
26(62) |
0,122 |
|
Дислипидемия, n(%) |
19(76) |
20(48) |
0,022 |
У пациентов группы I чаще встречалась артериальная гипертония (АГ), нарушения углеводного обмена и дислипидемия.
С целью анализа взаимосвязи субклинического коронарного атеросклероза с предполагаемыми предикторами его развития были изучены основные и дополнительные метаболические, нейрогуморальные ФР и маркеры сосудистого воспаления для определения набора показателей, имевших статистическую связь с зависимой переменной (наличие субклинического коронарного атеросклероза), и формирования предварительного списка переменных для регрессионного анализа. Сравнительная характеристика потенциальных предикторов коронарного атеросклероза представлена в таблице 2.
Было выявлено, что в группе I были более высокие значения ТГ (р=0,027) и более низкие показатели ХС ЛПВП (р=0,047) .
При анализе показателей нейрогуморальной активности висцерального жира в группе I отмечались более высокие уровни лептина, чем в группе II (р=0,002), и более низкие адипонектина (р=0,020). Кроме того, отмечалась тенденция к более высоким показателям резистина, различия между группами были близки к статистической значимости (р=0,054).
Сравнительный анализ маркеров провоспалительной активности плазмы показал, что в группе I отмечались более высокие показатели ИЛ-6 (р=0,042) и более высокие показатели СРБ (р=0,031).
Таблица 2
Сравнительная характеристика предикторов наличия или отсутствия субклинического коронарного атеросклероза в изучаемых группах
|
Группы Предиктор |
Группа I (n=25) |
Группа II (n=42) |
Р |
|
ИМТ, кг/м², Med (НКв, ВКв) |
36 (33; 39) |
34 (32; 37) |
0,099 |
|
Глюкоза, ммоль/л, Med (НКв, ВКв) |
6,0 (4,9; 6,8) |
5,3 (5,0; 6,0) |
0,072 |
|
ОХС, ммоль/л, Med (НКв, ВКв) |
6,0 (4,7; 6,5) |
5,8 (4,8; 6,4) |
0,845 |
|
ХСЛПВП, ммоль/л, Med (НКв, ВКв) |
0,9 (0,9; 1,1) |
1,1 (0,97; 1,2) |
0,047 |
|
ХСЛПНП, ммоль/л, Med (НКв, ВКв) |
3,0 (2,5; 4,0) |
2,7 (2,0; 3,2) |
0,051 |
|
ТГ, ммоль/л, Med (НКв, ВКв) |
2,0 (1,7; 2,4) |
1,8 (1,5; 2,0) |
0,027 |
|
АпоА1, г/л, М±SD |
1,05±0,29 |
1,32±0,34 |
0,067 |
|
АпоВ,г/л, М±SD |
1,4±0,20 |
1,15±0,31 |
0,074 |
|
ЛПа, мг/л, Med (НКв, ВКв) |
220 (170; 300) |
160 (120; 230) |
0,055 |
|
Лептин, нг/мл (НКв, ВКв) |
14,7 (13,8; 16,7) |
9,75 (6,7; 15,6) |
0,002 |
|
Адипонектин, мкг/мл, М±SD |
8,38±2,21 |
10,13±3,26 |
0,020 |
|
Резистин, нг/мл, Med (НКв, ВКв) |
11,6 (10,6; 12,9) |
7,8 (5,6; 14,5) |
0,054 |
|
ФНО-α, пкг/мл, Med (НКв, ВКв) |
4,8 (3,9; 5,4) |
4,3 (2,6; 5,1) |
0,058 |
|
ИЛ-6, пкг/мл, Med (НКв, ВКв) |
5,4 (4,5; 5,8) |
4,5 (3,2; 5,7) |
0,042 |
|
СРБ, г/л, Med (НКв, ВКв) |
5,0 (2,0; 6,0) |
2,0 (1,0; 3,0) |
0,031 |
Таким образом, в число потенциальных предикторов вошли: наличие АГ, наличие углеводных нарушений (гипергликемия натощак или НТГ), ТГ, лептин, адипонектин и СРБ. Для определения пороговых значений количественных предикторов и редукции интервальных переменных в категориальные был проведен ROC-анализ.
Так, для ТГ оптимальной точкой отсечения было значение 1,8 мм/л (чувствительность 72%, специфичность 66,7%), для лептина 12,8 нг/мл (чувствительность 80%, специфичность 64%) (рисунок 1).
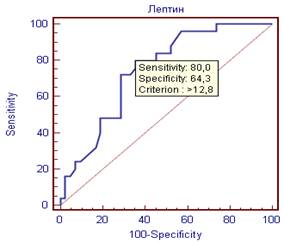
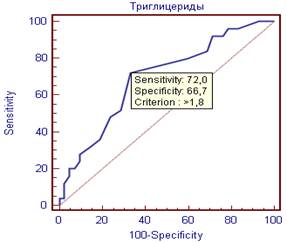
Рисунок 1. ROC – кривые оценки лептина и ТГ как предикторов субклинического коронарного атеросклероза.
Для адипонектина точкой отсечения стало значение 10 мкм/мл (чувствительность 84%, специфичность 45%), для СРБ 5 мг/мл (чувствительность 64%, специфичность 76%) (рисунок 2).
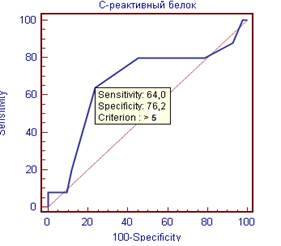
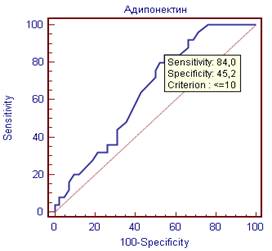
Рисунок 2. ROC – кривые оценки адипонектина и СРБ как предикторов субклинического коронарного атеросклероза.
После получения пороговых точек отсечения был проведен регрессионный анализ с оптимальным шкалированием для оценки значимости предикторов шкалы СКАБО. Полученные коэффициенты важности были выбраны в качестве весовых значений для создания шкалы. Для каждого из 6 включенных в регрессионную модель предикторов был подсчитан балл путем умножения абсолютного значения соответствующего коэффициента важности на 100 и округления до целых чисел (таблица 3).
Таблица 3
Результаты регрессионного анализа оценки значимости предикторов шкалы СКАБО
|
Предикторы |
Значение порогов отсечения |
Стандартизованные коэффициенты |
Стат. знач., Р |
Коэф. частной корреляции |
Коэф. важности |
Баллы |
|
|
Бета |
Стандартная ошибка |
||||||
|
Триглицериды |
≥1,8 |
0,262 |
0,105 |
0,015 |
0,314 |
0,234 |
+23 |
|
Лептин |
≥12,8 |
0,240 |
0,147 |
0,107 |
0,213 |
0,246 |
+25 |
|
Адипонектин |
≤10,0 |
0,060 |
0,087 |
0,493 |
0,063 |
0,043 |
+4 |
|
СРБ |
≥5,0 |
0,233 |
0,128 |
0,074 |
0,251 |
0,222 |
+22 |
|
Артериальная гипертензия |
Есть |
0,189 |
0,089 |
0,039 |
0,233 |
0,126 |
+13 |
|
Углеводные нарушения |
Есть |
0,236 |
0,102 |
0,024 |
0,278 |
0,129 |
+13 |
Примечание: бета-коэффициент отражает суммарный вклад предиктора в значение отклика; коэффициент частной корреляции отражает самостоятельный вклад предиктора в значение отклика.
Таким образом, была создана шкала как таковая (таблица 3). Анализ адекватности полученной регрессионной модели был проведен с помощью бинарной логистической регрессии (таблица 4). Величина верных классификаций (79,1%) является высоким показателем, что говорит о хорошей прогностической способности данной регрессионной модели.
Таблица 4
Результаты адекватности классификации с помощью регрессионной модели
|
Наблюдаемые результаты |
Предсказанные результаты |
Процент верных предсказаний |
Общий процент верных предсказаний |
ОШ |
|
|
Атеросклероз есть |
Атеросклероза Нет |
||||
|
Атеросклероз есть |
20 |
5 |
80,0 |
79,1 |
14,7 |
|
Атеросклероза нет |
9 |
33 |
78,6 |
||
Примечание: ОШ - отношение шансов
С помощью полученного уравнения были вычислены теоретические значения вероятности наличия субклинического коронарного атеросклероза для каждого пациента. Диаграмма рассеяния, отражающая данную зависимость, представлена на рисунке 9.
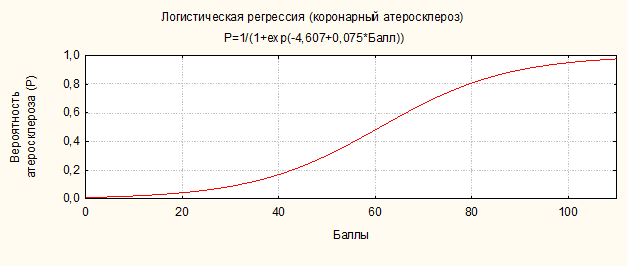
Рисунок 3. Уравнение и график функции логистической регрессии, отражающий зависимость вероятности наличия коронарного атеросклероза от суммарных баллов
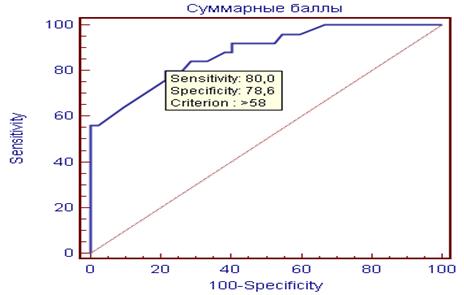
Для определения порогового значения суммарного балла, связанного с высоким риском наличия субклинического коронарного атеросклероза, была построена ROC-кривая (рисунок 4).
|
Area under the ROC curve (AUC) |
0,880 |
|
Standard error |
0,0478 |
|
95% Confidence interval |
0,777 to 0,946 |
|
z statistic |
7,942 |
|
Significance level P (Area=0.5) |
0,0001 |
Рисунок 4. ROC-кривая модели прогнозирования субклинического коронарного атеросклероза. Площадь под кривой равна 0,880.
Оптимальный порог отсечения суммы баллов (cut-off value), позволяющий разделить больных на 2 группы, соответствовал значению 58 баллов. Таким образом, при наличии вероятности коронарного атеросклероза ≥40%, риск его относится к градации высокого (рисунок 3). При проведении кросс-проверки адекватности модели на обучающей выборке была подсчитана фактическая частота случаев наличия субклинического коронарного атеросклероза у пациентов в группе высокого расчетного риска по шкале СКАБО (суммарный балл ≥58).
Таблица 5
Кросс-проверка адекватности модели на обучающей выборке
|
Суммарный балл пациентов |
Доля случаев прогноза коронарного атеросклероза, % (n) |
|
Выше 58 (n=30) |
76,6 (23) |
|
Ниже 58 (n=37) |
5,4 (2) |
|
Статистическая значимость различий по χ2, Р |
<0,001 |
Так, фактическое наличие коронарного атеросклероза у пациентов высокого риска (сумма баллов ≥58) по шкале СКАБО определялось в 76,6% случаев.
Для удобства и простоты практического применения предлагаемого рискометра СКАБО был создан вероятностный калькулятор (MS Exсel,MS Office 2007). Кроме того, воспользоваться шкалой для оценки риска при отсутствии компьютерного обеспечения можно с помощью графика функции логистической регрессии, отражающего зависимость вероятности наличия коронарного атеросклероза от суммарных баллов (рисунок 3).
Обсуждение. У пациентов с ожирением оценка субклинического атеросклероза проводилась в единичных исследованиях. В группе с морбидным ожирением и ИМТ≥40 кг/м² без клиники ИБС (средний возраст 50,4±10 лет, ИМТ 43,8±4,8 кг/м²) (n=41) в Италии у 61% были выявлены стенозы хотя бы одной коронарной артерии (КА) [18]. В другом исследовании, проведенном среди латиноамериканцев, 88,7% участников которого имели ожирение и 53,2% метаболический синдром (МС), в 34,8% случаев были выявлены признаки атеросклероза сонных артерий по данным дуплексного сканирования [17]. У пациентов с МС, диагностированного по классификации АТР III и без клиники ИБС, признаки субклинического коронарного атеросклероза при оценке кальциноза КА были выявлены в 24,7% случаев [13]. В одном из российских исследований у пациентов с абдоминальным ожирением в возрасте от 30 до 55 лет атеросклеротические бляшки в общих и внутренних сонных артериях были обнаружены у 35% пациентов [2]. Так, в нашем исследовании у пациентов с висцеральным ожирением по показателю тЭЖТ≥7 мм субклинический коронарный атеросклероз определялся в 37% случаев.
Сравнительная оценка метаболических ФР в нашем исследовании показала, что в группе I с субклиническим коронарным атеросклерозом определялись более высокие показатели ТГ (р=0,027), лептина (р=0,002), ИЛ-6 (0,042) и СРБ (0,031) и более низкие показатели адипонектина (р=0,020), ХСЛПВ (р=0,047). В одном из исследований у молодых людей уровень СРБ коррелировал с толщиной комплекса интима-медиа в сонных артериях [12]. Также ранее была выявлена связь СРБ с атеросклеротическим поражением как коронарных, так и других периферических артерий [6]. Ранее было доказано, что СРБ и окисленные ХСЛПНП непосредственно связаны с воспалительным повреждением артерий при ИБС [1]. В другом исследовании провоспалительный маркер ИЛ-6 ассоциировался с кальцинозом КА [26]. Уровень лептина также ассоциировался с кальцинозом КА независимо от веса и других ФР, что доказывает проатерогенную роль лептина [25]. Известно, что СРБ является одним из основных маркеров хронического воспаления и непосредственно участвует в прогрессировании атеросклероза коронарных артерий [20]. В одном из исследований выявлено, что висцеральная жировая ткань стимулирует синтез СРБ [23]. У пациентов с ИБС и низким уровнем адипонектина выявляются более выраженные атеросклеротические изменения КА по данным КАГ, чем у больных с высокими его концентрациями [22]. Низкие концентрации адипонектина в сочетании с высокими концентрациями ИЛ-6 у пациентов с ожирением и МС ассоциировались с риском развития ССЗ, а самый высокий риск развития СД 2 типа и ИБС наблюдается у пациентов с сочетанием низких концентраций адипонектина с низким уровнем ХС ЛПВП [11]. Кроме того, низкие концентрации адипонектина положительно коррелировали со степенью кальциноза КА и бессимптомными стенозами, выявленными ангиографически у пациентов с СД 2 типа и без него [19].
Заключение. Созданная шкала СКАБО оценки риска развития субклинического коронарного атеросклероза у больных с ожирением позволяет учитывать основные патогенетические механизмы, связывающие ожирение и коронарный атеросклероз. Так, анализ ТГ, лептина, адипонектина, СРБ, наличие АГ и углеводных нарушений (гипергликемия, НТГ) у конкретного пациента с ЭО позволяет с вероятностью 79,1% прогнозировать наличие или отсутствие коронарного атеросклероза при отсутствии клиники заболевания, что является особенно важным в рамках назначения своевременных профилактических мероприятий и предупреждения прогрессирования заболевания.
Рецензенты:
Попова М.А., д.м.н., профессор, зав. кафедрой госпитальной терапии ГБОУ ВПО «Сургутский государственный университет ХМАО-Югры», г. Сургут.
Петрова М.М., д.м.н., профессор, проректор по НЗ, зав. кафедрой поликлинической терапии, семейной медицины с курсом последипломного образования ГБОУ ВПО «Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого» Минздравсоцразвития России, г. Красноярск.



