Введение. Основным методом лечения местно распространенных процессов плоскоклеточного рака слизистой оболочки полости рта (ПРСПР) является лучевая терапия, при проведении которой число рецидивов достигает 50% случаев (Г.А. Гинзбург и соавт.) [2].
Сонодинамическая терапия с помощью локального ультразвука средней интенсивности в сочетании с химиотерапией и/или соносенсибилизатором позволяет увеличить биодоступность лечебных препаратов к опухоли, усилить повреждающее действие на опухоль (Андронова Н.В. и соавт.) [1]; Kim H.J. et al. [10]. Однако еще не доказаны механизмы взаимодействия с клеточными структурами цитостатиков, введенных в ткани с помощью ультразвукового воздействия.
Изучение электрической неоднородности клеточной взвеси, обусловленной различной величиной мембранных потенциалов живых клеток, способствует пониманию взаимодействия этих клеток с разными ионами (например, цитостатиками, антибиотиками), а также оценке влияния и действия на клетки электромагнитных полей и радиации. Высокие потенциальные возможности использования потенциалозависимых флуорохромов АНС и ДСМ были доказаны в работах О.В. Тарнопольской (2012) [6-8]; Г.К. Максимова (2012) [3], Е.М. Непомнящей (2012) [4], А.И. Шихляровой (2013) [9].
Цель. Изучить изменения, происходящие в опухолевых клетках больных (ПРСПР) при химиолучевом лечении с использованием локальной УЗ-химиотерапии.
Материалы и методы. Изучали опухолевые клетки биоптатов 11 больных 3-4 стадии ПРСПР, получавших расщепленным курсом ДГТ в режиме ускоренного фракционирования (1,2+1,2 Гр с интервалом 5 часов) и локальную химиотерапию цисплатином, проводимую в интервале между отдельными фракциями разовой дозы с использованием УЗ-воздействия (патент № 2488412 от 03.02.2012) [5]. Исследовали биопсийный материал до лечения и после очаговой дозы 40 Гр и суммарной дозы цитостатика 45 мг.
Из биоптата ПРСПР, не более 30 мин после удаления, размером 3×4 мм, получали клеточную взвесь путем измельчения скальпелем на стекле в 100 мкл забуференного физраствора. Концентрация клеток в ней составляла 5±3×104 клеток. Каждую клеточную взвесь от одного больного делили на три части. Одну часть витально окрашивали флуорохромом АНС, вторую - ДР, третью - ДСМ. Флуоресцентный зонд-катион ДСМ использовали в конечной концентрации 20 мкМ, АНС – 40 мкМ, ДР – 50 мкМ. Препараты живых клеток после 10-20 минутной инкубации с флуорохромами при температуре 22-25 °С под покровным стеклом исследовали под микроскопом Axio Imager M2, Zeiss. Захват изображения (модуль MosaiX) производили цветной цифровой камерой AxioCam HRc, а интерактивные измерения проводили с помощью программного обеспечения AxioVision, rel.4.8., измеряя в среднем до 100 клеток опухоли в каждой пробе и все попавшие при этом в поле зрения лейкоциты, в основном сегментоядерные нейтрофилы и лимфоциты. Флуорохром ДСМ был синтезирован в НИИ физической и органической химии при ЮФУ. АНС был поставлен фирмой Serva. Длина волны возбуждения и ДСМ, и ДР составляла 480 нм, а волны эмиссии - 520 нм. Для АНС эти параметры – 375 и 480 нм. При микросъемке строго соблюдали одинаковое разрешение и экспозицию для каждого флуорохрома в сравниваемых пробах для обеих групп (до и после лечения). Данные измерений клеток сохраняли в приложении AxioVision, rel.4.8 в файле, совместимом с Excel (Microsoft Office-2003), которые затем сводили в общие электронные таблицы и статистически обрабатывали с помощью Statistika 6.0. Клетки опухоли измеряли одним инструментом – «Outline», а лейкоциты – другим: «Circle Out-In», массив показателей сортировали по инструменту измерения, и тем самым отделяли показатели клеток опухоли от лейкоцитов. Яркость клеток суммировали по трем каналам (RGB). Для оценки различий (р-уровень) применяли как параметрические показатели (среднее и стандартное отклонение, t-test Стьюдента), так и непараметрические – критерий Вилкоксона.
Результаты. Флуорохром-анион АНС окрашивает живые клетки голубым свечением, концентрируется на мембране, не проникает в ядро, поскольку мембрана ядра заряжена отрицательно и в силу этого не пропускает анион АНС. Если в данной окраске ядро прокрашено и светит ярче цитоплазмы, то эта клетка мертвая [9]. На рис. 1 (А, Б, В, Г, Д) показаны поля зрения клеточной взвеси ПРСПР, окрашенные АНС. На рис. 2 и 3 живые клетки в окраске ДСМ и ДР, соответственно. Флуорохромы-катионы легко проникают в ядра клеток, делая ядро зачастую ярче цитоплазмы.
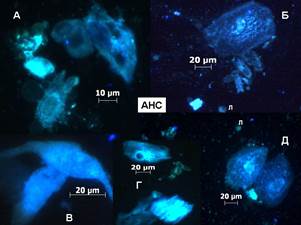
Рис. 1 (А, Б, В, Г, Д). Поля зрения препарата клеточной взвеси плоскоклеточного рака полости рта человека, окраска АНС. Имеет место клеточный и ядерный полиморфизм. Видим неоднородность по яркости флуоресценции АНС, связанного с клетками. Л – лейкоциты (клетки биоптата больных до лечения).
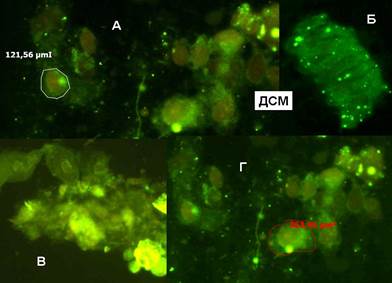
Рис. 2 (А, Б, В, Г). Поля зрения препарата клеточной взвеси ПРСПР, флуорохром ДСМ. После лечения. В данном случае ядра плохо прокрашены по сравнению с оранжевыми ядрами клеток аденокарциномы предстательной железы [6].
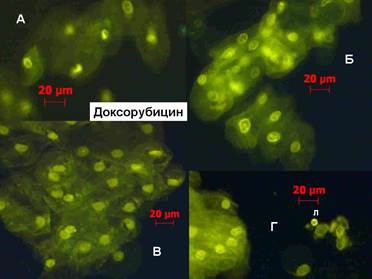
Рис. 3 (А, Б, В, Г). Поля зрения препарата клеточной взвеси ПРСПР, флуорохром доксорубицин. Больные после лечения. Л – лейкоциты. Ядра клеток интенсивно набрали доксорубицин.
В таблице 1 представлены полученные цитометрические результаты для группы 1 – «До лечения», а в таблице 2 - для группы 2 «После лечения», окраска ДСМ. Измеряли размеры клеток и яркость флуоресценции. Такие же таблицы были созданы для флуорохромов АНС и ДР. В таблицу 3 сведены данные по средним для групп значениям цитометрических показателей для трех флуорохромов; представлен уровень статистической значимости различий между группами «р», рассчитанный по критерию Стьюдента (параметрический) и по критерию Вилкоксона (непараметрический).
Таблица 1. Цитометрические показатели клеток опухоли ПРСПР больных ДО лечения. Флуорохром ДСМ.
|
Группа 1, больные до лечения (n=11) |
||||||
|
Номер больного |
Клетки опухоли |
Лейкоциты в опухоли |
||||
|
N |
S± ст. откл. (мкр кв.) |
Br ± ст. откл. (отн. ед.) |
Nlе |
Dle± ст. откл. |
Brle ± ст. откл. |
|
|
1 |
116 |
199±119 |
39±7 |
58 |
8,6±1,8 |
73±36 |
|
2 |
82 |
134±62 |
42±7 |
77 |
8,6±1,1 |
45±7 |
|
3 |
118 |
232±126 |
86±36 |
61 |
9,2±2,9 |
82±35 |
|
4 |
60 |
156±73 |
21±6 |
29 |
8,5±1,4 |
24±9 |
|
5 |
70 |
363±216 |
52±2 |
88 |
8,1±1,2 |
18±2 |
|
6 |
96 |
412±242 |
45±11 |
65 |
9,8±1,3 |
57±30 |
|
7 |
97 |
212±90 |
25±12 |
66 |
8,8±1,4 |
27±10 |
|
8 |
98 |
302±104 |
42±10 |
67 |
8,6±1,5 |
50±22 |
|
9 |
99 |
286±145 |
12±4 |
68 |
9,0±1,6 |
22±13 |
|
10 |
75 |
187±140 |
32±15 |
42 |
9,1±1,5 |
28±14 |
|
11 |
85 |
296±147 |
44±16 |
24 |
8,0±1,8 |
42±15 |
|
СРЕДНЕЕ → |
253±87 |
40±19 |
|
8,8±0,5 |
42±22 |
|
Таблица 2. Цитометрические показатели клеток опухоли ПРСПР больных ПОСЛЕ лечения. Флуорохром ДСМ.
|
Номер больного |
Клетки опухоли |
Лейкоциты в опухоли |
||||
|
N |
S (мкр кв.) |
Br (отн. ед.) |
Nlе |
Dle± ст. откл. |
Brle (отн. ед.) |
|
|
1 |
131 |
214±91 |
40±16 |
33 |
8,7±1,7 |
23±5 |
|
2 |
50 |
156±73 |
21±6 |
29 |
8,5±1,4 |
24±9 |
|
3 |
60 |
363±216 |
12±2 |
40 |
8,1±1,2 |
14±2 |
|
4 |
96 |
402±142 |
25±11 |
15 |
9,8±1,3 |
35±10 |
|
5 |
48 |
452±400 |
20±12 |
45 |
9,3±1,3 |
15±4 |
|
6 |
94 |
144±69 |
27±4 |
26 |
7,2±0,9 |
37±7 |
|
7 |
95 |
194±70 |
15±5 |
27 |
7,2±1,0 |
20±9 |
|
8 |
96 |
294±71 |
35±9 |
19 |
9,2±1,1 |
29±10 |
|
9 |
97 |
280±72 |
24±12 |
27 |
8,2±1,2 |
23±6 |
|
СРЕДНЕЕ → |
277±110 |
24±9 |
|
8,5±0,9 |
24±8 |
|
Таблица 3. Сравнение средних цитометрических показателей клеток опухоли плоскоклеточного рака слизистой полости рта (ПРСПР) и лейкоцитов, населяющих эту опухоль. Уровни статистического различия между ними.
|
Флуорохром |
Цитометрический показатель |
Больные ДО ЛЕЧЕНИЯ |
Больные ПОСЛЕ ЛЕЧЕНИЯ |
р-уровень (Т-Тест Стьюдента) |
р-уровень (Wilcoxon-test), |
|
|
ДСМ |
(S), мкр кв. |
253±87 |
277±110 |
р=0,577 |
р=0,441 |
|
|
Яркость (Br), отн. ед. |
40±19 |
24±9 |
р=0,038 |
р=0,086 |
||
|
(D le), мкр |
8,8±0,5 |
8,5±0,9 |
р=0,380 |
р=0,554 |
||
|
Яркость (Brle), отн. ед. |
42±22 |
24±8 |
р=0,030 |
р=0,038 |
||
|
АНС |
(S), мкр кв. |
227±61 |
210±44 |
р=0,499 |
р=0,953 |
|
|
Яркость (Br), отн. ед. |
71±28 |
61±10 |
р=0,349 |
р=0,678 |
||
|
(D le), мкр |
8,6±1,1 |
7,7±0,5 |
р=0,037 |
р=0,0,21 |
||
|
Яркость (Brle), отн. ед. |
37±10 |
44±10 |
р=0,164 |
р=0,173 |
||
|
ДР |
(S), мкр кв. |
248±83 |
292±106 |
р=0,308 |
р=0,374 |
|
|
Яркость (Br), отн. ед. |
31±8 |
30±10 |
р=0,855 |
р=0,859 |
||
|
(D le), мкр |
8,7±0,5 |
8,8±0,7 |
р=0,629 |
р=0,753 |
||
|
Яркость (Brle), отн. ед. |
36±13 |
30±12 |
р=0,255 |
р=0,441 |
||
Обозначения в таблицах: S - средняя площадь клеток; Dle - средний диаметр лейкоцитов; Br - средняя яркость клеток; N - число измеренных клеток; ст. откл. - стандартное отклонение; мкр кв. - микрон квадратный; отн. ед. - относительные единицы. На рис. 4 представлены графики средних значений измеренных показателей (Mean) и стандарнтой ошибки среднего (±SE) для клеток, окрашенных АНС и ДСМ.
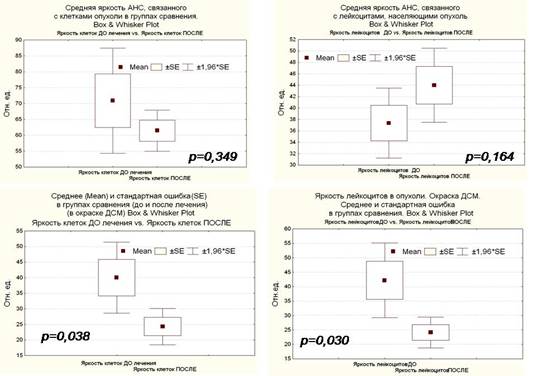
Рис. 4. Разброс флуориметрических показателей клеток ПРСПР у больных до и после лечения.
Обсуждение. Визуализация клеточной взвеси ПРСПР, окрашенной витальными флуорохромами, показывает четкую картину неоднородности по яркости клеток опухоли и лейкоцитов, так же как на других типах опухолевых клеток, о чем сообщалось в работах [3; 4]. Об этом свидетельствуют представленные здесь таблицы и рис. 4. Нами были обнаружены различия в выбранных флуориметрических показателях между группами до и после лечения. Это достоверная разница в средней яркости флуоресценции ДСМ, которая в группе больных после лечения снижена в 1,7 раза (р=0,038). Яркость флуоресценции АНС, связанного с опухолевыми клетками, также несколько снижена у больных после лечения, но не достоверно. На основании исследования, представленного в работе [8], можно объяснить происхождение такого различия. Все больные второй группы получали цисплатин при химиотерапии, а вывод в работе [8] свидетельствует о конкуренции в ядре клеток между ДСМ и цисплатином. Цисплатин занимает места связывания в ядре и не позволяет связаться там молекулам ДСМ, а без этой связи флуоресценции ДСМ не происходит. Отсюда и пониженная яркость целых клеток, и сниженная яркость ДСМ в ядрах этих клеток, например на рис. 2 (Б). Остальные показатели на данном числе испытаний не представили значимой разницы. Можем отметить следующие различия в клеточных картинах ПРСПР в группах до и после лечения: во-первых, до лечения имеет место обилие флоры, расположенной на плоских клетках, да и самой взвеси (рис. 1). После лечения флоры практически нет; во-вторых, имеет место значительное преобладание плоских клеток у больных после лечения, рис. 3.
Выводы. Полученные данные свидетельствуют о том, что снижение яркости флуоресценции ДСМ, связанного с опухолевыми клетками, может быть критерием наличия в клеточной взвеси цисплатина.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.



