Введение
Синтез и репарация ДНК, так же как и метилирование ДНК, являются важнейшими процессами в ходе гаметогенеза, оплодотворения и беременности [3]. Ключевыми событиями в ходе раннего эмбриогенеза являются активация эмбрионального генома, т.е. переход с материнского паттерна экспрессии генов, установившегося в ооцитах, к профилю экспрессии генов собственно эмбриона, формирование бластоцисты и успешная имплантация [1]. Для последней необходимы как полноценная подготовка рецептивного эндометрия, так и поддержание жизнеспособности эмбриона. В период раннего эмбриогенеза, уровень экспрессии генов различается в тканях матери и плода и зависит от конкретного этапа развития зародыша [2]. На ранних стадиях развития эмбриона наблюдается очень небольшой уровень синтеза мРНК. Эти ранние стадии развития контролируются продуктами оогенеза и материнским геномом, что говорит о преимущественной зависимости раннего эмбриогенеза от того, что экспрессируется материнским геномом.
Исследование уровней экспрессии генов системы репарации и контроля клеточного цикла в ооцитах и предимплатационных эмбрионах на всех стадиях развития выявило их ключевую роль в нормальном эмбриональном развитии. На настоящий момент аллельный полиморфизм генов системы репарации и контроля клеточного цикла подробно рассмотрен при изучении этиологии и патогенеза различных раковых заболеваний. В то же время вовлеченность аллельных вариантов данных генов в развитие патологии беременности практически не исследована. Однако в течение первого триместра беременности происходит активное деление как фетальных, так и материнских клеток, при этом неизбежно возникновение ошибок, которые в норме исправляются системой контроля повреждений ДНК (DDR – dna damage response). Очевидно, что наличие аллельных вариантов генов системы репарации и контроля клеточного цикла посредством снижения функциональной активности BER/NER-репарационных белков и специфических протеинкиназ может внести немалый вклад в развитие патологии беременности вследствие несрабатывания механизма корректировки повреждений ДНК, появления геномной нестабильности и запуска апоптоза в материнских и фетальных клетках. В результате происходит недостаточная децидуализация стромы эндометрия, способствующая неполной или слабой инвазии цитотрофобласта, что подавляет нормальные гестационные изменения в маточно-плацентарных артериях и приводит к снижению кровотока в них. Любые изменения интенсивности экспрессии генов и выполняемых ими функций приведут к нарушению процессов эмбриогенеза и возникновению патологии беременности [5]. Целью данной работы было исследовать уровень экспрессии генов системы репарации и контроля клеточного цикла при невынашивании беременности.
Материал и методы исследования
Для молекулярно-генетического исследования использовали образцы децидуальной и хорионической тканей, полученные при медицинском аборте у женщин с физиологическим течением беременности на сроке 6-10 недель (12 образцов), а также при невынашивании беременности (10 образцов) раннего срока. У женщин, включенных в исследуемые группы, были исключены анатомические и гормональные аномалии. Все женщины подписали информированное согласие об участии в исследовании.
Выделение тотальной РНК из образцов тканей материнского и зародышевого происхождения проводили экстракцией смесью гуанидинтиоционат-фенол-хлороформ. Реакцию обратной транскрипции проводили при температуре 45° С в течение 50 минут. Затем следовала инактивация MMLV-RT при 92° С в течение 8 минут. Уровень экспрессии генов APEX1 (MIM*107748), XPD (MIM*126340), СНЕК2 (MIM*604373), P53 (MIM*191170) в децидуальной и хорионической тканях при физиологически протекающей беременности и при невынашивании беременности первого триместра определяли с помощью real-time PCR с использованием флуоресцентных ген-специфичных зондов. Подбор праймеров и зондов к мРНК исследуемых генов проводили с помощью программы Primer3 (http://frodo.wi.mit.edu/primer3/), которые в дальнейшем были синтезированы фирмой Синтол (Москва) (табл. 1). Реакцию амплификации проводили в двух повторах для каждого образца по следующей программе: 94° С – 10 минут, 60° С – 50 секунд, 94° С – 15 секунд. Последние два шага повторяли 40 раз.
Таблица 1 – Характеристика праймеров и зондов, используемых для определения уровня экспрессии генов цитокинов
|
Ген |
5-3` последовательность праймеров и зонда |
|
GAPDH |
AGGTCGGAGTCAACGGATTT ATCGCCCCACTTGATTTTGG Fam-GGCGCCTGGTCACCAGGGCT-BHQ1 |
|
АРЕХ1 |
AAAGTTTCTTACGGCATAGGCGAT CTGTTACCAGCACAAACGAGTCA Fam-ATCACCCGGCCTTCCTGATCATGCTCC-ВHQ1 |
|
P53 |
GCCCTCAACAAGATGTTTTGCCAACT CAACCTCCGTCATGTGCTGTGACTG Fam-TTGATTCCACACCCCCGCCCGGCACC-BHQ1 |
|
XPD |
CGAGGCCCACAACATTGACAAC TCTTTGATCCTGAGCACCGTCT Fam-AACCTCACCCGCCGGACCCTTGACC-BHQ1 |
|
CHEK2 |
AGCCCAGCCTTCTACTAGTCGAAA GTTCAAACCACGGAGTTCACAACACA Fam-TCGGCACCCTCGGCTTCCCCTTCACGG-BHQ1 |
Статистический анализ результатов исследования уровня экспрессии генов, проводили методом 2-∆∆Ct. Для сравнения уровня экспрессии генов использовали все значения экспрессии гена (∆Ct) и сравнивали их между собой как две выборки. Для подтверждения достоверности отличий экспрессии гена в совокупности одной из выборок образцов по сравнению с другой выборкой использовали критерий Стьюдента.
Результаты исследования и их обсуждение
В целом, в норме в клетках децидуальной ткани уровень экспрессии АРЕХ1 выше по сравнению с соответствующими образцами хорионической ткани (Р = 0,013) (рис. 1А). При нарушении ранних этапов эмбриогенеза активность транскрипции гена АРЕХ1 в клетках хорионической ткани приблизительно на одном уровне с децидуальной. В целом, уровень экспрессии данного гена в тканях материнского и зародышевого происхождения при патологии беременности не отличается от такового для физиологически протекающей беременности (рис. 1Б).
А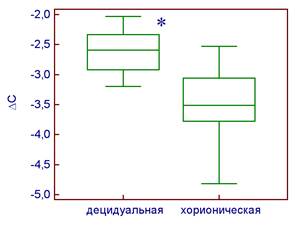 Б
Б 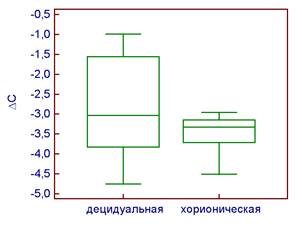
Рис. 1. Уровень экспрессии гена АРЕХ1 в клетках хорионической и децидуальной тканей относительно экспрессии гена GAPDH при физиологически протекающей беременности (А) и невынашивании беременности (Б).
Уровень экспрессии гена XPD в децидуальной ткани при физиологически протекающей беременности в среднем в 2,5 раза (Р = 0,0001) превосходит данный показатель в хорионической ткани (рис. 2А). При невынашивании беременности – в 1,5 раза (Р = 0,003) (рис. 2Б). Экспрессия данного гена в децидуальной ткани при невынашивании беременности выше по сравнению с физиологически протекающей беременности (Р = 0,003). В хорионической ткани уровень мРНК XPD одинаков при обоих вариантах течения беременности.
А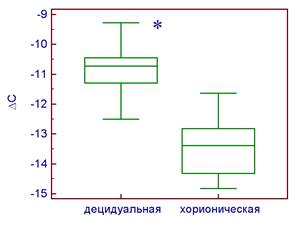 Б
Б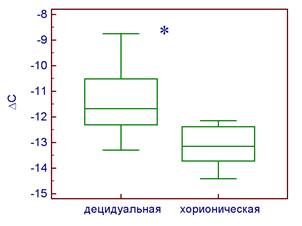
Рис. 2. Уровень экспрессии гена XPD в клетках хорионической и децидуальной тканей относительно экспрессии гена GAPDH при физиологически протекающей беременности (А) и невынашивании беременности (Б).
В целом, в норме в клетках децидуальной ткани уровень экспрессии CHEK2 выше, по сравнению с соответствующими образцами хорионической ткани (Р = 0,0001) (рис. 3А). При невынашивании беременности в клетках децидуальной ткани уровень экспрессии CHEK2 выше по сравнению с соответствующими образцами хорионической ткани (P = 0,039) (рис. 3Б).
А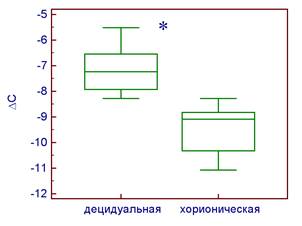 Б
Б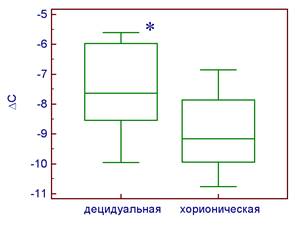
Рис. 3. Уровень экспрессии гена CHEK2 в клетках хорионической и децидуальной тканей относительно экспрессии гена GAPDH при физиологически протекающей беременности (А) и невынашивании беременности (Б).
Уровень экспрессии гена р53 выше в децидуальной ткани по сравнению с хорионической при физиологическом (Р = 0,0001) течении беременности (рис. 4А). При невынашивании беременности различий в уровне экспрессии гена р53 между двумя типами тканей не выявлено (P = 0,19) (рис. 4Б).
А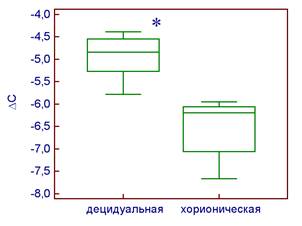 Б
Б 
Рис. 4. Уровень экспрессии гена р53 в клетках хорионической и децидуальной тканей относительно экспрессии гена GAPDH при физиологически протекающей беременности (А) и невынашивании беременности (Б).
В целом, уровень экспрессии всех исследованных нами генов репарации (эндонуклеазы и хеликазы) в тканях материнского происхождения выше (P = 0,01), чем в хорионической. Возможно, это связано с тем, что при децидуализации эндометрия запускается эндоредупликация, во время которой подавляются механизмы АТМ-CHEK2-P53 опосредованного апоптоза за счет сайленсинга промоторов проапоптотических генов. Показано, что гиперэкспрессия р53 не индуцирует запуск апоптоза в эндоредуплицирующихся клетках, в отличие от клеток с обычным митотическим циклом. Кроме того, клетки в состоянии эндоциклического деления не вступают в апоптоз за счет измененного чекпоинт ответа на генотоксический стресс [7].
По данным литературы известно, что в ответ на повреждения ДНК CHEK2 фосфорилирует p53, который в свою очередь активирует р21, который запускает р53 – опосредованную остановку клеточного цикла в G1-фазе. Кроме того, было показано, что р53 подавляет экспрессию АРЕХ1, обеспечивая тем самым дополнительный р53 – опосредованный путь индукции апоптоза в ответ на повреждения ДНК [8]. APEX1 в свою очередь может выполнять роль как ко-активатора, так и ко-репрессора гена р21, в зависимости от р53 статуса. Вероятно, что репрессия АРЕХ1 и гиперэкспрессия р53 способны стимулировать эндоредупликацию клеток трофобласта и децидуа за счет активации ингибитора циклин-зависимых киназ р21 [8].
Процесс образования специализированных клеток децидуа – ключевой для развития беременности. В начале децидуализации стромальные клетки, непосредственно окружающие имплантируемую бластоцисту, активно делятся. Клеточный цикл осуществляется за счет работы циклин-зависимых киназ. Во время деления клеток эндометрия белок p21 подавляет работу комплекса циклина D и киназы cdk4, что приводит к образованию эндоцикла (удвоению хромосом без деления). В результате эндоредупликации получаются гигантские полиплоидные клетки децидуа (до 64n) [5].
Изменение уровня экспрессии генов АТМ – CHEK2 сигнального пути (CHEK2) приводит к изменению функциональной активности генов системы репарации (APEX1, XPD), контроля клеточного цикла и апоптоза (р53). Р53 в свою очередь индуцирует экспрессию генов, регулирующих имплантацию и плацентацию регулятор LIF и белок р21, запускающий процесс эндоредупликации в эндометрии, а также ХГЧ, участвующий в плацентации посредством стимуляции роста сосудов [6].
Полученные результаты можно объяснить тем, что в процессе эндоредупликации децидуальных клеток подавляется р53– опосредованный путь апоптоза. Кроме того, в клетках трофобласта, дифференцирующихся в эндоредуплицирующиеся клетки, индукция р21 приводит к подавлению Cdk1 и к подавлению работы чекпоинт пунктов и возникновению толерантности к повреждениям ДНК [5]. Исследование уровней экспрессии генов системы репарации и контроля клеточного цикла в ооцитах и предымплатационных эмбрионах на всех стадиях развития выявило их ключевую роль в нормальном эмбриональном развитии. Изменение экспрессии генов, участвующих в чекпоинтах и запуске апоптоза, оказывает влияние на жизнеспособность эмбриона.
Работа выполнена при финансовой поддержке РФФИ, проект № 12-04-31408.
Рецензенты:
Амелина С.С., д.м.н., заведующая отделом биомедицины НИИ биологии Южного федерального университета, г. Ростов-на-Дону.
Усатов А.В., д.б.н., профессор, заведующий отделом изменчивости генома НИИ биологии Южного федерального университета, г. Ростов-на-Дону.



