Введение
Галогенсодержащие комплексные соединения никеля с органическими лигандами применяются в различных областях химической промышленности. Например, одной из областей их применения является модификация полимеров с целью создания материалов с заданными свойствами, в частности являются эффективными светостабилизаторами различных полимеров [5].
Методы получения комплексных соединений никеля с органическими лигандами основаны на многостадийном синтезе или на окислительном растворении никеля в органических средах, содержащих такие экологически опасные соединения, как свободные галогены или тетрахлорид углерода [2], поэтому существует необходимость их замены в различных химических процессах.
В настоящей работе исследовался механизм окислительного растворения никеля в системе бензилбромид – диметилформамид (ДМФА) - кислород с целью создания экологически безопасной технологии получения комплексных соединений никеля с органическими лигандами, без участия тетрахлорида углерода и свободных галогенов.
Экспериментальная часть
Анализ продуктов реакции и количественное определение примесей в исходных соединениях методом ГЖХ (хроматограф «Цвет–800») и ионной хроматографии (хроматограф «Цвет 3006»), по методикам, представленным в работе [3], методом ИК- спектроскопии (IMPACT 400d фирмы Nicolet, США) в таблетках из KBr; методом ЭПР-спектроскопии (радиоспектрометр СЭ/Х-2543 фирмы Radiopan, Польша) по ранее описанным методикам [4; 8]. Органические продукты реакции выделяли с помощью препаративной жидкостной хроматографии на хроматографе «Цвет-304», снабженном УФ-детектором и стальной колонкой (l = 2,5 м, d = 4 мм); неподвижная фаза – Silasorb 600 (Chemapol, Чехия, размер частиц 15-25 мкм), элюент – смесь гексан : диэтиловый эфир 5:1. Спектры ЭПР реакционных смесей снимали на радиоспектрометре Radiopan СЭ/Х-2543 (частота 9400 МГц) при 77 К в пленках соконденсатов никеля и избытка бензилгалогенида по методике [8]. Анализ продуктов реакций методом хромато-масс-спектрометрии проводили на приборе фирмы Hewlett Packard (США) (масс-детектор НР-5972, хроматограф НР-5890) по описанной ранее методике [9]. Количественный анализ примесей в никеле проводили после растворения образцов металла в HNO3 и нейтрализации полученного раствора 25%-ным раствором аммиака методом атомно-абсорбционной спектрометрии на приборе GBC-908 АА (Австралия). Элементный анализ дейтерированных органических соединений проводили на газохроматографическом элементном анализаторе Carlo-Erba - 1100 фирмы Carlo Erba Instruments (Италия) и газовом хроматографе «Цвет-570» (Россия) по методике [4]. Измерение удельного вращения плоскости поляризованного света проводили на автоматическом поляриметре «ВНИЭКИпродмаш А-1 ЕПО» (Россия, σ = 0,01˚) в кюветах различной толщины.
Порошок никеля применяли ГОСТ 9722-79, содержание никеля 99,8405%±2×10-4% марки ПНЭ-1 «Люкс» (ФГУП «Уральский электрохимический комбинат», РФ). Никелевую проволоку (NI005106 Goodfellow Corporation, USA, Ni 99,9804%±2×10-4%) диаметром 0.025 мм и длиной 10 мм выдерживали в течение 5-10 секунд в 20%-ном растворе серной кислоты, промывали водой, ацетоном, а затем ДМФА. Все органические соединения были получены из коммерческих источников. Бензилбромид (Aldrich) сушили плавленым CaCl2 и перегоняли. Т. кип. 83,5-84 °С (32 мм рт. ст.), nD20 1.4380. ДМФА очищали двукратной медленной перегонкой в вакууме над большим количеством P2O5, дополнительно кипятили 2 часа над гидридом кальция и перегоняли в вакууме в токе азота. Бензилбромид и все растворители освобождали от растворенных газов путем многократного замораживания и размораживания при пониженном давлении и хранили в ампулах без доступа воздуха.
Получение комплексных соединений никеля проводили по следующим методикам. К 0,02 М порошка никеля прилили 20 мл ДМФА и 0,1 моль бензилбромида. Реакцию проводили в присутствии сухого воздуха при 70 °С. После растворения никеля реакционную смесь обработали 20 мл сухого диэтилового эфира. Выпавшие кристаллы комплексного соединения никеля (II) отделяли, промывали гексаном и сушили в вакууме. [Ni(ДМФА)6]Br2. Выход 86% (от теорет.) Найдено (%): C 32.98, H 6.37, Br 24.37, N 12.71, Ni 8.89, O 14.68.. Вычислено для C18H42Br2N6NiO6 (%): C 32.90, H 6.44, Br 24.32, N 12.79, Ni 8.93, O 14.62. Спектр ИК, ν(см-1): 425 (Ni-O), 465 (Ni-O), 690 (OCN), 1030 (СН3), 1070 (СН3), 1120 (СН3), 1160 (СН3), 1255 (С-N), 1387 (СН3), 1425 (СН3), 1445 (СН3), 1635 (C=O••Ni), 1650 (C=O••Ni) (KBr).
Исследование реакции в присутствии ловушки радикалов проводили аналогично методике получения комплексных соединений никеля. В качестве ловушки радикалов применяли дициклогексилдейтерофосфин (DCPD).
В отсутствии кислорода спектры ЭПР снимали при 77 К. Никель испаряли из корундового тигля при температуре 1670-1720 К при непрерывном вакуумировании 10-4 мм. рт. ст. и конденсировали на поверхность тонкостенной подвижной части реактора для ЭПР-спектроскопии, охлажденной жидким азотом до 77 К. Бензилбромид испаряли при 273-298 К и конденсировали на полупрозрачную блестящую пленку никеля при 77 К. Соотношение никель : бензилбромид составило 1 : 10. При осаждении избытка бензилбромида на полупрозрачную блестящую пленку никеля наблюдалось образование пленки красного цвета. В другом эксперименте полученную полупрозрачную блестящую пленку никеля обрабатывали кислородом. После получения компактной пленки никеля вакуумирование прекращали, реактор при 77 К заполняли кислородом, выдерживали при этой температуре 1 минуту и снова вакуумировали до 10-4 мм. рт. ст. На полученную пленку конденсировали избыток бензилбромида, также в соотношении 1 : 10. В этом случае образовывались пленки розового цвета, которые быстро обесцвечивались.
Исследование кинетики процессов взаимодействия никеля с бензилбромидом в ДМФА в присутствии кислорода проводили резистометрическим методом. Скорость вращения мешалки составляла 2500 об/мин. Начиная с 2000 об/мин скорость растворения никеля в изучаемых средах не зависела от скорости перемешивания, что указывало на кинетический режим исследования процесса.
Обсуждение результатов
Окислительное растворение никеля в системе бензилбромид – диметилформамид - кислород протекает по следующей схеме:
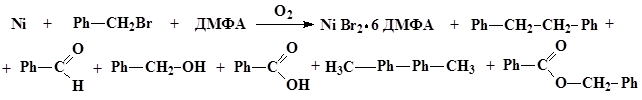
Анализ продуктов методом хромато-масс-спектрометрии показал наличие в продуктах реакции 1,2-дифенилэтана и следовых количеств 4,4'-дитолила, что позволяет предположить радикальную природу механизма реакции, через образование радикальной пары. Кроме того, были выделены бензальдегид и бензиловый спирт, что, вероятно, является результатом окисления бензильного радикала кислородом.
Методом ионной хроматографии было показано, что при окислительном растворении никеля в данной системе образуются соединения Ni (II).
Идентификацию радикальных интермедиатов в растворе проводили с помощью химической ловушки радикалов DCPD. Анализ продуктов реакции в присутствии DCPD свидетельствует о протекании процесса по механизму одноэлектронного переноса с образованием бензильного радикала [7]:
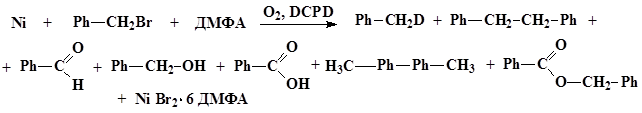
При проведение реакции в присутствии DCPD обнаружение a-дейтеротолуола может быть связано только с наличием в растворе бензильных радикалов [7]:

Для более достоверной идентификации бензильного радикала применяли метод электронного парамагнитного резонанса (ЭПР) при 77 К.
Производилось осаждение избытка бензилбромида на полупрозрачную блестящую пленку никеля в соотношении никель : бензилбромид 1 : 10, при этом наблюдалось образование пленки красного цвета, что характерно для комплексов с переносом заряда [10]:
По окончании конденсации снимали ЭПР. В спектре ЭПР был обнаружен триплет квартетов, который на основании литературных данных (таблица 1) был отнесен к сигналу бензильного радикала.
Таблица 1
Параметры спектров ЭПР бензильного радикала в твердых матрицах
|
g-фактор |
aHCH2, Гс |
aoH, Гс |
amH, Гс |
apH, Гс |
Примечание |
|
2,002±0,001 |
16,5±1,5 |
5,5±0,7 |
– |
5,5±0,7 |
получено в настоящей работе |
|
– |
16,4±0,8 |
5,5±0,5 |
– |
5,5±0,5 |
лит. данные [8] |
При повышении температуры интенсивность цвета пленок постепенно ослабевала. Сигнал ЭПР от бензильного радикала исчезал при 185 К. При дальнейшем повышении температуры пленка плавилась с образованием раствора, содержащего небольшое количество твердых включений желтого цвета. Анализ твердых включений методом ионной хроматографии показал, что они содержат катионы никеля (+2) и анионы галогена (-1), причем их соотношение соответствует формуле галогенида никеля (II).
Методом газовой хроматографии в расплавах пленок наряду с бензилбромидом обнаружено небольшое количество 1,2-дифенилэтана и следовые количества 4,4-дитолила. Полученные результаты свидетельствуют, что компактный никель реагирует с бензилбромидом по следующей схеме:
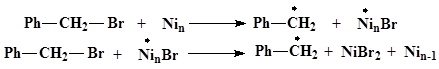
Для того чтобы выяснить влияние кислорода на реакцию, было проведено осаждение бензилбромида на предварительно обработанную кислородом пленку никеля при 77 К. В этом случае образовывались пленки розового цвета, которые быстро обесцвечивались, что объясняется быстрой реакцией комплексов никель-бензилбромид с комплексами кислород-никель на поверхности никеля. Спектр ЭПР бензильного радикала имел аналогичные параметры, но имел интенсивность в пять раза выше, чем в опыте при отсутствии кислорода, что свидетельствует о более быстром протекании процесса.
В результате протекания процесса наряду с галогенидами никеля (II), 1,2-дифенилэтаном и следами 4,4'-дитолила были обнаружены бензальдегид и бензиловый спирт, что свидетельствует об изменении схемы механизма реакции никеля с бензилбромидом в присутствии кислорода, адсорбированного на поверхности металла.
Определение кинетических параметров реакции проводили резистометрическим методом, который успешно применяется при исследовании быстрых гетерогенных процессов [6]. Реакцию проводили в инертном растворителе, в качестве которого был выбран бензол, что позволило получить зависимости скорости растворения металла как от концентрации бензилбромида, так и от концентрации ДМФА. Исследование кинетики проводили в широком интервале концентраций (0-7 моль×л-1) при 313-353 К.
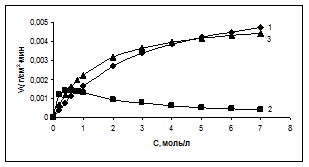
Рис. 1. Зависимости скорости реакции (w) системы Ni–PhCH2Br–ДМФА–О2 от исходных концентраций компонентов смеси при 353К: 1. СДМФА = 2 моль/л-1; СRBr изменяли от 0 до 7,0 моль×л-1; 2. СRBr = 0,5 моль×л-1; СДМФА изменяли от 0 до 7,0 моль×л-1; 3. СДМФА = 0,5 моль×л-1; СRBr изменяли от 0 до 7,0 моль×л-1.
Зависимости скорости реакции никеля с системой бензилбромид – ДМФА- кислород от концентрации бензилгалогенида, представленные на рис. 1 (кривые 1, 3), носят плавный характер, и при увеличении концентрации ДМФА от 0,5 до 2 моль×л-1 вид кривых не изменяется, а на зависимости скорости реакции от концентрации ДМФА (рис. 1, кривая 2) наблюдается максимум, т.е. имеют вид, характерный для реакций, протекающих по механизму Лэнгмюра – Хиншельвуда при адсорбции бензилбромида и ДМФА на одинаковые центры поверхности металла [1]:
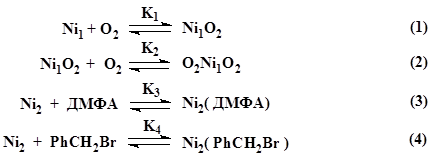
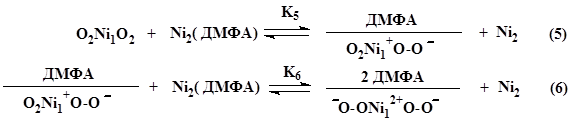
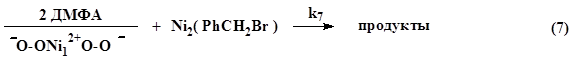
где Ni1, Ni2 – активные центры поверхности никеля, на которые осуществляется адсорбция кислорода, бензилбромида и ДМФА; K1, K2, K3, K4 - константы равновесия адсорбции кислорода, ДМФА и бензилбромида на поверхности металла; K5, K6 – константы равновесия переноса электрона на кислород; k7 – константа скорости лимитирующей стадии.
Выражение для скорости реакции имеет вид:
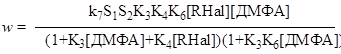
где S1, S2 - площади поверхности активных центров Ni1 и Ni2.
Линеаризация кинетических кривых на основе уравнения для скорости реакции позволяет определить константы равновесия K4, K6 и константу скорости процесса k7', равную k7S1S2 при различных температурах. А затем находим энтальпии адсорбции бензилбромида и стадии переноса второго электрона на кислород на поверхности никеля, а также энергию активации Еа химического процесса.
Однако K6 и K4 невозможно определить независимо от K3, которую можно получить при исследовании кинетики реакции никеля с бензилбромидом в диметилформамиде в отсутствии кислорода [3] (таблица 2).
Таблица 2.
Кинетические параметры процесса окислительного растворения никеля в системе бензилбромид – ДМФА в отсутствии кислорода [3]
|
Параметр |
k·102, г×см-2×мин-1 |
K3, л×моль-1 |
K4, л×моль-1 |
|
|
Т, К |
313 |
0,0223±0,0001 |
3,08±0,01 |
3,13±0,02 |
|
323 |
0,0439±0,0001 |
2,44±0,01 |
2,38±0,01 |
|
|
333 |
0,0821±0,0002 |
1,99±0,01 |
1,93±0,01 |
|
|
338 |
0,107±0,001 |
1,77±0,01 |
1,71±0,01 |
|
|
343 |
0,158±0,001 |
1,65±0,01 |
1,51±0,01 |
|
|
353 |
0,277±0,002 |
1,33±0,01 |
1,21±0,01 |
|
|
ΔEa, кДж/моль |
57,8 ± 2,5 |
|
|
|
|
ΔНо, кДж/моль |
-19,1 ± 0,7 |
-21,5 ± 1,0 |
||
|
ΔSо, Дж/моль·K (при 298 К) |
-51,7 ± 2,3 |
-59,2 ± 3,4 |
||
где k – константа скорости химического процесса.
В результате исследования реакции дегалогенирования бензилбромида никелем в ДМФА в присутствии кислорода были получены кинетические и термодинамические параметры, представленные в таблице 3.
Таблица 3.
Кинетические параметры процесса окислительного растворения никеля в системе бензилбромид – ДМФА в присутствии кислорода
|
Параметр |
k7`·102, г×см-2×мин-1 |
K4, л×моль-1 |
K6, л×моль-1 |
|
|
Т, К |
313 |
0,137±0,001 |
3,12±0,02 |
10,1±0,1 |
|
323 |
0,210±0,001 |
2,39±0,01 |
7,28±0,05 |
|
|
333 |
0,335±0,002 |
1,93±0,01 |
5,98±0,04 |
|
|
338 |
0,406±0,003 |
1,72±0,01 |
5,10±0,03 |
|
|
343 |
0,506±0,003 |
1,51±0,01 |
4,69±0,02 |
|
|
353 |
0,746±0,004 |
1,21±0,01 |
3,76±0,02 |
|
|
ΔEa, кДж/моль |
39,2 ± 1,2 |
|
|
|
|
ΔНо, кДж/моль |
-21,6 ± 1,0 |
-22,3 ± 1,8 |
||
|
*ΔSо, Дж/моль·K (при 298 К) |
-59,4 ± 2,7 |
-52,2 ± 4,0 |
||
Анализ полученных данных показывает, что энтальпии адсорбции бензилбромида и ДМФА на поверхности никеля имеют близкие значения. Это подтверждает наше предположение, что адсорбция реагента и растворителя осуществляется на одинаковые активные центры поверхности никеля. Энтальпия и энтропия адсорбции бензилбромида и ДМФА на поверхности никеля являются сильно отрицательными, т.е. при адсорбции их диссоциации на поверхности никеля не происходит.
Константы, энтальпия и энтропия адсорбции бензилбромида на поверхности никеля для кислородного и без кислородного процессов равны с точностью до ошибки. Это означает, что адсорбция реагента на поверхности никеля осуществляется независимо от других компонентов смеси.
В бескислородном и кислородном процессах К4 получается одинаковой с точностью до ошибки. Это позволяет утверждать, что был правильно выбран метод исследования кинетики этих процессов, верно предложены механизмы окислительного растворения никеля в системе бензилбромид - ДМФА в присутствии кислорода, а также правильно проведена обработка полученных результатов.
Заключение
Подробный анализ полученных результатов показывает, что первыми стадиями реакции никеля с бензилбромидом в ДМФА в присутствии кислорода являются:
1. Адсорбция кислорода на поверхности никеля:
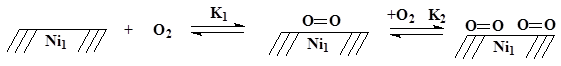
2. Перенос электрона с поверхности никеля на кислород. Одновременно происходит взаимодействие с ДМФА и стабилизация образующихся бескислородных анионов, за счет рассредоточения образующегося положительного заряда по целой группе атомов никеля и координация диметилформамида на Ni2+. Взаимодействие адсорбата с растворителем может происходить по механизму Ленгмюра-Хиншельвуда или по механизму Или-Ридила.
По механизму Ленгмюра-Хиншельвуда происходит взаимодействие адсорбата с диметилформамидом, адсорбированным на поверхности никеля:
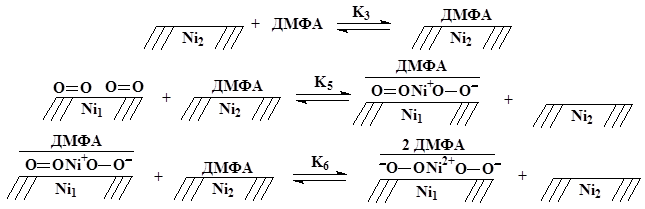
По механизму Или-Ридила происходит взаимодействие адсорбата с диметилформамидом при его подходе из раствора:
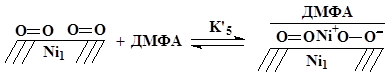
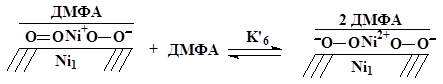
Различить эти механизмы не представляется возможным.
3. Перенос электрона с бескислородного аниона на бензилбромид. Взаимодействие адсорбированного бензилбромида с бескислородным анионом осуществляется по механизму одноэлектронного переноса с образованием бензильного радикала, кислородного аниона и кислорода. Адсорбция бензилбромида и ДМФА осуществляется на одинаковые активные центры поверхности металла:
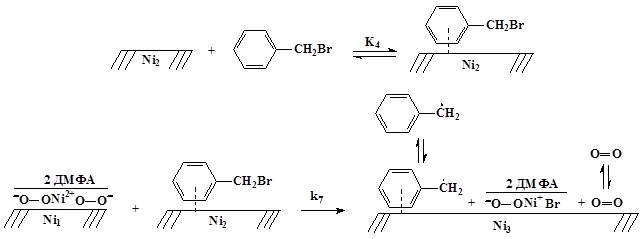
4. Перенос второго электрона с супероксидного аниона на вторую молекулу бензилбромида осуществляется с образованием бензильного радикала, т.к. образование ион-радикальных пар энергетически менее выгодно:
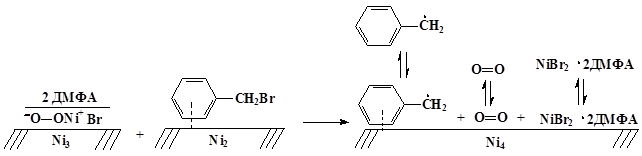
5. Рекомбинация и изомеризация бензильных радикалов осуществляется преимущественно в растворе в радикальной паре с образованием 1,2-дифенилэтана и следовых количеств 4,4`-дитолила:
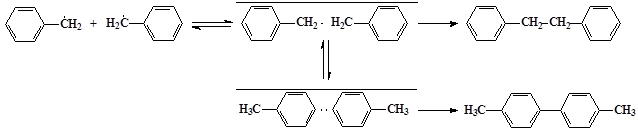
6. Окисление бензильных радикалов кислородом:
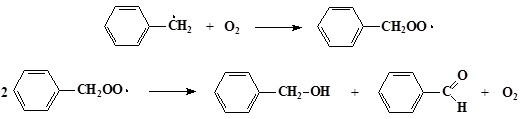
7. Образование комплексных соединений никеля (II):
![]()
где Ni1, Ni2, Ni3, Ni4 – активные центры поверхности никеля.
Рецензенты:
Вулах Е.Л., д.х.н., профессор, генеральный директор ООО «Фенил», г. Тула.
Левин Д.М., д.ф.-м.н., профессор, заведующий кафедрой физики ФГБОУ ВПО «Тульский государственный университет», г. Тула.



