Введение
Исследования последних десятилетий в области ишемических кардиальных катастроф подчеркивают важную роль эндотелия сосудов. Безусловно, что наряду с протекцией миокарда важное клиническое значение имеет защита клеток эндотелия, так как ишемия и последующая реперфузия приводят к эндотелиальной дисфункции [9] и определяют степень повреждения миокарда [10]. Особенно эта проблема актуальна для пожилых пациентов, поскольку с увеличением возраста наблюдается прогрессирование дисфункции эндотелия и повышение риска развития сердечно-сосудистых осложнений [7; 8]. Данные ряда исследовательских работ подтверждают тот факт, что состояние, характеризующееся нарушенной функцией эндотелия, обратимо [4]. В связи с этим поиск путей эндотелиопротекции продолжается. В ряде работ отмечается, что ишемическое прекондиционирование (ИП) способствует уменьшению дисфункции эндотелиальных клеток коронарных артерий [6]. Ишемическое прекондиционирование может рассматриваться как неспецифический ответ на различные виды сублетального стресса. С практической точки зрения предпочтение видится в использовании медикаментозных, фармакологических агентов прекондиционирования, так как это дает возможность контролировать их дозы, пролонгировать эффект, снижать развитие толерантности.
Никорандил - уникальный фармакологический препарат, обладающий свойствами открывать аденозинтрифосфатзависимые калиевые (КАТФ) каналы и активировать систему синтеза оксида азота (NO).
В механизм ишемического прекондиционирования вовлечено несколько ключевых медиаторов, включая аденозин, сублетальные активные формы кислорода (ROS) и NO. Никорандил открывает митохондриальные КАТФ-каналы не только прямым воздействием, но и опосредованно, через активацию пути NO – ц ГМФ-зависимой протеинкиназы .
В связи с этим целью нашего исследования является изучение механизмов реализации эндотелиопротекторных эффектов дистантного ишемического прекондиционирования и фармакологического прекондиционирования никорандилом при L-NAME-индуцированном дефиците оксида азота.
Материалы и методы
Моделирование L-NAME-индуцированной эндотелиальной дисфункции проводили на белых крысах-самцах линии Wistar массой 250-300 г. Все исследования проводили в одно и то же время суток во второй половине дня. N-нитро-L-аргинин метиловый эфир (L-NAME) вводили ежедневно один раз в сутки внутрибрюшинно в дозе 25 мг/кг в течение 7 дней.
Развитие эндотелиальной дисфункции (ЭД) оценивали путем проведения пробы на эндотелийзависимую вазодилатацию (ЭЗВД) в ответ на болюсное внутривенное введение раствора ацетилхолина в дозе 40 мкг/кг и эндотелийнезависимую вазодилатацию (ЭНВД) в ответ на болюсное введение раствора нитропруссида натрия в дозе 30 мкг/кг. Для объективной оценки развития нарушения функции эндотелия рассчитывали коэффициент эндотелиальной дисфункции (КЭД). Для этого определяли площади прямоугольных треугольников над кривыми восстановления микроциркуляции после проведения реакций ЭЗВД и ЭНВД. КЭД рассчитывался как отношение площади треугольника над кривой восстановления микроциркуляции в ответ на введение нитропруссида к площади треугольника над кривой восстановления микроциркуляции в ответ на введение ацетилхолина [5].
Биохимическими маркерами эндотелиальной дисфункции служили Total NO (NOx). Нами использована модификация метода определения стабильных метаболитов NO. Принцип метода заключается в одновременном восстановлении нитратов в нитриты в присутствии хлористого ванадия и реакции диазотирования с последующим развитием окраски.
Для морфологического подтверждения развития моделируемых патологических процессов кусочки органов фиксировали в 10%-ном нейтральном формалине и заливали в парафин по общепринятым методикам (Меркулов Г.А., 1969). В почках обращали внимание на состояние капилляров клубочков, толщину стенок артерий и артериол и их эндотелия. В сердце изучали общее состояние эндокарда и перикарда, кардиомиоцитов и стромы, оценивали состояние сосудов миокарда и их эндотелия.
Дистантное ишемическое прекондиционирование создавали по ранее апробированной и обоснованной методике наложением эластичного жгута на верхнюю треть контрлатерального (правого) бедра на 10 минут с последующей 20-минутной реперфузией непосредственно перед моделированием патологии. Контролем эффективности пережатия служило исчезновение пульсации на артериях стопы и появление цианоза ее кожи в первые секунды после наложения жгута.
Никорандил вводили в дозе 2 мг/кг в виде раствора внутрижелудочно через зонд 2 раза в сутки в течение 7 дней непосредственно перед введением L-NAME.
Для изучения участия АТФ-зависимых калиевых каналов и индуцибельной NO- синтазы в реализации эндотелиопротекторных эффектов различных форм прекондиционирования использовали глибенкламид в дозе 0,4 мг/кг, который вводили внутрибрюшинно 1 раз в сутки в течение 7 дней на фоне введения L-NAME и аминогуанидин в дозе 100 мг/кг.
Статистический анализ полученных данных осуществляли в программе Microsoft Excel. «Описательная статистика» применялась для нахождения среднего значения (M) и ошибки среднего (m). «Двухвыборочный t-тест с различными дисперсиями» использовался для сравнения показателей в различных группах животных и определения достоверности различий между ними. Статистически значимыми считали различия при значениях двустороннего p<0,05.
Результаты исследования и их обсуждение
Проведенные нами исследования показали, что и дистантное, и фармакологическое прекондиционирование никорандилом оказывают выраженное эндотелиопротекторное действие, выражающееся в преобладании эндотелийзависимого расслабления сосудов и снижении коэффициента эндотелиальной дисфункции. Так, КЭД в группах животных с применением фармакологического прекондиционирования никорандилом составил 1,9±0,18 усл. ед., дистантного ишемического прекондиционирования – 2,5±0,3 усл. ед. по сравнению с группой контроля L-NAME-патологии – 5,4±0,6 усл. ед.
NO-продуцирующая функция эндотелия исследована нами на основании определения в сыворотке крови концентрации конечных стабильных метаболитов оксида азота (NOх). Концентрация NOх на фоне дистантного и фармакологического прекондиционирования увеличивалась, приближаясь к уровню интактных животных (7,3±0,73 мкмоль/л), и составила 4,8±0,25 мкмоль/л, 6,2±0,3 мкмоль/л при проведении прекондиционирования ДИП и никорандилом соответственно.
Данные морфологических исследований показали, что применение двух видов прекондиционирования положительно повлияло на морфологические изменения почек и сердца крыс с экспериментальной артериальной гипертензией. Так, в группе с ДИП эта величина равнялась 13,0±0,5 мкм, и 12,0±0,3 мкм в группе с использованием никорандила. Отмечались нормализация структуры капилляров, предотвращение развития гипертрофических изменений диаметра кардиомиоцитов, отсутствовали деструктивные изменения эндотелия сосудов и признаки гипертрофии их стенок. В почках почти полностью исчезли признаки мембранозной гломерулопатии и капилляры клубочков выглядели в большинстве случаев так же, как и у интактных животных. Размер диаметра кардиомиоцитов группе контроля составил 18,5±0,3 мкм (рис. 1).
А 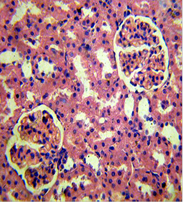 Б
Б 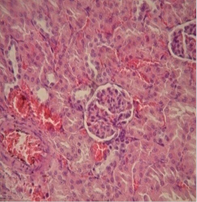 В
В 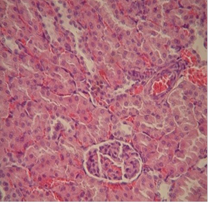
Рисунок 1. А-Крыса с экспериментальной артериальной гипертензией: клубочки имеют «лапчатые» очертания; базальные мембраны капилляров утолщены («проволочные петли»). Почка крысы на фоне проведения ДИП (Б) прекондиционирования никорандилом (В). 8-е сутки эксперимента: капилляры клубочка почки без патологических изменений; артериола коркового вещества без признаков гипертрофии, эндотелий не поражен. Окраска гематоксилином и эозином. Микрофото. х 400.
Таким образом, мы можем заключить, что и ДИП, и фармакологическое прекондиционирование никорандилом в эксперименте оказывают эндотелиопротекторное действие на L-NAME-индуцированной модели дефицита оксида азота.
Для изучения роли АТФ-зависимых калиевых каналов и индуцибельной NO-синтазы в эндотелиопротекторных эффектах разных видов прекондиционирования нами были выполнены следующие эксперименты:
1) группа интактная;
2) группа контроля на фоне L-NAME-патологии;
3) L-NAME+ на фоне дистантного ишемического прекондиционирования (ДИП);
4) L-NAME + на фоне введения никорандила (фармакологическое прекондиционирование);
5) L-NAME+ на фоне введения глибенкламида;
6) L-NAME+ на фоне введения аминогуанидина;
7) L-NAME+ на фоне проведения ДИП, после предварительного введения глибенкламида;
8) L-NAME+ на фоне введения никорандила, после предварительного введения глибенкламида;
9) L-NAME+ на фоне проведения ДИП, после предварительного введения аминогуанидина;
10) L-NAME+ на фоне введения никорандила, после предварительного введения аминогуанидина.
Таблица 1.
Влияние дистантного ишемического прекондиционирования и фармакологического прекондиционирования никорандилом на коэффициент эндотелиальной дисфункции при моделировании L-NAME (25 мг/кг внутрибрюшинно, однократно в течение 7 дней) индуцированного дефицита оксида азота (M±m, n=10)
|
№ n/n |
Группа |
КЭД (усл. ед.) |
NOx (мкмоль/л) |
ДКМЦ (мкм) |
|
1. |
Интактные |
1,1±0,1 * |
7,7±0,2* |
9,1±0,4* |
|
2. |
Контроль |
5,4±0,5 |
2,3±0,4 |
18,5±0,1 |
|
3. |
L-NAME+ДИП |
2,5±0,3* |
4,8±0,3* |
13,0±0,6* |
|
4. |
L-NAME +никорандил |
1,9±0,1* |
6,2±0,6* |
12,0±0,3* |
|
5. |
L-NAME+аминогуанидин |
4,8±0,2 |
2,6±0,3 |
16,4±0,4 |
|
6. |
L-NAME+глибенкламид |
5,3±0,5 |
2,2±0,2 |
18,1±0,3 |
|
7. |
L-NAME+аминогуанидин +ДИП |
5,1±0,2 |
3,1±0,4 |
17,3±0,1 |
|
8. |
L-NAME+аминогуанидин никорандил |
2,3±0,4* |
6,0±0,3* |
10,5±0,5* |
|
9. |
L-NAME+глибенкламид +ДИП |
4,4±0,3 |
3,5±0,5 |
17,0±0,4 |
|
10. |
L-NAME+глибенкламид +никорандил |
4,3±0,5 |
3,0±0,2 |
17,1±0,2 |
Примечание: * – р<0,05 в сравнении с L-NAME,
NOx - концентрация конечных стабильных метаболитов оксида азота, ДКМЦ – диаметр кардиомиоцитов, КЭД – коэффициент эндотелиальной дисфункции.
Введение аминогуанидина животным контрольной группы не повлияло на КЭД и составило 4,8±0,2 усл. ед., что достоверно не отличается от группы контроля. Введение его перед применением дистантного ишемического прекондиционирования увеличивало КЭД (таблица 1) и нивелировало эндотелиопротекторный эффект дистантного ишемического прекондиционирования. В группе с применением аминогуанидина с никорандилом полной отмены эффекта прекондиционирования не произошло, отмечено лишь небольшое его уменьшение. Что в цифрах составляет 2,3±0,4 усл. ед. Что подтверждается и результатами биохимических и морфологических исследований (таблица 1).
Введение глибенкламида, блокатора АТФ-зависимых калиевых каналов полностью нивелировали эндотелиопротективные эффекты всех способов прекондиционирования: и ишемического, и фармакологического, что выражалось в повышении коэффициента эндотелиальной дисфункции (КЭД), при этом значения приближались к таковым в группе с L-NAME-патологией (5,4±0,6 усл. ед.) и составили 4,4±0,5 усл. ед. и 4,3±0,2 усл. ед. при введении глибенкламида на фоне прекондиционирования ДИП и никорандила. Что подтверждается результатами биохимических и фармакологических исследований (таблица 1).
В настоящее время не существует фармакологической группы для специфической коррекции эндотелиальной дисфункции, поэтому данные о свойствах различных препаратов и кардиологических феноменов в качестве дополнения к существующим методам лечения сердечно-сосудистых заболеваний имеют огромное значение.
В исследованиях, проведенных в нашей лаборатории ранее, показано положительное влияние дистантного ишемического прекондиционирования и фармакологического прекондиционирования на степень выживаемости ишемизированных тканей и неоваскулогенез, воспалительный процесс и размер повреждения миокарда при инфаркте [1-3].
Полученные нами экспериментальные данные свидетельствуют о защитном действии дистантного ишемического и фармакологического прекондиционирования никорандилом, выражающемся в преобладании эндотелийзависимого расслабления сосудов и снижении коэффициента эндотелиальной дисфункции. Пути реализации данных эффектов предполагаются различные. У никорандила он обусловлен в основном влиянием на АТФ-зависимые калиевые каналы. В связи с чем блокада КАТФ-каналов глибенкламидом обнаружила нивелирование положительных эндотелиопротективных эффектов никорандила, выразившееся в повышении КЭД; а механизмы эндотелиопротективных свойств дистантного ишемического прекондиционирования обусловлены дополнительным влиянием на метаболизм оксида азота.
Выводы
1. Дистантное ишемическое прекондиционирование и фармакологическое прекондиционирование никорандилом могут рассматриваться как способы предупреждения повреждения эндотелия сосудов, что имеет важное значение для определения возможного спектра применения различных видов прекондиционирования в клинической практике.
2. Индуцибельная NO-синтаза играет важную роль в формировании эндотелиопротекторного эффекта дистантного ишемического прекондиционирования.
Механизм эндотелиопротекторного эффекта никорандила зависит главным образом от чувствительных АТФ-зависимых калиевых каналов.
Рецензенты:
Маль Г.С., д.м.н., профессор, заведующая кафедрой фармакологии КГМУ, г. Курск.
Будко Е.В., д.м.н., профессор КГМУ, г. Курск.



