Проведенные крупные популяционные исследования свидетельствуют, что у лиц с заболеваниями почек, а особенно, имеющих почечную недостаточность, риск сердечно-сосудистых заболеваний гораздо выше, чем в общей популяции. Снижение СКФ на 10 мл/мин ассоциируется с увеличением риска развития сердечно-сосудистых исходов на 20 % и смерти от любых причин на 33 % [5].
Высокая частота сердечно-сосудистых осложнений при ХПН дает основание рассматривать почечную недостаточность в качестве «васкулопатического состояния», которое под влиянием различных патогенетических механизмов вначале «формируется как функциональное расстройство, а затем трансформируется в органическую сердечно-сосудистую патологию» [6]. По современным представлениям процессы ускоренного атерогенеза формируются при патологии почек задолго до начала лечения гемодиализом и прогрессируют с момента начала заместительной почечной терапии [3]. В ряде исследований доказано влияние на состояние сердечно-сосудистой системы факторов, обусловленных уремией: синдром хронического системного воспаления, анемия, вторичный гиперпаратиреоз, гиперфосфатемия, оксидативный стресс, воздействие уремических токсинов [1, 2, 4, 7].
Цель исследования: выявление связи между «уремическими факторами» риска сердечно-сосудистых осложнений и процессами ремоделирования периферических сосудов в условиях хронической болезни почек.
Объекты и методы исследования. Для решения поставленных задач проведено клиническое и лабораторное обследование 100 человек, из них 84 пациента с хронической почечной недостаточностью в различных стадиях, находившихся на лечении в отделении нефрологии УХМАО-Югры «Окружная клиническая больница» г. Ханты-Мансийск в 2006–2010 гг. Группу сравнения представили 16 здоровых добровольцев. Среди обследованных мужчин – 41, женщин – 58; средний возраст – 38,37+11,84 лет. В изучаемой группе СКФ составила 38.69±31,6 мл/мин. Структура нозологии в исследуемых группах: гломерулонефрит – 71 (84,5 %), ХТИН – 10 (11,9 %), АРМВС – 3 (3,6 %).
Критериями включения в исследование явились: наличие нефропатии с нарушением азотовыделительной функции почек (повышение уровня креатинина крови более 1,4 мг/дл (123 мкмоль/л) и/или снижение скорости клубочковой фильтрации ниже 90 мл/мин/1,73м2, сохраняющееся в течение года) у лиц, старше 18 лет.
Критериями исключения из исследования явились: возраст младше 18 и старше 55 лет; наличие сахарного диабета I или II типов; наличие сердечно-сосудистой патологии, развившейся до начала почечной патологии; реноваскулярная гипертензия, наличие тяжелых соматических и психических заболеваний (в том числе стенокардии напряжения III и IV ФК и ХСН III и IV ФК (NYHA).
При обследовании у всех пациентов исследуемых и контрольной групп уровень гемоглобина (Нb) и гематокрит (Ht) определяли на гематологическом анализаторе «Beckman coulter». Уровень сывороточного железа (Fe) и общей железосвязывающей способности сыворотки (ОЖСС) – с расчетом сатурации трансферрина (Sat Fe); креатинина (Сrea), фосфора (Phos), кальция (Ca), С-реактивного белка (CRP) определяли на аппарате «Beckman coulter synchron Clinical system CX4». Обследование проведено в стадии ремиссии основного заболевания. Ферритин определяли на аппарате Beckman coulter Access Immunoassay system». Уровни иПТГ и гомоцистеина определялись методом иммуноферментного анализа (ИФА).
Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле Cockroft-Gault: СКФ=[(140 – возраст – вес (кг) -0,85 (для женщин)]/[72-креатинин сыворотки (мг/дл)], мл/мин. В соответствии с рекомендациями Национального почечного фонда США (NKF K/DOQI, 2002 г.) по уровню СКФ устанавливалась стадия хронической болезни почек (ХБП).
Лодыжечно-плечевой индекс (ЛПИ) определялся на аппарате Smart Dop 30 EX. Толщину комплекса интима – медиа (КИМ) брахио-цефальных сосудов (БЦС) измеряли на аппарате SEQUOIA-512. Всем больным выполняли ультразвуковую допплерографию общих сонных артерий с целью проведения количественной и качественной оценки состояния сосудистой стенки. Определяли толщину КИМ, также констатировали наличие атеросклеротических бляшек и/или кальцинатов в общих сонных артериях (ОСА).
Результаты обработаны с использованием методов непараметрической статистики с помощью пакетов статистических программ SPSS 16.0 for Windows. Для оценки нормальности распределения количественных признаков применялась визуальная оценка частотного распределения с последующей оценкой нормальности с использованием критерия асимметрии. Выборка считалась нормально распределенной, если уровень значимости для всех использованных критериев нормальности был р< 0,05. Для сравнения нескольких групп применялся однофакторный дисперсионный анализ. Для сравнения различий в двух группах использовался двухвыборочный критерий Стъюдента, если распределение в группах было нормальным.
При определении взаимосвязей между различными параметрами использовался корреляционный анализ. Непараметрический коэффициент парной корреляции Спирмена применялся для определения корреляции параметров, которые имеют неправильное распределение, а для параметров с нормальным распределением использовался коэффициент парной корреляции Пирсона. Различия между группами и корреляционные связи считались статистически значимыми при уровне значимости р < 0,05.
Результаты и обсуждение
В нашей работе мы исследовали вопросы эпидемиологии поражения сосудистого русла у больных с хронической почечной недостаточностью (ХПН) и факторы, имеющие статистически значимую связь с сосудистым кальцинозом и атеросклерозом при ХПН (табл. 1).
Таблица 1
Общая характеристика пациентов исследуемой группы
|
Фактор |
Means |
Std.Dev. |
Фактор |
Means |
Std.Dev. |
|
возраст |
38,37 |
11,84 |
Hb |
113,32 |
23,68 |
|
пол |
0,41 |
0,49 |
Ht |
32,18 |
6,74 |
|
BSA |
1,79 |
0,23 |
Fe |
12,99 |
5,62 |
|
САД |
152,09 |
35,30 |
ОЖСС |
51,26 |
13,77 |
|
ДАД |
91,99 |
18,12 |
Sat Transf |
26,89 |
13,68 |
|
ПАД |
59,90 |
19,44 |
Ferritin |
253,85 |
165,62 |
|
ЧСС |
75,06 |
7,43 |
СРБ |
1,54 |
1,42 |
|
Crea |
0,56 |
0,45 |
Гомоцистеин |
17,17 |
15,74 |
|
Phos |
1,77 |
0,76 |
Alb |
34,00 |
6,59 |
|
Ca |
2,21 |
0,21 |
GFR |
38,69 |
31,60 |
|
PxCa |
3,87 |
1,66 |
PTH |
356,58 |
330,28 |
Выраженность ремоделирования артерий оценивали на основании увеличения толщины КИМ и изменения ЛПИ (табл. 2).
Таблица 2
Показатели КИМ и ЛПИ больных ХБП
|
Показатель |
Means |
Std.Dev. |
|
КИМ |
1,2 |
0,19 |
|
ЛПИ |
1,10 |
0,17 |
В нашем исследовании более чем у 1/3 из обследованных больных выявлено увеличение КИМ ОСА, кальциноз сосудов диагностирован в – 12 %. Инструментальное подтверждение наличия бляшек получено у 19 % больных. Таким образом, более чем у 35 % больных с додиализной стадией почечной недостаточности методом допплерографии сосудов выявлены признаки доклинической стадии атеросклероза.
Наличие увеличения толщины КИМ в сонных артериях прямо коррелировало с пульсовым артериальным давлением (ПАД), систолическим артериальным давлением (САД), уровнем креатинина, гомоцистеина. Выявлена отрицательная корреляция с показателем кальция. При анализе корреляционной связи толщины КИМ сосудов шеи наибольшая зависимость выявлена от показателей анемического синдрома (Ht r= -0,46, p<0,0001; Нв r= -0,40, p<0,0001;) и СКФ (r= -0,54, p<0,0001). Не выявлено зависимости от возраста и пола (табл. 3).
Таблица 3
Корреляция показателя толщины КИМ с параметрами гемодинамики, уремическими факторми риска у больных ХБП
|
|
r |
p |
|
возраст |
0,111 |
0,321 |
|
пол |
0,008 |
0,944 |
|
BSA |
-0,084 |
0,454 |
|
САД, мм рт.ст |
0,319 |
0,004 |
|
ДАД, мм рт.ст. |
0,263 |
0,017 |
|
ПАД, мм ртст. |
0,326 |
0,003 |
|
Crea |
0,264 |
0,017 |
|
Phos |
0,192 |
0,083 |
|
Ca |
-0,274 |
0,013 |
|
PхСа |
0,126 |
0,260 |
|
PTH |
0,136 |
0,225 |
|
Hb, г/л |
-0,399 |
0,001 |
|
Ht |
-0,456 |
0,001 |
|
Ferritin |
0,165 |
0,138 |
|
СРБ |
0,169 |
0,130 |
|
Гомоцистеин |
0,248 |
0,025 |
|
Alb |
-0,169 |
0,130 |
|
GFR |
-0,543 |
0,001 |
При проведении регрессионного анализа степень описания моделью процесса RI=0,64, при этом критерий Фишера р<0,00001, что говорит о достоверности модели (рис. 1).
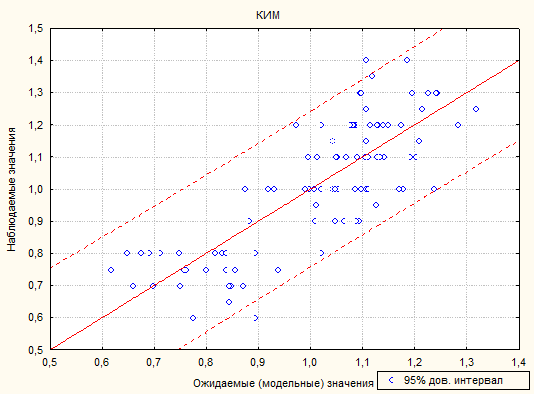
Рис. 1. Зависимость наблюдаемых и модельных значений переменной КИМ
Патологические изменения ЛПИ выявлены у 24 человек в исследуемой группе пациентов, при этом увеличение показателя (более 1,3) – в 15 % случаев, а снижение (менее 0,9) – в 9,5 %. При оценке факторов риска и процессов, патогенетически связанных с нарастанием жесткости артерий, в группе больных с додиализной стадией ХПН обнаружены прямые положительные достоверные связи между повышением ЛПИ и уровнем креатинина, гомоцистеина, СРБ, ферритина. Отрицательно коррелирует величина ЛПИ и показатель СКФ. Но наибольший коэффициент корреляции получен между ЛПИ и показателями фосфорно-кальциевого обмена (PхСа r= 0,64, p=0,0001; фосфор r= 0,57, p=0,0001) и иПТГ (r= 0,48, p=0,0001) (таб. 4).
Таблица 4
Корреляция показателя ЛПИ с параметрами гемодинамики, уремическими факторами риска у больных ХБП
|
|
r |
p |
|
возраст |
0,120 |
0,282 |
|
пол |
-0,158 |
0,156 |
|
BSA |
-0,223 |
0,044 |
|
САД, мм рт.ст |
-0,097 |
0,385 |
|
ДАД, мм рт.ст. |
-0,190 |
0,088 |
|
ПАД, мм ртст. |
0,008 |
0,943 |
|
ЧСС |
-0,225 |
0,042 |
|
Crea |
0,347 |
0,001 |
|
Phos |
0,570 |
0,001 |
|
Ca |
0,204 |
0,067 |
|
PхСа |
0,640 |
0,001 |
|
PTH |
0,483 |
0,001 |
|
Hb |
-0,130 |
0,243 |
|
Ht |
-0,156 |
0,162 |
|
Sat Transf |
-0,079 |
0,482 |
|
Ferritin |
0,327 |
0,003 |
|
СРБ |
0,227 |
0,041 |
|
Гомоцистеин |
0,361 |
0,001 |
|
СКФ |
-0,399 |
0,001 |
При проведении регрессионного анализа степень описания моделью процесса RI=0,55, при этом критерий Фишера р<0,0000001, что говорит о достоверности модели. Рассчитаны коэффициенты регрессии для наиболее коррелируемых с ЛПИ величин. Степень и направление влияния показателей гемодинамики и уремических факторов сердечно-сосудистых осложнений на ЛПИ представлены в диаграмме (рис. 2). Наибольшим влиянием обладают показатели фосфорно-кальциевого обмена и СКФ.
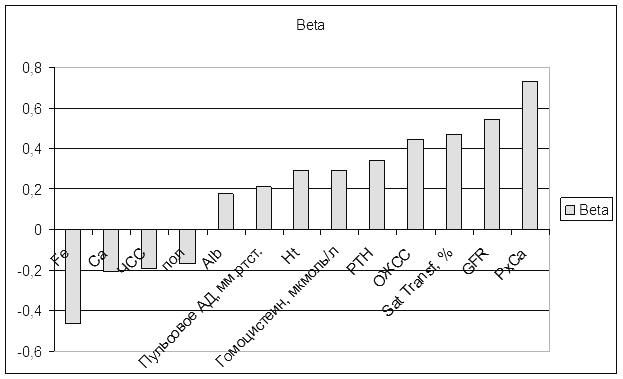
Рис. 2. Диаграмма, отражающая степень и направление влияния переменных на значения ЛПИ
Таким образом, получены достоверные данные о взаимосвязи уремических факторов риска с показателями, характеризующими состояние периферических артерий. Имеется достаточно оснований для постановки вопроса относительно широкого внедрения в алгоритм обследования пациентов с ХБП метода измерения ЛПИ и толщины КИМ как показателей, позволяющих на доклинической стадии выявить пациентов с гемодинамически значимой патологией артерий, повышенным риском наличия атеросклеротических поражений в коронарном бассейне, а также уточнить риски развития сердечно-сосудистых осложнений.
Выводы
1. При ХБП структурно-функциональные изменения периферических сосудов (увеличение ТИМ БЦС – 34,5 %, кальциноз БЦС – 12 %, патологические сдвиги ЛПИ – 28,6 %) регистрируются на додиализной стадии ХПН.
2. Частота выявления утолщения КИМ увеличивается при снижении СКФ, коррелирует с выраженностью анемического синдрома (r= -0,46, р< 0,0001).
3. Величина ЛПИ изменяется на ранних стадиях ХПН, параллельно нарушениям фосфорно-кальциевого обмена (РхСа r=0,64, p<0,001; ПТГ r=0,48, p<0,001).
Рецензенты:
Попова М. А., доктор медицинских наук, профессор, зав. кафедрой госпитальной терапии ГБОУ ВПО «Сургутский государственный университет ХМАО-Югры», г. Сургут.
Гноевых В. В., доктор медицинских наук, профессор, зав. кафедрой пропедевтики внутренних болезней медицинского факультета Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Библиографическая ссылка
Пьянкина О.В., Татаринцев П.Б., Рагозин О.Н. ВЛИЯНИЕ УРЕМИЧЕСКИХ ФАКТОРОВ НА ПРОЦЕССЫ РЕМОДЕЛИРОВАНИЯ ПЕРИФЕРИЧЕСКИХ СОСУДОВ У БОЛЬНЫХ ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК // Современные проблемы науки и образования. 2013. № 1. ;URL: https://science-education.ru/ru/article/view?id=8509 (дата обращения: 09.03.2026).



