Разработка экспрессных, эффективных способов тестирования антиоксидантов является одной из актуальных проблем современной химии, так как антиоксиданты определяют многие технологии: хранение и переработка жиров, масел, масляных фармпрепаратов, полимеров, топлив.
В настоящее время широкое развитие получает антиоксидантотерапия для профилактики и лечения многих заболеваний, процессов старения, адаптации к стрессам, неблагоприятным воздействиям окружающей среды. В связи с этим, существует большой интерес к поиску новых, эффективных средств антиоксидантотерапии и совершенствованию известных, разработке новых способов тестирования антиоксидантов. Известные способы тестирования антиоксидантов основаны на теории цепных разветвленных процессов жидкофазного окисления углеводородов и их производных [7, 8, 12].
Настоящая работа посвящена исследованию кинетики окисления растворов метиллинолеата в хлорбензоле в зависимости от концентраций инициатора и ингибиторов: ионола, α-токоферола, капотена и разработке на этой основе способов оценки эффективности ингибиторов.
С этой целью предложены критерии оценки эффективности и механизма действия антиоксидантов на основе аппроксимации и дифференцирования функций, соответствующих кинетическим кривым (КК) окисления.
В следующем сообщении будут приведены результаты соответствующих исследований в водно-липидных системах.
Методы эксперимента
Окисление осуществляют в термостатированной ячейке при 60о ±0,2оС при непрерывном перемешивании со скоростью 1200 об./мин. Концентрацию поглощенного кислорода определяют волюмометрически. В качестве инициатора использован 2, 2´-азобисизобутиронитрил (АИБН) марки «ч», который очищают путем многократной последовательной кристаллизации из этанола, ацетона, бензола с последующей осушкой в вакуумном эксикаторе и хранением при –10оС [4]. Метиллинолеат (МЛ) получают путем метилирования линолевой кислоты четырехкратным избытком метанола при комнатной температуре с последующей вакуумной перегонкой и очисткой путем кристаллизации с мочевиной в растворе метанола [3]. Ионол (2, 6-дитретбутил-4-метилфенол) марки «ч.» очищают двукратной кристаллизацией из абсолютного этанола при температуре 68,5оС. α-токоферол (2, 5, 7, 8-тетраметил-2-(4, 8, 12-триметилтридецил)-6-оксихроман) фирмы «Serva» и капотен в виде субстанции (1-[(2S)-3-метилпропио-нил]-L-пролина) используют без дополнительной очистки. Хлорбензол очищают экстракцией примесей концентрированной серной кислотой по известной методике [9] с последующей ректификационной перегонкой и отбором пробы с температурой 132оС.
Результаты исследования
Механизм инициированного окисления углеводородов описывается схемой:
Инициирование цепей:
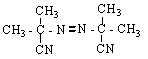
![]()
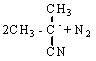
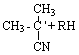
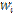
![]()
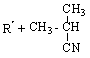 (0)
(0)
Продолжение цепей:
![]() (1)
(1)
![]() (2)
(2)
Разветвление цепей:
![]() (3.1)
(3.1)
![]() (3.2)
(3.2)
Обрыв цепей:
![]() (4)
(4)
Для подтверждения соответствия механизма окисления МЛ приведенной схеме сравнивают теоретически рассчитанные и экспериментально определенные скорости окисления. Скорость определяется лимитирующей стадией процесса (2) и, в соответствии со схемой, описывается выражением (1):
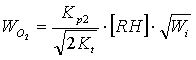 , (1)
, (1)
где ![]() – константа скорости продолжения цепей;
– константа скорости продолжения цепей;
![]() – константа скорости обрыва цепей.
– константа скорости обрыва цепей.
Из литературы [6, 11] известны значения ![]() и
и ![]() для МЛ при 60оС и соответственно равны 81,38 и 4,42∙106 л∙моль-1·с-1. Концентрация МЛ в растворе хлорбензола составляет 1,5 моль/л.
для МЛ при 60оС и соответственно равны 81,38 и 4,42∙106 л∙моль-1·с-1. Концентрация МЛ в растворе хлорбензола составляет 1,5 моль/л.
Скорость инициирования вычисляется по известному [13] для растворов углеводородов в хлорбензоле выражению (2):
![]() (2)
(2)
где [I] – концентрация инициатора, моль·дм-3;
l = 1,2 – эффективность выхода радикалов из "клетки" в растворах хлорбензола;
Кi – константа скорости распада АИБН (л·моль–1·с–1), которую вычисляют по известному для метиллинолеата [14] выражению (3):
![]() (3)
(3)
В результате для концентраций АИБН, равных 2∙10-3; 6∙10-3; 6∙10-2 моль/л получены значения скоростей: 1,4∙10-9; 2,98∙10-9; 2,98∙10-8 моль·л–1·с–1 соответственно.
Экспериментально изучают окисление растворов МЛ в хлорбензоле в соотношении 1 : 1 (по объему) для различных концентраций инициатора. Типичные КК для трех концентраций АИБН приведены на рисунке 1.
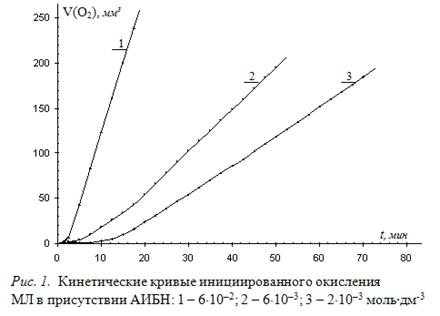
По наклону линейных участков КК графическим методом вычисляют скорость окисления. В результате получены значения скоростей (1,7±0,3)×10–9; (3,0±0,2)×10–9; (3,0±0,3)×10–8 моль×л-1×с-1 для указанных концентраций инициатора соответственно. Получены близкие значения расчетных и экспериментальных скоростей инициирования, что свидетельствует о соответствии механизма процесса окисления МЛ приведенному механизму.
Далее исследована кинетика инициированного окисления МЛ в зависимости от концентрации ионола. Ионол известен как стандартный сильный синтетический ингибитор углеводородов. К сильным ингибиторам, по современной классификации относятся ингибиторы, участвующие только в реакциях обрыва цепей [6, 7, 8]:
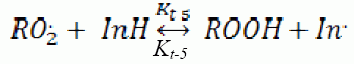 (5)
(5)
![]() (6)
(6)
К слабым – относят ингибиторы, участвующие не только в реакциях обрыва, но и в реакциях продолжения и разветвления цепей:
![]() (7)
(7)
![]() (8)
(8)
В соответствии с приведенной схемой механизма скорость окисления в присутствии сильного ингибитора определяется выражением:
![]() , (4)
, (4)
где ![]() – константа скорости обрыва цепей на ингибиторе, л∙моль–1·с–1;
– константа скорости обрыва цепей на ингибиторе, л∙моль–1·с–1;
![]() – стехиометрический коэффициент ингибирования, определяющий число обрывов цепей на одной молекуле ингибитора, для ионола
– стехиометрический коэффициент ингибирования, определяющий число обрывов цепей на одной молекуле ингибитора, для ионола ![]() ;
;
![]() – концентрация ингибитора, моль/л.
– концентрация ингибитора, моль/л.
Эффективность ингибитора определяется величиной константы ![]() . Для ионола в этилбензоле и других углеводородах при 60оС она определена и составляет (2,6±0,4)×104 л×моль-1×с-1 [6, 11]. На рис. 2 приведены типичные КК окисления МЛ в присутствии 6×10-3 моль/л АИБН при различных концентрациях ионола.
. Для ионола в этилбензоле и других углеводородах при 60оС она определена и составляет (2,6±0,4)×104 л×моль-1×с-1 [6, 11]. На рис. 2 приведены типичные КК окисления МЛ в присутствии 6×10-3 моль/л АИБН при различных концентрациях ионола.
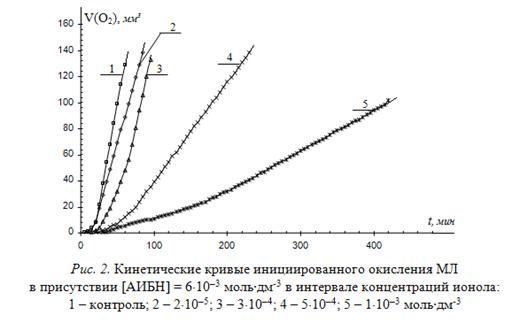
По начальным участкам КК графическим методом вычисляют скорость окисления МЛ в присутствии ингибитора. С целью увеличения точности, вычисления производят в разных точках, а результаты усредняют. Возможно также вычисление скорости как величины обратной периоду полного торможения. По выражению (5), выведенному из выражения (4) при известных параметрах ![]() ,
, ![]() ,
, ![]() ,
, ![]() и
и ![]() вычисляют
вычисляют ![]() .всех исследованных концентраций ионола при различных скоростях инициирования:
.всех исследованных концентраций ионола при различных скоростях инициирования:
![]() (5)
(5)
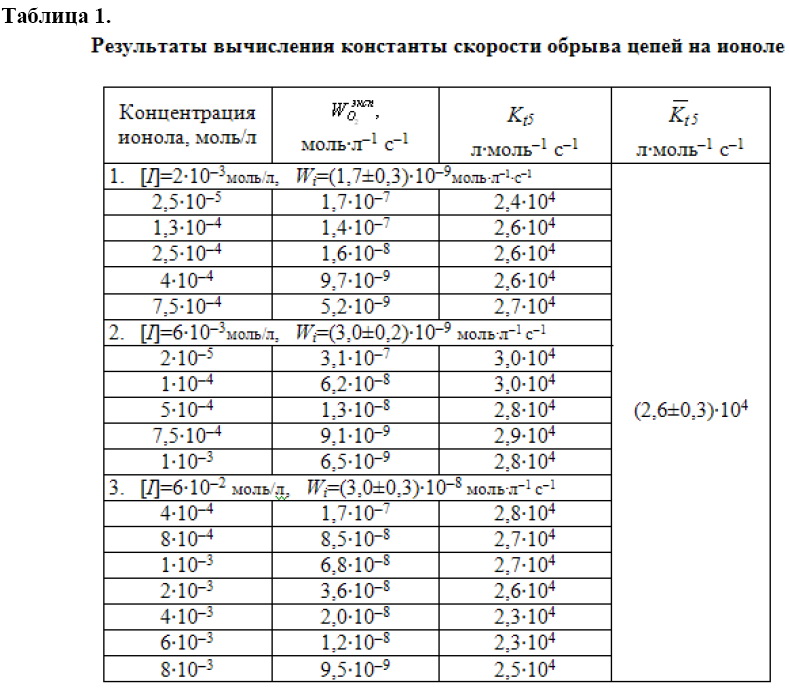
Результаты вычислений приведены в табл. 1.
Из таблицы видно, что константа скорости обрыва цепей на ионоле при изученных условиях окисления не зависит от концентрации ингибитора и практически не зависит от скорости инициирования.
Результаты показывают, что эффективность сильных ингибиторов для тор-можения процессов окисления липидов можно оценивать по результатам опреде-ления кинетических параметров инициированного окисления МЛ. В качестве критерия сильного ингибитора нужно использовать постоянство значений ![]() при различных скоростях инициирования и концентрациях ингибитора. Тогда критерием эффективности ингибитора служит величина
при различных скоростях инициирования и концентрациях ингибитора. Тогда критерием эффективности ингибитора служит величина ![]() .
.
Далее метиллинолеатная модель использована для исследования кине-тики и механизма действия биоантиоксидантов. Важнейшим биоантиокси-дантом животных и растительных клеток признан α-токоферол. Из литерату-ры [1, 2, 5] известен сложный механизм действия α-токоферола в углеводо-родах, его участие в реакциях продолжения цепей. Константа скорости обрыва цепей определена Ингольдом в стироле при 60оС, как субстрате в котором не-возможно участие α-токоферола в реакциях продолжения цепей и составляет (2,6±0,4)·106 л∙моль-1·с-1. В этилбензоле константа скорости обрыва цепей на α-токофероле определена Е. Бурлаковой с соавторами [2] при 37оС она состав-ляет (3,3±0,4)·106 л∙моль-1·с-1.
Далее приведены результаты оценки антиоксидантной активности α-то-коферола по величине ![]() . С этой целью исследована кинетика окисления метиллинолеата в зависимости от концентрации α-токоферола при различных скоростях инициирования. Типичные КК приведены на рис. 3.
. С этой целью исследована кинетика окисления метиллинолеата в зависимости от концентрации α-токоферола при различных скоростях инициирования. Типичные КК приведены на рис. 3.
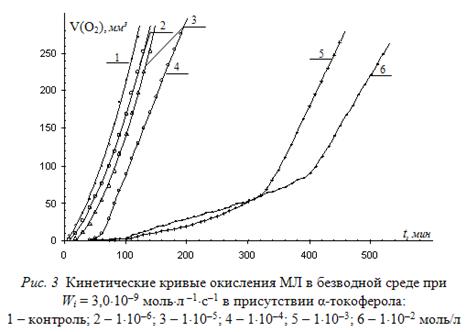
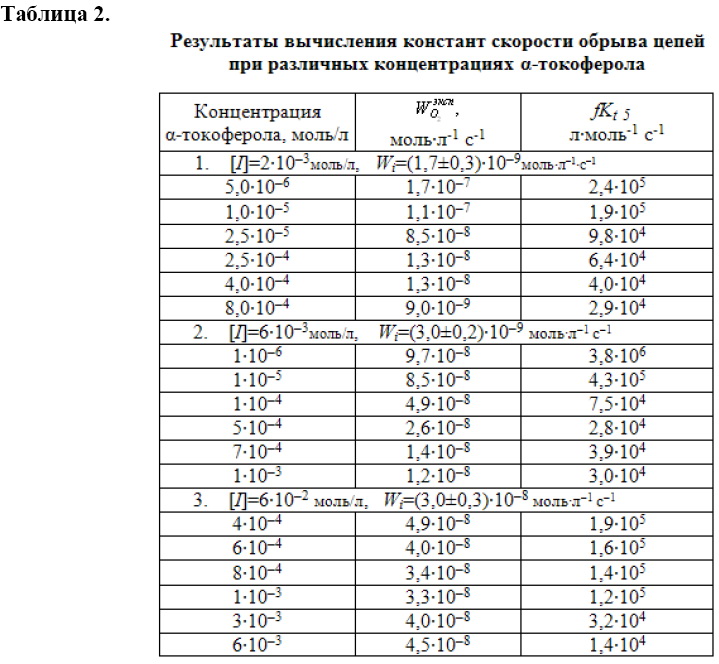
На начальных участках КК, как показано выше, определены скорости окисления МЛ в присутствии α-токоферола. По выражению (5) вычислены значения ![]() , которые сведены в табл. 2.Из таблицы видно, что при всех исследованных скоростях инициирования параметр
, которые сведены в табл. 2.Из таблицы видно, что при всех исследованных скоростях инициирования параметр ![]() уменьшается с увеличением концентрации α-токоферола примерно в 10 – 100 раз, что вероятно связано с его участием в реакциях продолжения цепей.
уменьшается с увеличением концентрации α-токоферола примерно в 10 – 100 раз, что вероятно связано с его участием в реакциях продолжения цепей.
Представленные результаты показывают, что параметр ![]() для α-то-коферола отражает вклад различных элементарных реакций, поэтому он не может использоваться в качестве показателя эффективности обрыва цепей, что будет, видимо, характерно для всех других ингибиторов подобного типа.
для α-то-коферола отражает вклад различных элементарных реакций, поэтому он не может использоваться в качестве показателя эффективности обрыва цепей, что будет, видимо, характерно для всех других ингибиторов подобного типа.
Для оценки эффективности «слабых ингибиторов», для липидных суб-стратов предлагается метод внешнего стандарта. С этой целью необходимо сравнить в идентичных условиях кинетику окисления МЛ в присутствии оди-наковых концентраций ионола и тестируемого ингибитора. Типичные КК окисления метиллинолеата в присутствии ионола и α-токоферола приведены на рис. 4.
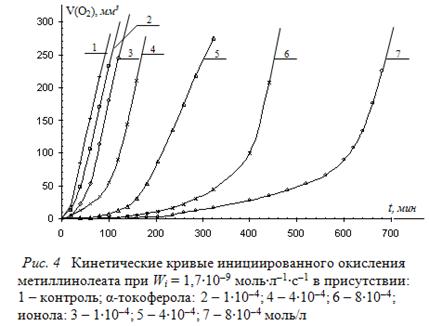
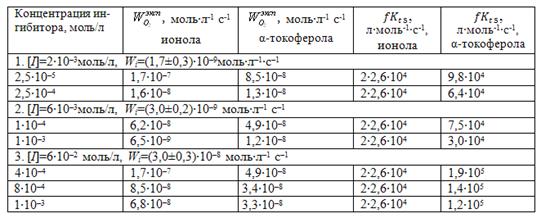
Рисунок показывает различный характер КК окисления МЛ присутствии ионола и α-токоферола при одинаковых концентрациях. В присутствии α-токо-ферола всегда наблюдается меньший период индукции, более плавный и продол-жительный период ускорения, что указывает на меньшую его антиоксидантную активность по сравнению с ионолом. Сравнение ![]() для некоторых одинаковых концентраций ионола и α-токоферола приведено в табл. 3.
для некоторых одинаковых концентраций ионола и α-токоферола приведено в табл. 3.
Из таблицы видно, что при всех скоростях инициирования ![]() для ионола имеет постоянные значения, в то время как
для ионола имеет постоянные значения, в то время как ![]() для α-токоферола зависят от его концентрации и скорости инициирования. В целом, метод внешнего стандарта позволяет сделать вывод о сложном или простом механизме действия тестируемого ингибитора, а также прогнозировать его эффективность по сравнению с ионолом.
для α-токоферола зависят от его концентрации и скорости инициирования. В целом, метод внешнего стандарта позволяет сделать вывод о сложном или простом механизме действия тестируемого ингибитора, а также прогнозировать его эффективность по сравнению с ионолом.
Таблица 3. Расчет константы скорости обрыва цепей на ионоле и α-токофероле в условиях метиллинолеатной модели
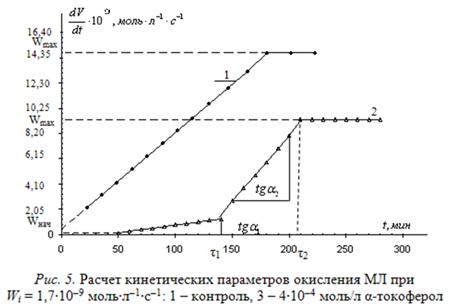
Для более детальной оценки и прогнозирования эффективности тестируемых ингибиторов нами разработан метод математической оценки кинетических параметров. С этой целью исходные КК аппроксимируют по участкам методом наименьших квадратов наилучшими функциями, которые далее дифференцируют. В результате получают пять кинетических параметров: ![]() ,
, ![]() – начальная и максимальная скорости,
– начальная и максимальная скорости, ![]() ,
, ![]() – период полного торможения и окончания ускорения,
– период полного торможения и окончания ускорения, ![]() – ускорение. Эти параметры позволяют оценить не только эффективность торможения, но и механизм действия ингибиторов. Эффективность торможения оценивают по величинам
– ускорение. Эти параметры позволяют оценить не только эффективность торможения, но и механизм действия ингибиторов. Эффективность торможения оценивают по величинам ![]() ,
, ![]() . Наличие перегибов на участке ускорения оценивают как разветвление цепей с участием и без участия ингибитора. Сравнение
. Наличие перегибов на участке ускорения оценивают как разветвление цепей с участием и без участия ингибитора. Сравнение ![]() контроля и
контроля и ![]() в пробе с ингибитором позволяют судить об участии ингибитора или продуктов его окисления в реакциях продолжения цепей. Типичные результаты приведены на рис. 5.
в пробе с ингибитором позволяют судить об участии ингибитора или продуктов его окисления в реакциях продолжения цепей. Типичные результаты приведены на рис. 5.
Далее методом внешнего стандарта и математической обработки оценивают эффективность и механизм действия лекарственного гипотензивного препарата капотена – тиола по своей химической природе в зависимости от скорости инициирования и концентрации. Типичные КК приведены на рис. 6.
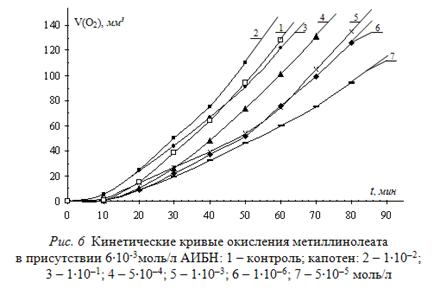
Показан аутоускоренный характер КК. При соотношении инициатора и ингибитора (6000 – 120) : 1 наблюдается снижение начальной и максимальной скоростей на 15 и 35% соответственно. При соотношении компонентов 12 : 1 сохраняется характер влияния, но величина снижения скоростей уменьшается до 10 и 15% соответственно. При соотношении 6 : 1 начальная скорость возрастает ![]() на 10%, а максимальная скорость снижается
на 10%, а максимальная скорость снижается ![]() на 15%. При соотношении 1 : (1,3 – 17) начальная скорость увеличивается
на 15%. При соотношении 1 : (1,3 – 17) начальная скорость увеличивается ![]() на 40%, а максимальная скорость не меняется или возрастает. Далее эффективность капотена оценена математически (табл. 4).
на 40%, а максимальная скорость не меняется или возрастает. Далее эффективность капотена оценена математически (табл. 4).
Таблица 4. Кинетические параметры окисления раствора метиллинолеата в хлорбензоле в присутствии капотена при Wi = 3,0·10–9 моль·л–1·с–1
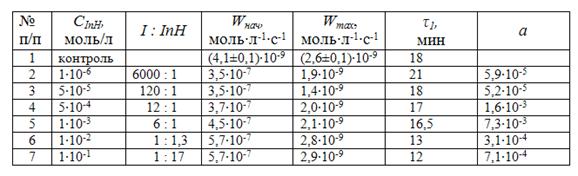
Показано, что повышение концентрации капотена снижает его эффективность вплоть до промотирования процесса, а максимальная скорость возрастает. Эти факты, вероятно, связаны с конкурирующим участием капотена в реакциях обрыва (6), продолжения (5) и зарождения цепей (реакции 0.1 и 0.2) за счет связи S–H:
![]() (0.1)
(0.1)
![]() (0.2)
(0.2)
Таблица 5. Результаты вычисления величины fKt 5 на капотене при окислении раствора МЛ в хлорбензоле при Wi = 3,0·10–9 моль·л–1·с–1
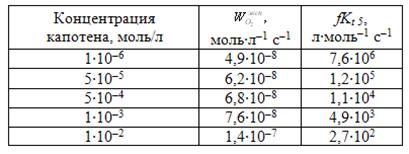
Параметр fKt5 уменьшается обратно пропорционально концентрации (табл. 5), что подтверждает сложный механизм действия капотена.
Таким образом, метиллинолеатная кинетическая модель позволяет оценить капотен как слабый ингибитор в условиях инициированного окисления.
На примере двух нетоксичных соединений: природного и синтетического, показана применимость метода внешнего стандарта для качественной и количественной оценки эффективности биоантиоксидантов.
Метиллинолеатная кинетическая модель позволяет оценить эффективность и механизм действия ингибиторов и классифицировать их как сильные, буферного действия и слабые, рекомендовать условия, в которых ингибиторы могут быть наиболее эффективны.
СПИСОК ЛИТЕРАТУРЫ:
1. Аристархова С.А., Бурлакова Е.Б., Храпова Н.Г. // Известия АН СССР. Серия химическая. - 1972. - № 12. - С. 2714-2718.
2. Бурлакова Е.Б., Крашаков С.А., Храпова Н.Г. Кинетические особенности токоферолов как антиоксидантов // Препринт. Черноголовка, 1992. – 56с.
3. Будацкий Н.П., Савенков Н.М. Мягкий метод синтеза метиловых эфиров высших жирных кислот // Масло-жировая промышл., 1969. - № 10. – С. 14 – 15.
4. Гук А.Ф., Цепалов В.Ф.//Кинетика и катализ. – 1971. – Т. 12. – В. 4. – № 6. – С. 910-913.
5. Гольденберг В.И., Тенцова А.И., Дмитричук Н.А. и др. // Хим. фарм. журнал. 1976. – Т. 10. – № 6. – С. 99 – 104.
6. Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций. – М.: Наука, 1971. – 711с.
7. Денисов Е.Т., Эмануэль Н.М. // Кинетика и катализ. – 1973. – Т. 14. – № 4. – С. 823 – 825.
8. Денисов Е.Т. // Успехи химии. – 1973. – Т. 43. – № 3. – С. 361 – 389.
9. Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия: Уч. пос.: В 2 ч. – М.: Изд-во МГУ, 1999. – Ч. 1. – 560с.
10. Ушкалова В.Н., Ионидис Н. В., Кадочникова Г.Д. и др. Контроль перекисного окисления липидов // Новосибирск: Наука, 1993. – 181с.
11. Цепалов В.Ф., Харитонова А.А., Гладышева Г.П., Эмануэль Н.М. // Кинетика и катализ. – 1977. – Т. 18. – № 5. – С. 1261 – 1267.
12. Эмануэль Н.М. // Известия АК СССР. Серия химическая. – 1974. - № 5. – С. 1056 – 1072.
13. Янишлиева Н., Скибида И., Майзус З. // Известия АН Болгария. Серия химия. – 1971. – Т. 4. – С. 1 – 4.
Библиографическая ссылка
Журавлева Л.А., Ушкалова В.Н. КИНЕТИЧЕСКИЕ ПОДХОДЫ К ПРОБЛЕМЕ ТЕСТИРОВАНИЯ АНТИОКСИДАНТОВ. С. 1. МЕТИЛЛИНОЛЕАТНАЯ МОДЕЛЬ // Современные проблемы науки и образования. 2008. № 3. ;URL: https://science-education.ru/ru/article/view?id=779 (дата обращения: 02.03.2026).



