В качестве биообъектов для биотехнологического производства рибофлавина используются микроорганизмы различной таксономической принадлежности, в основном, дрожжи и мицелиальные грибы. У флавиногенных дрожжей индукция рибофлавина происходит при iron starvation депрессии по железу. Аскомицеты Eremothecium gossypii, Ashbya gossypii (anamorph: Eremothecium ashbyii [9, 10], Candida famata [8], Pichia guilliermondii [7] также являются продуцентами витамина В2, который в организме фосфорилируется, превращаясь в коферменты - флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД), участвует в окислительно-восстановительных процессах, входит в состав основных дыхательных ферментов, с помощью которых осуществляется тканевое дыхание. Применение большинства указанных микроорганизмов в промышленных целях позволяет получать биотехнологическое сырье с высоким содержанием витамина.
Развитие современной индустрии биотехнологического производства витаминов требует разработки методов мониторинга биосинтетических процессов. Контролируя концентрацию метаболита, можно не только исследовать биологические основы процесса, но и обеспечить более высокое качество целевого продукта.
Материалы и методы исследования
В работе исследовали штаммы E. аshbyii BKMF-124, BKMF-3009, E.gossypii BKMF-3276, BKMF-3296. Культуры выращивали при 28 °С в колбах емкостью 750 мл с 200 мл питательной среды на качалке при 150 об./мин в течение 48 ч. Микромицеты культивировали на ферментационных средах ( в г/л: глюкоза - 10, пептон - 3, дрожжевой экстракт - 0,5, янтарнокислый натрий - 1,5, мезоинозит - 140 мг), которые готовили на дистиллированной воде (№1) или 1/15 М фосфатном буфере (№2). Количество биомассы учитывали весовым методом после ее отделения от культуральной жидкости и высушивания при 100 ºС до постоянной массы. Спектр поглощения и концентрация рибофлавина исследовался на спектрофотометре СФ-103 при длине волны 445 нм.
Результаты исследования и их обсуждение
Для определения рибофлавина в культуральной жидкости используются различные аналитические методы. Несомненно, наиболее эффективен метод ВЭЖХ. После центрифугирования и отделения осадка определяется концентрация рибофлавина в супернатанте. При этом способе используется спектрофотометрическая детекция пиков при определенных длинах волн, отвечающих 2 максимумам поглощения - 223 и 445 нм. Однако, для серийных определений метод ВЭЖХ оказывается не совсем удобен, так как требует дорогостоящего оборудования и реактивов.
В связи с этим становится актуальной разработка простой и эффективной методики оценки рибофлавина в культуральной жидкости, субстанции и фармацевтическом препарате. Мы предлагаем спектрофотометрический метод контроля уровня рибофлавина, в котором практически отсутствует пробоподготовка - наиболее трудоемкая стадия процесса. При указанной идентификации вещества главную роль играет положение максимумов светопоглощения и их интенсивность. Положение полос поглощения вещества связано с его химической структурой и является характеристикой его подлинности.
В молекуле рибофлавина C17H20N4O6 (7,8-диметил-10-[(2S,3S,4R)-2,3,4,5-тетрагидроксипентил]бензо[g]птеридин-2,4(3H,10H)-диона) (рис. 1) наличие развитой системы сопряжения изоаллоксазинового фрагмента обусловливает поглощение в УФ-области, что было использовано нами при исследовании его спектра. Для более объективного качественного анализа целесообразно учитывать и другие факторы, например: расчет отношения оптических плотностей при двух максимумах поглощения.
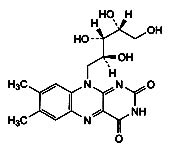
Рис. 1. Химическая структура рибофлавина
Спектр поглощения водного раствора рибофлавина регистрировали на Спектрофотометре СФ103 в интервале 210-500 нм в течение 4 суток (рис. 2). В качестве параметров спектра рассчитывали соотношение максимумов поглощения 373/267 и 444/267, как это предлагается в Фармакопее Великобритании (ВР-2007) [6]. При этом максимумы поглощения и соотношение максимумов 373/267 и 444/267 в течение 2 суток соответствовали требованиям ВР-2007 (373/267 - 0,31-0,33, 444/267 - 0,36-0,39). Это свидетельствует о стабильности рибофлавина в растворе и согласуется со сроком хранения экстемпоральных лекарственных форм [4].
Для количественного определения рибофлавина в субстанции был использован спектрофотометрический метод, предложенный Британской Фармакопеей [6]. При этом предлагается рассчитывать концентрацию рибофлавина по удельному поглощению при 444 нм (Е1%1 см = 328).
![]()
Все анализируемые жидкости (растворы) должны готовиться в склянках темного стекла, так как изоаллоксазиновый фрагмент чувствителен к свету.
Данный метод был апробирован на коллекционных и производственных штаммах продуцентов рибофлавина при различных режимах культивирования. Штаммы E. аshbyi и E.gossypii продуцируют витамин В2 (рибофлавин) - до 150 мг/л культуральной жидкости и при этом различаются уровнем флавиногенеза [1].
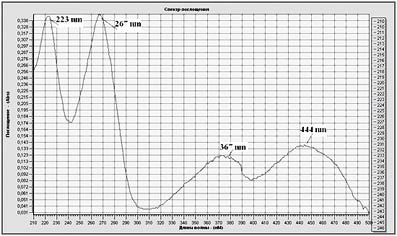
Рис. 2. Спектр поглощения рибофлавина
На рис. 3 представлена динамика накопления вторичного метаболита - рибофлавина культурой E. аshbyii в жидких питательных средах, различающихся компонентным составом. Содержание рибофлавина сохраняет тенденцию к увеличению с возрастанием рН независимо от состава среды. Добавление в среду 0,5 г/л гидрофосфата калия не стимулирует биосинтетическую активность по изучаемому витамину, что согласуется с ранее полученными данными [2, 3, 5].
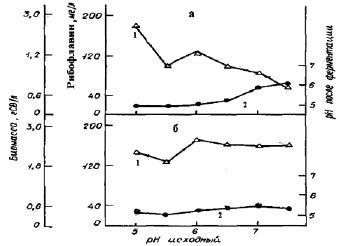
Рис. 3. Динамика накопления рибофлавина и биомассы при глубинном культивировании E. аshbyii:
а - среда №2; б - среда №1 с 0,5 г/л гидрофосфата калия, 1 - биомасса; 2 - рибофлавин
Каждому максимальному показателю продуктивности гриба (накопление биомассы, синтез рибофлавина) соответствуют определенные значения рН, ионов калия и натрия, что необходимо учитывать при оптимизации условий культивирования.
Выводы
1. Предложен метод спектрально-кинетического исследования содержания рибофлавина в водных растворах фармацевтических субстанций и препаратов, культуральной жидкости продуцентов.
2. Опытные данные свидетельствуют о стабильности рибофлавина в растворе в течение 2 суток, что согласуется со сроком хранения экстемпоральных лекарственных форм.
3. Экспериментально подтверждена эффективность применения спектрофотометрического метода при мониторинге уровня рибофлавина, продуцируемого культурами микромицетов.
Список литературы
- Бугорский П.С. Влияние ионов водорода, калия и натрия на продуктивность гриба Eremothecium ashbyi / П.С. Бугорский, Е.Ф. Семенова, В.С. Родов // Микробиологический журнал. - 1990. - Т. 52, № 3. - С. 44-47
- Миронов В.А., Цибульская М.И. Взаимосвязь процессов биосинтеза флавинов и стеринов у Eremothecium ashbyi // Прикл. биохимия и микробиология. - 1971. - Т. 7, № 5. - С. 604-606.
- Миронов В.А., Цибульская М.И. Образование монотерпенов аскомицетом Eremothecium ashbyi // Прикл. биохимия и микробиология. - 1982. - 18, № 3. - С. 343-345.
- Приказ МЗ РФ №214 от 16.07.97. О контроле качества лекарственных средств, изготовляемых в аптеках.
- Цибульская М.И., Миронов В.А. Влияние пропионовой и лимонной кислот на флавиногенез Eremothecium ashbyi // Прикл. биохимия и микробиология. - 1973. - 9, №4. - С. 565-568.
- British Pharmacopea CD 2007, V.1,2, System Simulation Ltd. (2007).
- Fedorovich D., Protchenko O., Lesuisse E. Iron uptake by the yeast Pichia guilliermondii. Flavinogenesis and reductive iron assimilation are co-regulated processes // Biometals. - 1999. - 12, №4. - P. 295-300
- Stahmann KP, Revuelta JL, Seulberger H. Three biotechnical processes using Ashbya gossypii, Candida famata, or Bacillus subtilis compete with chemical riboflavin production // Appl. Microbiol. Biotechnol. - 2000. - 53, №5 - P. 509-516.
- Tanner FWJ, Vojnovich C, Van Lanen JM: Factors affecting riboflavin production by Ashbya gossypii // Bacteriol. - 1949. - 58, №6. - P. 737-745.
- The yeasts, a taxonomic study. Ed.: C.P. Kurtzman, Jack W. Fell. Fourth edition. - 1998. Elsevier Science. B.V. - P. 201-208.
Библиографическая ссылка
Шпичка А.И., Семенова Е.Ф., Кузнецова А.В. К ВОПРОСУ ОПРЕДЕЛЕНИЯ РИБОФЛАВИНА В БИОТЕХНОЛОГИЧЕСКОМ СЫРЬЕ // Современные проблемы науки и образования. 2011. № 1. ;URL: https://science-education.ru/ru/article/view?id=4572 (дата обращения: 20.02.2026).



