Тучные клетки (ТК) являются одними из наиболее хорошо изученных клеток иммунной системы. Они происходят от плюрипотентных CD34+/CD117+ стволовых клеток костного мозга [1]. После миграции из костного мозга незрелые ТК циркулируют по микроциркуляторному руслу, пока не достигают периферических тканей, где созревают и подвергаются росту и дифференцировке [2; 3].
ТК в небольшом количестве постоянно присутствуют в печени и располагаются преимущественно в портальных трактах возле сосудов и желчных протоков. Эти клетки имеют очень важное значение при повреждении печеночной ткани. После воздействия повреждающих факторов холангиоциты начинают активно синтезировать фактор стволовых клеток (SCF), который является мощным хемоаттрактантом и вызывает миграцию ТК в печень. Интересно отметить, что после гепатэктомии 70% ткани печени с течением времени уровень SCF увеличивается и достигает максимума через 7 дней [4]. Мигрировавшие в печень ТК активируются, их количество возрастает, они дегранулируют, секретируя множество медиаторов, таких как гепарин, гистамин, триптаза, химаза, TNF, TGF-β1, TNF-α, IL-33, цитокины, основной фактор роста фибробластов (bFGF), лейкотриены и матриксные металлопротеиназы, которые активируют регенерацию, ангиогенез и пролиферацию гепатоцитов [5; 6].
Рутинное окрашивание гематоксилином и эозином дает мало информации об активности и морфологии ТК, а окраска толуидиновым синим лишь позволяет оценить количественные характеристики ТК и степень их дегрануляции. Поэтому была разработана комбинированная окраска ТК альциановым синим и сафранином О. Достоинством данного метода является то, что с помощью него можно дифференцировать молодые и зрелые ТК на основе содержания гепарина. При этом молодые незрелые ТК, содержащие слабо сульфатированные гликозаминогликаны (предшественники гепарина), окрашиваются в синий цвет, а зрелые и активные, за счет высокого содержания гепарина, окрашиваются в красный цвет [7]. Поэтому с помощью данного метода можно выявить незрелые ТК, мигрировавшие из микроциркуляторного русла.
В настоящее время имеются доказательства того, что ТК являются важными клеточными регуляторами при заболеваниях печени человека. Их число увеличивается, и они ремоделируют печеночную ткань при первичном билиарном холангите, первичном склерозирующем холангите, обструкции желчных протоков, гепатите, повреждении печени, вызванном алкоголем, стеатозе, стеатогепатите, фиброзе и циррозе печени, печеночноклеточном раке и холангиокарциноме, отторжении печени при трансплантации печени [8].
Гепарин, высвобождающийся из ТК при их активации, способен вызывать важные гомеостатические эффекты, ограничивающие развитие воспаления и способствующие регенерации поврежденной ткани [9]. Показано, что этот мукополисахарид, связываясь со многими белками, вовлеченными в различные стадии воспалительного каскада, проявляет множество эффектов, в том числе: стимулирует фибринолитическую и антикоагулянтную активность, ингибирует рекрутирование провоспалительных клеток в очаг повреждения и адгезию нейтрофилов к эндотелиальным клеткам сосудов, а также стимулирует ангиогенез [10; 11].
Участие ТК в регенерации органов после воздействия различных стрессорных повреждающих факторов, и в том числе гипотермии, активно изучается [12-14]. В то же время функциональная активность ТК в адаптации и регенерации печени после воздействия холодового стресса изучена недостаточно [15].
Целью работы было исследование количества и состояния тучных клеток в печени экспериментальных животных после воздействия однократной глубокой иммерсионной гипотермии.
Материалы и методы исследования. Исследование выполнено на кафедре судебной медицины имени профессора В.Н. Крюкова и патологической анатомии с курсом ДПО ФГБОУ ВО «АГМУ» Минздрава России. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «АГМУ» Минздрава России (протокол № 3 от 30.10.2024 г.). Эксперимент выполнен на 30 6-месячных здоровых крысах-самцах Wistar с массой тела 255±15 граммов, выращенных в виварии Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук» (г. Новосибирск, Российская Федерация). Глубокую иммерсионную гипотермию (ГИГ) моделировали, помещая животных в индивидуальных клетках в воду температурой 5 °С, при температуре окружающего воздуха 7 °С. Критерием достижения глубокой степени иммерсионной гипотермии являлась ректальная температура 20-25 °С. Время экспозиции в среднем составляло 40±7 мин. Животные были подвергнуты рандомизации с выделением 5 экспериментальных групп по 5 крыс: 1-я группа – животные выводились из эксперимента декапитацией сразу после прекращения охлаждения; 2-я группа – через 2 суток; 3-я группа – через 7 суток; 4-я группа – через 14 суток и 5-я группа – через 30 суток. Животных умерщвляли цервикальной дислокацией. В качестве наркоза перед цервикальной дислокацией применяли хлороформ. Группой контроля служили 5 интактных животных.
Для гистологического исследования образцы ткани печени забирались из правой боковой, левой боковой, правой центральной и левой центральной долей. Фиксировали фрагменты печени в 10% нейтральном формалине и жидкости Карнуа в течение 24 часов, затем в автомате TISSUE-TEK VIPTM6 (Sakura, Япония) осуществляли проводку материала по изопропиловому спирту и просветляли в ксилоле. Заливку в парафин осуществляли в станции парафиновой заливки TISSUE-TEK TEC 5 (Sakura, Япония). Для заливки использовали парафин Histomix (BioVitrum, Россия). Серийные срезы толщиной 5–7 мкм изготавливали на роторном микротоме Accu-Cut SRM (Sakura, Япония), окрашивали гематоксилином и эозином в автомате TISSUE-TEK Prisma (Sakura, Япония) и заключали под пленку в автомате TISSUE-TEK Film (Sakura, Япония).
С целью идентификации ТК использовали окраску препаратов толуидиновым синим (BioVitrum, Россия), согласно рекомендациям фирмы-производителя. Для оценки плоидности гепатоцитов после кислотного гидролиза препараты окрашивали по Фельгену. Высчитывали средний индекс накопления ДНК (ИНДНК) в 25–30 гепатоцитах. Фотографирование препаратов, а также морфометрию гепатоцитов, ТК и плоиднометрию проводили с использованием комплекса визуализации МC-LCD 4K (Россия), микроскопа «Микмед-6» (АО «ЛОМО», Россия) и программы «ВидеоТест-Морфология 5.2.» (ООО «Видеотест», Россия). Подсчет плотности распределения ТК в ткани печени осуществляли в программе UTHSCSA Image Tool 3.0 (разработанной в University of the Texas Health Science Cennter of San Antonio, Texas) в 10 полях зрения (площадь поля зрения составляла 0,12 мм²) при увеличении микроскопа в 400 раз. По морфологическим критериям в процентном отношении подсчитывали недегранулированные (компактные) формы и клетки в состоянии дегрануляции (в том числе в состоянии лизиса). Для определения степени зрелости ТК гистологические срезы окрашивали последовательно 1%-ным раствором альцианового синего на 3%-ной уксусной кислоте (рН 3,2) и раствором 0,5%-ного сафранина в 0,1 N HCl (рН 1,5) и оценивали число незрелых альцианположительных (альциан +), промежуточных, содержащих синие и красные гранулы (альциан-сафранин ++), и зрелых сафранинположительных (сафранин +) форм ТК.
Полученный информационный массив данных обрабатывали при помощи статистического пакета Statistica 12.0 (StatSoft, USA). Различия признавались статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение. При микроскопическом исследовании печеночные дольки имели многоугольную форму, были окружены умеренно выраженной соединительной тканью, границы долек определялись чётко. Гепатоциты выглядели полиморфными: они были округлой, овальной или кубической формы. Средняя площадь цитоплазмы гепатоцитов составила 470,7±13,8, площадь ядра – 33,8±1,7 мкм², ИНДНК - 3,9±0,2 (табл. 1).
ТК в печени интактных крыс располагались преимущественно в портальных трактах около сосудов и желчных протоков. Они обнаруживались, как правило, поодиночке и имели округлую форму (рис. 1).
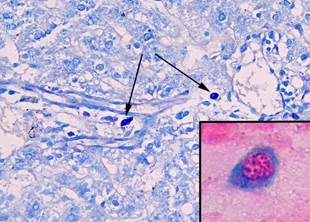
Рис. 1. Тучные клетки в печени интактных животных. При окраске толуидиновым синим тучные клетки небольшого размера с компактным расположением гранул (показаны стрелками), увеличение х 400. В рамке на большом увеличении незрелая тучная клетка (цитоплазма окрашена альциановым синим в синий цвет), фрагмент микрофотографии увеличен с помощью программного обеспечения, окраска альциановым синим – сафранином
Сафранин + ТК при окраске альциановым синим – сафранином обнаружены не были, альциан-сафранин ++ ТК было 27,4 ± 8,5%, а альциан + ТК было 72,6 ± 8,5%. Среднее количество ТК составило 1,2 ± 0,2 в 10 полях зрения, средняя площадь ТК была равна 34,0 ± 0,7 мкм². Количество ТК с компактным расположением гранул составило 83,2 ± 0,3%, а в состоянии дегрануляции было 16,8 ± 0,5% (табл. 2, 3).
Таблица 1
Морфометрические параметры гепатоцитов в зависимости от срока проведения однократной глубокой иммерсионной гипотермии (M±m)
|
Срок эксперимента
|
Морфометрические параметры гепатоцитов |
||
|
Площадь ядра (мкм2) |
Площадь цитоплазмы (мкм2) |
ИНДНК (с) |
|
|
Интактные животные (1) |
33,8±1,7 |
470,7±13,8 |
3,9±0,2 |
|
Сразу после гипотермии (2) |
26,5±1,7 |
364,4±18,9 |
3,2±0,2 |
|
Через 2 дня (3) |
45,0±1,7 |
501,7±40,8 |
5,7±0,2 |
|
Через 7 дней (4) |
100,3±6,3 |
394,2±10,8 |
9,3с±0,2 |
|
Через 14 дней (5) |
67,2±4,2 |
425,3±40,1 |
5,7с±0,2 |
|
Через 30 дней (6) |
63,9±3,5 |
479,4±31,3 |
4,5с±0,2 |
Примечание: Р для площади ядра -Р1-2 = 0,004; Р2-3 = 0,004; Р3-4 = 0,0000001; Р4-5 = 0,0000001; Р5-6 =0,4;
Р для площади цитоплазмы ядра -Р1-2 = 0,0002; Р2-3= 0,0002; Р3-4 = 0,007; Р4-5 = 0,4; Р5-6 =0,3.
Р для ИНДНК -Р для ИНДНК -Р1-2 = 0,01; Р2-3 = 0,0000001; Р3-4 = 0,0000001; Р4-5 = 0,001; Р5-6 =0,0001.
Таблица 2
Характеристика тинкториальных особенностей тучных клеток в зависимости от срока эксперимента (M±m)
|
Срок эксперимента |
Альциан (+) ТК (%) |
Альциан- сафранин ТК (++) (%) |
Сафранин (+) ТК (%) |
|
Интактные животные (1) |
72,6±8,5 |
27,4±8,5 |
- |
|
Сразу после гипотермии (2) |
43,1±12,4 |
24,8±9,7 |
32,1±12, 4 |
|
Через 2 дня (3) |
- |
27,8±8,7 |
72,2±8,7 |
|
Через 7 дней (4) |
7,9±3,7 |
22,6±7,0 |
69,4±8,7 |
|
Через 14 дней (5) |
10,0±4,7 |
22,2±8,1 |
67,8±10,5 |
|
Через 30 дней (6) |
32,7±5,1 |
56,3±5,2 |
10,9±3,8 |
Примечание: Р для альциан + ТК – Р1-2 = 0,05, Р2-4= 0,003; Р4-5= 0,9; Р5-6 =0,02;
Р для альциан-сафранин ++ ТК –Р1-2 = 0,8, Р2-3= 0,8; Р3-4= 0,6; Р4-5= 0,9; Р5-6=0,001;
Р для сафранин + ТК – Р2-3= 0,00001; Р3-4 = 0,0001; Р4-5 = 0,9; Р5-6 =0,01.
Таблица 3
Количество, площадь и состояние тучных клеток в зависимости от срока эксперимента (M±m)
|
Срок эксперимента |
Параметры тучных клеток |
|||
|
Количество ТК |
Количество компактных форм ТК (%) |
Количество ТК в состоянии дегрануляции (%) |
Площадь ТК (мкм2) |
|
|
Интактные животные (1) |
1,2±0,2 |
83,2±0,3 |
16,8±0,5 |
34,0±0,7 |
|
Сразу после гипотермии (2) |
4,0±0,5 |
64,5±5,1 |
35,5±5,1 |
40,2±3,2 |
|
Через 2 дня (3) |
10,2±1,4 |
54,4±0,9 |
45,6±0,9 |
51,5±1,9 |
|
Через 7 дней (4) |
10,8±0,9 |
43,2±1,9 |
56,8±0,19 |
73,3±3,2 |
|
Через 14 дней (5) |
9,0±1,4 |
66,7±3,1 |
33,3±3,1 |
57,9±2,3 |
|
Через 30 дней (6) |
4,5±0,6 |
72,6±4,6 |
27,4±4,6 |
47,9±2,8 |
Примечание: Р для числа ТК – Р1-2 = 0,0001, Р2-3 = 0,0000001; Р3-4 = 0,9; Р4-5 = 0,7; Р5-6 =0,000001;
Р для площади ТК – Р1-2 = 0,04, Р2-3 = 0,0001; Р3-4 = 0,0001; Р4-5 = 0,0001; Р5-6 =0,000001;
Р для числа компактных ТК – Р1-2 = 0,02; Р2-3 = 0,03; Р3-4 = 0,01; Р4-5 =0,001, Р5-6 = 0,03;
Р для числа ТК в состоянии дегрануляции – Р1-2 = 0,01; Р2-3 = 0,01; Р3-4 = 0,001; Р4-5 =0,001, P5-6 = 0,1.
Сразу после проведения однократной глубокой иммерсионной экспериментальной гипотермии (ГИГ) печеночные дольки имели многоугольную форму, границы их были видны нечётко. Гепатоциты были округлой или овальной формы и резко уменьшены в размерах. Средняя площадь цитоплазмы гепатоцитов по сравнению с интактными животными уменьшалась в 1,3 раза (p = 0,0002) и составила 470,7±13,8 мкм², площадь ядра была меньше в 1,3 раза (p = 0,004) (26,5±1,7 мкм²), ИНДНК снижался в 1,2 раза (p = 0,02) (3,2±0,2) (табл. 1). Число альциан + ТК уменьшалось в 1,7 раза (p = 0,05), количество альциан-сафранин ++ ТК снижалось до 24,8±9,7%, и появлялись сафранин + ТК (32,1±12,4%) (рис. 2).
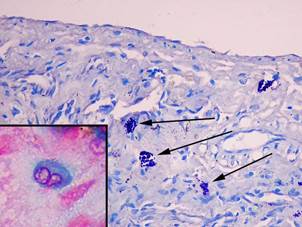
Рис. 2. Тучные клетки в печени крыс сразу после однократной ГИГ. При окраске толуидиновым синим тучные клетки в состоянии дегрануляции (показаны стрелками), увеличение х 400. В рамке незрелая тучная клетка (цитоплазма окрашена альциановым синим в синий цвет), фрагмент микрофотографии увеличен с помощью программного обеспечения, окраска альциановым синим – сафранином
Среднее число ТК в 10 полях зрения в ткани печени возрастало в 3,3 раза (p = 0,0001), средняя площадь ТК увеличивалась до 40,2±3,2 мкм² (p = 0,04), количество клеток в состоянии дегрануляции возрастало в 2,1 раза (p = 0,01), а содержание компактных форм уменьшалось в 1,3 раза (p = 0,02) (табл. 2, 3).
На 2-е сутки после начала эксперимента ткань печени находилась в состоянии умеренно выраженного отека, в гепатоцитах отмечались явления мелкокапельной жировой дистрофии. Гепатоциты имели полиморфную форму, их ядра увеличивались в размерах в 1,7 раза (p = 0,004) до 45,0±1,7 мкм², ИНДНК в ядрах увеличивался в 1,8 раза (р = 0,0000001) до 5,7с±0,2, также в 1,4 раза (p = 0,0002) возрастала площадь цитоплазмы до 501,7±40,8 мкм² (табл. 1).
Альциан + ТК обнаружены не были, число альциан-сафранин ++ ТК возрастало до 27,8±8,7% (p = 0,8), а содержание сафранин + ТК увеличивалось в 2,25 раза (p = 0,00001). Среднее число ТК в 10 полях зрения возрастало в 2,55 раза (p = 0,0000001), средняя площадь их увеличивалась в 1,3 раза, содержание клеток в состоянии дегрануляции было больше в 1,3 раза (p = 0,0001), а число компактных форм уменьшалось в 1,2 раза (p = 0,03) (табл. 2, 3).
На 7-е сутки эксперимента гепатоциты приобретали полиморфную форму и площадь их значительно возрастала. Средняя площадь ядра по сравнению с предыдущим сроком эксперимента была больше в 2,2 раза (p = 0,0000001) (100,3±6,3 мкм²), площадь цитоплазмы на этом сроке эксперимента несколько уменьшалась (в 1,3 раза) (p = 0,02) и составила 394,2±10,8 мкм², а ИНДНК увеличивался до 9,3с±0,2 (p = 0,0000001) (табл. 1).
Число альциан + ТК составило 7,9±3,7%, число альциан-сафранин ++ ТК уменьшалось до 22,6±7,0% (p = 0,6), а содержание сафранин + ТК незначительно снижалось до 69,4±8,7% (p = 0,0001). Среднее число ТК в 10 полях зрения составило 10,8±0,9 (p = 0,9), средняя площадь и число клеток в состоянии дегрануляции возрастало в 1,4 раза (p = 0,0001) и 1,25 раза (p = 0,001) соответственно, а содержание компактных форм ТК уменьшалось в 1,3 раза (p = 0,01) (рис. 3, табл. 1, 2).
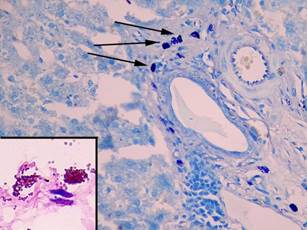
Рис. 3. Тучные клетки в печени крыс на 7-й день эксперимента. При окраске толуидиновым синим большое число тучных клеток в портальном тракте (показаны стрелками), увеличение х 400. В рамке на большом увеличении сафранин+ клетки в состоянии дегрануляции, фрагмент микрофотографии увеличен с помощью программного обеспечения, окраска альциановым синим – сафранином
На 14-е сутки эксперимента по сравнению с 7-м днем отмечали слабо выраженные явления отека, и гепатоциты приобретали округлую форму. Средняя площадь ядра уменьшалась в 1,5 раза (p = 0,0000001) и составила 67,3±4,2 мкм², площадь цитоплазмы гепатоцитов увеличивалась до 425,3±40,1 мкм² (p = 0,4), а ИНДНК уменьшался до 5,7±0,2 (p = 0,001) (табл. 1).
Число альциан + ТК несколько увеличивалось до 10,0±4,7% (p = 0,9), число альциан-сафранин ++ ТК практически не изменялось (22,2±8,1%) (p = 0,9), а содержание сафранин + ТК уменьшалось до 67,8±10,5% (p = 0,9). Среднее число ТК в 10 полях зрения уменьшалось до 9,0±1,4, средняя площадь ТК снижалась в 1,3 раза (p = 0,0001), число клеток в состоянии дегрануляции было меньше в 1,7 раза (p = 0,001), а содержание компактных форм возрастало в 1,5 раза (p = 0,001) (рис. 4, табл. 2, 3).
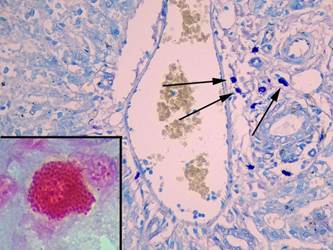
Рис. 4. Тучные клетки в печени крыс на 14-й день эксперимента. При окраске толуидиновым синим видно большое число тучных клеток в портальном тракте (показаны стрелками), увеличение х 400. В рамке на большом увеличении компактная сафранин+клетка, фрагмент микрофотографии увеличен с помощью программного обеспечения, окраска альциановым синим – сафранином
На 30-е сутки по сравнению с 14-м днем размеры ядра и цитоплазмы изменялись незначительно, а гистологическое строение печени было приближено к норме, но ИНДНК в ядрах оставался увеличенным и составил 4,5с±0,2 (р = 0,0001) (табл. 1).
По сравнению с 14-м днем число альциан + ТК возрастало в 3,3 раза (р = 0,02), количество альциан-сафранин ++ ТК увеличивалось в 2,5 раза (р = 0,001), а содержание сафранин + ТК уменьшалось в 6,2 раза (р = 0,01). Среднее число ТК в 10 полях зрения ТК уменьшалось в 2 раза (р = 0,000001) до 9,0±1,4, средняя площадь ТК снижалась в 1,2 раза (p = 0,000001), число клеток в состоянии дегрануляции было меньше в 1,2 раза (р = 0,000001), а содержание компактных форм возрастало до 72,6±4,6% (р = 0,03, табл. 2, 3).
Результаты проведенного исследования показали, что тучноклеточная популяция печени интактных крыс контрольной группы исследования была представлена небольшим количеством преимущественно компактных форм ТК, клетки в состоянии дегрануляции составили 16,8±0,5%, что соответствует данным литературы [16]. При этом преобладали альциан + ТК (72,6±8,5%), которые, по литературным данным, являются незрелыми формами ТК и мигрируют в органы из сосудов микроциркуляции [17]. Возможно, также наличие большого числа незрелых форм связано с низким темпом созревания ТК или низким уровнем факторов, стимулирующих их созревание у крыс.
Гипотермия оказывала повреждающее действие на ткань печени: площадь ядра, цитоплазмы и индекс ДНК гепатоцитов при этом резко уменьшались, что было обусловлено спазмом сосудов, централизацией кровообращения, выключением печени из кровотока и гипоксией. По данным литературы, гипоксия активирует ТК, повышает их миграцию, созревание и дегрануляцию [18]. В нашем исследовании сразу после воздействия гипотермии реакция ТК на холодовой стресс характеризовалась увеличением числа ТК, возрастанием альциан-сафранин ++ форм ТК (что свидетельствует о созревании незрелых ТК и накоплении ими гепарина, который необходим для регенерации клеток печени). Дегрануляция ТК также возрастала.
На 2-й день эксперимента отмечали начало адаптационных компенсаторно-приспособительных процессов в ткани печени: размеры ядер гепатоцитов возрастали в 1,7 раза, а пролиферация клеток, по данным исследования ИНДНК, возрастала в 1,8 раза. На этом этапе эксперимента число сафранин+ ТК было наибольшим, количество альциан-сафранин++ клеток продолжало возрастать, а альциан+ клеток отсутствовали, число клеток в состоянии дегрануляции возрастало.
На 7-й день эксперимента активные адаптивные регенераторные процессы в ткани печени достигали максимума, что соответствует данным литературы, полученным на других моделях [19]. По сравнению с 1-м днем эксперимента площадь ядер гепатоцитов возрастала в 3,8 раза, а ИНДНК увеличивался в 2,9 раза. На этом сроке эксперимента число и площадь ТК были наибольшими, что, по-видимому, было связано с их высокой синтетической активностью. Сафранин+ ТК было 67,8±10,5%, альциан-сафранин++ клеток было 22,6±7,0%, а альциан+ клеток было лишь 7,9±3,7%, возможно, данные ТК являлись незрелыми формами, которые мигрировали в ткань печени из кровяного русла.
Через 14 дней адаптивные процессы стихали, уменьшались размеры ядер гепатоцитов в 1,5 раза и ИНДНК в 1,6 раза. Тинкториальные особенности ТК изменялись незначительно, что свидетельствует об активности ТК на фоне продолжения снижения регенераторных компенсаторно-приспособительных процессов.
На 30-й день эксперимента сафранин+ ТК было лишь 10,9±3,8%, а число альциан-сафранин++ клеток было наибольшим (56,3±5,2%). Нельзя исключить, что данный феномен связан с обратным процессом перехода сафранин+ форм ТК через альциан-сафранин++ формы в альциан+ ТК, которые синтезируют слабо сульфатированные гликозаминогликаны.
Таким образом, выявленные количественные изменения, а также изменения тинкториальных особенностей тучноклеточной популяции после воздействия однократной ГИГ являются следствием регенераторных и адаптивных компенсаторно-приспособительных процессов.
Заключение. Таким образом, выявленные изменения количества и морфологии тучных клеток в печени крыс после однократной глубокой иммерсионной гипотермии заключаются в увеличении как общего количества ТК, так и ТК в состоянии дегрануляции. При этом происходит постепенное замещение альциан+ на сафранин+ ТК. Подобная динамика ТК, скорее всего, является следствием регенераторных и адаптивных компенсаторно-приспособительных процессов.
Конфликт интересов
Благодарности
Финансирование
Библиографическая ссылка
Долгатова П.А., Калин Д.А., Бобров И.П., Долгатов А.Ю., Лепилов А.В., Корсиков Н.А., Долгатова Е.С., Лушникова Е.Л., Бакарев М.А. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ КОЛИЧЕСТВА И СОСТОЯНИЯ ТУЧНЫХ КЛЕТОК ПЕЧЕНИ КРЫС ПРИ ГИПОТЕРМИИ // Современные проблемы науки и образования. 2025. № 6. ;URL: https://science-education.ru/ru/article/view?id=34330 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34330



