Введение. В мире ежегодно регистрируется более 325 000 новых случаев и 57 000 летальных исходов меланомы кожи – агрессивной злокачественной опухоли нейроэктодермального происхождения [1]. Эта нозология является одной из наиболее опасных среди онкологических патологий, характеризуется низкой 5-летней выживаемостью, эффективностью стандартной терапии, в которую входят ингибиторы BRAF/MEK - дабрафениб и траметиниб, и ростом заболеваемости (прогнозируемое увеличение на 25% к 2034 г.) [2-4].
Протеинкиназа BRAF является частью сигнального пути RAS-RAF-MEK-ERK (MAPK). Молекулярные ингибиторы регулярно одобряются Управлением по контролю за продуктами и лекарствами (FDA) для лечения опухолей, и большинство из них нацелены на подавление пролиферации и метаболизма опухолевых клеток. Путь RAS–RAF–MEK–ERK является консервативным сигнальным путем, который играет жизненно важную роль в выживании и дифференцировке клеток. Аберрантная активация сигнального пути RAS–RAF–MEK–ERK вызывает опухоли. Около 33% опухолей содержат мутации RAS, в то время как 8% опухолей вызваны мутациями RAF. За последние десятилетия были приложены большие усилия для воздействия на этот сигнальный путь для лечения рака [5]. Мутации BRAF приводят к активации сигнального пути MAPK, и вследствие этого происходит стимуляция пролиферации, подавление апоптоза и неопластическая трансформация. Выявление мутаций в этом гене служит показанием к назначению BRAF-ингибиторов.
Открытие роли пути RAS/RAF/MEK/ERK в меланомогенезе открыло новую эру в лечении этой опухоли. Вемурафениб был первым специфическим ингибитором киназы, одобренным для терапии меланом, содержащих мутации, активирующие BRAF, за ним последовали дабрафениб и энкорафениб. Однако, несмотря на превосходные результаты ингибиторов киназы первого поколения в комбинации с ингибиторами MEK с точки зрения скорости ответа, средняя продолжительность ответа была короткой из-за генетических и эпигенетических механизмов резистентности [6].
Важно понимать, что и другие молекулярно-генетические аномалии (кроме мутаций в генах сигнального пути MAPK) могут приводить к стимуляции клеточного деления и неопластической трансформации, в то числе вариации копийности генов (CNV) [4]. Вариация числа копий генов (CNV, copy number variation) - особый тип полиморфизмов, изменяющий количество копий определенного генетического локуса и, соответственно, его экспрессию. Исследователями накоплены значительные объемы данных о копийности генов сигнального пути MAPK в клетках опухолей [4; 7]. Так, например, высокая экспрессия мРНК BRAF, а также высокий уровень числа копий этого гена связаны с поздними стадиями опухоли и неблагоприятным прогнозом при раке молочной железы [8]. А изменение числа копий генов BRAF и NRAS играет неотъемлемую роль в патогенезе меланомы [9].
Исходя из описанного выше целью исследования стало изучение особенностей копийности некоторых генов сигнальных путей MAPK и PI3K при меланоме кожи, связанных с эффективностью терапии BRAF/MEK-ингибиторами.
Материалы и методы исследования
На биоинформационном этапе исследования был выполнен анализ открытой базы данных TCGA (The Cancer Genome Atlas, https://www.cancer.gov/ccg/research/genome-sequencing/tcga), содержащей информацию о 470 больных меланомой (n=470), для выявления особенностей аномальной копийности генов в меланоме кожи, ассоциированных с эффективностью терапии BRAF/MEK-ингибиторами. Данные о числе копий генов были получены из Genomic Data Commons Data Portal (https://portal.gdc.cancer.gov/) с помощью TCGABiolinks (R v.4.0.0, Rstudio). Алгоритм GISTIC был использован для обнаружения областей генома, размер которых значимо изменялся в ряде опухолевых образцов [9; 10].
Для экспериментальной части исследования использовали срезы тканей из FFPE (Formalin-fixed paraffin-embedded)-блоков 317 больных меланомой кожи и 20 образцов свежезамороженных тканей пациентов с доброкачественными новообразованиями кожи (невусы). Пациенты получали ингибиторы BRAF/MEK по следующей схеме: дабрафениб 150 мг 2 раза в сутки и траметиниб 2 мг 1 раз в сутки в течение 12 месяцев. Выявленные в TCGA аномалии CNV валидировали методом RT-PCR на 327 образцах ДНК, а также проводили секвенирование по Сэнгеру на наличие мутаций в гене BRAF у этих пациентов.
Определение уровня относительной копийности генетических локусов. Фенол-хлороформную экстракцию применяли для выделения 327 образцов ДНК, которую, после нормализации, использовали для определения относительной копийности генов методом ПЦР в режиме реального времени (Real-Time qPCR). С использованием базы данных NCBI GenBank (www.ncbi.nlm.nih.gov/genbank) и онлайн-инструмента Primer-BLAST (www.ncbi.nlm.nih.gov/tools/primer-blast) были разработаны последовательности синтетических олигонуклеотидов, в том числе для референсных локусов (ACTB, GAPDH) (табл. 1).
Таблица 1
Перечень синтетических олигонуклеотидов (праймеров) для определения числа копий генов
|
Ген |
Праймер (5'->3') |
Размер ампликона (п.о.) |
Область |
|
Grb2 |
F: AGTGGAGATGCGGGAGAAC |
~150 |
Интрон |
|
SOS1 |
F: CCTCTTTGGCTGCTGACATG |
~120 |
Интрон |
|
KRAS |
F:TGTGTGACATGTTCTAATATAGTCACATTCA |
~130 |
Промотор/ Интрон |
|
NRAS |
F: GGTGAAACCTGTTTGTTGGAC |
~110 |
Интрон |
|
BRAF |
F: TCCCTCTCAGGCATAAGGTAA |
~160 |
Интрон |
|
MEK1 |
F: CAGCTTCAGCTGTGGTTTCC |
~140 |
Интрон |
|
ERK2 |
F: TGGCTACACCTTCGACATCG |
~180 |
Интрон |
|
PKA (PRKACA) |
F: GTGGTCAGAGCCATCAAGGG |
~100 |
Интрон |
|
PI3K (PIK3CA) |
F: CCTCTTGCTGTTTCACCA |
~200 |
Интрон |
|
β-Актин (ACTB) |
F: CATGTACGTTGCTATCCAGCC |
~250 |
Кодирующая |
|
GAPDH |
F: CCTGAACGGGAAGCTCАCС R: GCAGGTTTTTCTAGACGGCAT |
~130 |
Кодирующая |
Источник: составлено авторами на основе полученных данных в ходе исследования.
Список генов, выбранных в ходе биоинформационного анализа, включал 9 локусов, сигнального пути MAPK (Grb2, SOS1, KRAS, NRAS, BRAF, MEK1, ERK2, PKA (PRKACA), PI3K (PIK3CA)). Количественная ПЦР в режиме реального времени с интеркалирующим красителем EvaGreen®Dye (Biotium, США) проводилась на термоциклере Bio-Rad CFX96.
Амплификация каждого образца осуществлялась в 3 технических повторах. При этом усредненные данные по каждому генетическому локусу нормализовались относительно усредненного показателя референсных генов: ΔC(t)=C(t)(среднее гена мишени) – C(t)(среднее геометрическое референсных генов). Копийность гена (rCN) вычисляли по формуле rC=Е-ΔC(t), где Е - эффективность реакции амплификации, рассчитанная по формуле E=10-1/h, где h - коэффициент уравнения C(t) = h•log P0 + b, полученного путем линейной аппроксимации экспериментальных данных (Е=1,98). Далее вычисляли медиану rCоп для образцов опухолевых тканей и медиану rCNн для образцов тканей доброкачественных новообразований по каждому генетическому локусу и рассчитывали кратность изменения (fold change, FC) копийности генов в опухолевых образцах по отношению к нормальным: FC = rCNопухоль/rCNне опухоль [10].
Определение соматических мутаций. Определение соматических мутаций V600E, V600К, V600R, K601E проводили методом прямого секвенирования по Сэнгеру с использованием генетического анализатора ABI Prism 3500 (Life Technologies, США). ПЦР для наработки ампликона экзона 15 гена BRAF проводилась с использованием пары праймеров F:TGCTTGCTCTGATAGGAAAATGAGA и R:AACTCAGCAGCATCTCAGGG. Амплификация проводилась по программе: 95°C - 5 мин. и 40 циклов: 95°С - 15 с, 66°С -15 с, 72°С - 20 и 72°С - 30 мин. Секвенирующая амплификация проводилась по стандартному протоколу с использованием набора ABI Prism Big Dye Terminator Cycle Sequencing Ready Reaction Kit. Ver 3.1 по программе: 96°С - 1 мин. и 30 циклов: 96°С - 10 с, 50°С - 5 с, 72°С - 4 мин. [11].
Статистический и биоинформационный анализ данных выполняли в программах и средах программирования, включая Statistica 10.0 (StatSoft, США) и Rstudio (v4.0.1). Для проверки распределения признаков на соответствие закону нормального распределения использовали критерий Колмогорова-Смирнова. Для оценки различий значений количественных показателей применяли непараметрический U-критерий Манна-Уитни. Для учета множественного сравнения использовали поправку Бонферрони [12].
Результаты исследования и их обсуждение
Проведенный биоинформационный анализ TCGA выявил изменение копийности 4500 генов у пациентов с меланомой кожи, 9 из которых (Grb2, SOS, KRAS, NRAS, BRAF, MEK1, ERK2, PKA, PI3K) были ассоциированы с эффективностью терапии ингибиторами BRAF/MEK. Прирост копий гена BRAF и MEК1 был более распространен в образцах с мутациями V600K по сравнению с V600E (p<0,001), что было подтверждено в наборе данных TCGA.
У 317 пациентов ФГБУ «НМИЦ онкологии» МЗ РФ выявлены мутации: V600E у 294, V600К – у 20, V600R – у 1, K601E - у 2 пациентов, и только у 230 из них был зафиксирован клинически значимый ответ на лечение BRAF/MEK-ингибиторами. Биологические образцы всех пациентов были проанализированы на изменение копийности генов BRAF, Grb2, KRAS, NRAS, SOS, MEK1, ERK2, PKA и PI3K. У 87 пациентов с мутацией V600E без ответа на терапию выявлено статистически значимое (p<0,001) увеличение копийности генов SOS в 4,4 раза, KRAS в 2,1 раза, BRAF в 1,9 раза, MEK1 в 2,3 раза, ERK2 в 1,9 раза и PI3K в 3,8 раза относительно доброкачественных новообразований (рис.). А также обнаружено статистически значимое (p<0,001) увеличение копийности генов SOS в 2,9 раза и PI3K в 2,2 раза у пациентов без ответа на терапию относительно группы с клинически значимым ответом.
Сигнальные пути MAPK являются эволюционно консервативными путями передачи сигнала, которые регулируют множество фундаментальных клеточных процессов, включая пролиферацию клеток, дифференциацию, старение, выживание, трансформацию и миграцию [13].
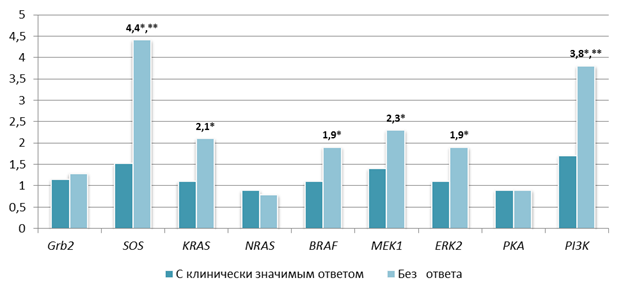
Относительная копийность генов сигнального пути MAPK в опухолевой ткани относительно ткани доброкачественных новообразований
Примечание. * - статистически значимые отличия относительно доброкачественных новообразований (p<0,001); ** - статистически значимые отличия относительно группы с клинически значимым ответом на терапию (p<0,001).
Источник: составлено авторами по результатам данного исследования.
Эти сигнальные пути характеризуются отличительной чертой линейных/векторных каскадов событий фосфорилирования, которые распространяются от клеточной мембраны к ядру. Путь MAPK активируется при взаимодействии широкого спектра внеклеточных сигналов, включая митогены, факторы роста и цитокины, со специфическими рецепторами плазматической мембраны. Это взаимодействие запускает иерархический каскад событий фосфорилирования, который в конечном итоге заканчивается активацией специфических MAP-киназ (MAPK) - их каталитическая активность определяет специфический сигнальный ответ данного пути, т. е. активацию/репрессию определенного набора генов в ядре вместе с активацией/репрессией определенных клеточных функций в цитоплазме [6]. Сигнальный путь MAPK/ERK необходим для развития и прогрессирования меланомы - мутационный ландшафт, описанный выше, показывает, что наиболее частыми движущими мутациями в меланомогенезе являются активирующие мутации этого пути; более того, реактивация сигнализации MAPK генетическими и эпигенетическими событиями является основным механизмом приобретенной устойчивости к таргетной терапии в этой опухоли [6].
В нормальных клетках млекопитающих киназы RAF (ARaf, BRaf и CRaf) являются наиболее важными эффекторами RAS [14]; дополнительными эффекторами RAS являются путь PI3K/AKT/PTEN [15] и путь Ral/RalGDS [16]. Пути PI3K и Ral часто активируются при меланоме, где они участвуют в развитии приобретенной лекарственной устойчивости, часто подрывая таргетную терапию BRAF/MEK. Более того, они в значительной степени пересекаются друг с другом и с путем MAPK [16].
В таблице 2 представлены ключевые характеристики генов сигнальных путей MAPK и PI3K/AKT/mTOR с аномальной копийностью.
Таблица 2
Характеристики генов сигнальных путей MAPK и PI3K/AKT/mTOR
|
Название |
Функция |
Роль в сигнальном пути |
|
SOS (Son of Sevenless) |
Кодирует гуанин-нуклеотид обменный фактор (GEF - Guanine nucleotide Exchange Factor) для белков семейства RAS. Связывается с Grb2 и активирует RAS, способствуя обмену GDP (неактивная форма) на GTP (активная форма) |
Непосредственный активатор RAS в ответ на стимуляцию RTK через Grb2 |
|
KRAS (Kirsten RAt Sarcoma virus oncogene homolog) |
Малая ГТФаза (G-белок) семейства RAS. В активной GTP-связанной форме взаимодействует с эффекторными белками (в первую очередь с RAF киназами), передавая сигнал дальше. Играет ключевую роль в регуляции пролиферации, дифференцировки и выживания клеток |
Ключевой переключатель сигнала от RTK/Grb2/SOS к эффекторным путям, таким как MAPK и PI3K. Часто мутирован или амплифицирован при раке |
|
BRAF (B-Raf proto-oncogene, serine/threonine kinase) |
Серин/треониновая киназа, член семейства RAF киназ. Является основным эффектором белков RAS. Активируется связыванием с RAS-GTP и последующими фосфорилированиями. Фосфорилирует и активирует MEK |
Прямой активатор MEK в каскаде MAPK. Мутация V600E является одной из самых известных в онкологии
|
|
MEK1 (MAP2K1) |
Киназа с двойственной специфичностью (фосфорилирует и серин/треонин, и тирозин). Активируется фосфорилированием со стороны RAF киназ. Фосфорилирует и активирует MAPK |
Прямой активатор MAPK (ERK) в каскаде MAPK |
|
MAPK (Mitogen-Activated Protein Kinase) или ERK2 (MAPK1) |
Серин/треониновая киназа. Активируется фосфорилированием со стороны MEK. Фосфорилирует множество цитоплазматических и ядерных мишеней (транскрипционные факторы, другие киназы, регуляторы апоптоза, цитоскелетные белки) |
Ключевой эффекторный киназный каскад. Регулирует экспрессию генов, участвующих в пролиферации, выживании, миграции, дифференцировке клеток. Конечная киназа каскада RAS-RAF-MEK-MAPK |
|
PI3K (Phosphoinositide 3-Kinase) |
Липидная киназа. Фосфорилирует фосфатидилинозитол (4,5)-бисфосфат с образованием фосфатидилинозитол трисфосфата, который служит для рекрутирования в мембрану сигнальных белков с PH-доменами (например, AKT) |
Активирует сигнальный путь PI3K-AKT-mTOR, регулирующий пролиферацию, метаболизм и подвижность клеток. Часто мутирован или амплифицирован при раке |
Источник: составлено на основании данных, представленных в источниках [14-17].
Пути PI3K и MAPK/ERK часто активируются совместно в ответ на стимуляцию факторами роста и другими внеклеточными сигналами. Они могут взаимодействовать друг с другом на различных уровнях, усиливая или регулируя клеточный ответ. Нарушения в этих путях, в частности мутации в PIK3CA, могут приводить к развитию рака, а понимание этих взаимосвязей имеет значение для разработки новых методов лечения [17].
Заключение
В ходе проведенного исследования у больных меланомой кожи с мутацией V600E в гене BRAF и отрицательным ответом на терапию ингибиторами протеинкиназ выявлено статистически значимое (p<0,001) повышенное число копий генов BRAF, SOS, KRAS, MEK1, ERK2 и PI3K в опухолевой ткани по сравнению с этим показателем в доброкачественных новообразованиях. Соответственно, у данных пациентов, независимо от наличия или отсутствия мутаций гене BRAF, может наблюдаться активация сигнального пути RAS-RAF-MEK-ERK, опосредованная увеличением числа копий генов BRAF, SOS, KRAS, MEK1 и ERK2. Таким образом, применение BRAF/MEK-ингибиторов может быть не целесообразно у данных пациентов, так же как и у больных с повышенной копийностью гена PI3K в опухолевой ткани. Рутинное исследование CNV данных генов может позволить избежать неэффективного лечения меланомы кожи дорогостоящими препаратами.
Конфликт интересов
Финансирование
Библиографическая ссылка
Кутилин Д.С., Зварич А.М., Позднякова В.В., Захарова Н.А., Хохлова О.В., Озеркова Е.А. ОСОБЕННОСТИ КОПИЙНОСТИ ГЕНОВ ПРИ МЕЛАНОМЕ КОЖИ И ЭФФЕКТИВНОСТЬ ТЕРАПИИ // Современные проблемы науки и образования. 2025. № 4. ;URL: https://science-education.ru/ru/article/view?id=34237 (дата обращения: 05.03.2026).
DOI: https://doi.org/10.17513/spno.34237



