Введение
Для эффективной остеоинтеграции, оптимизации и потенцирования остеорегенераторных качеств имплантируемые биоматериалы должны обладать рядом свойств, приоритетными из которых являются биосовместимость, пористость и механическая прочность. В ряде клинических случаев абсолютно востребованным становится и наличие антибактериальных компонентов, особенно при замещении инфицированных костных дефектов. В настоящее время антибактериальный эффект достигается, главным образом, путем введения в состав материала антибиотиков. Однако, учитывая растущую антибиотикорезистентность, актуален поиск альтернативных бактерицидных агентов. В качестве антисептического компонента в имплантационных материалах широко используется ряд металлов, в частности ионы серебра [1, 2, 3]. Однако он относится к потенциально цитотоксичным дозозависимым микроэлементам, вызывающим повышение уровня клеточного апоптоза и снижение экспрессии факторов роста эндотелия сосудов, что требует тщательной оценки и контроля уровня ионов серебра при применении его в медицинских изделиях [4, 5]. В связи с этим ведутся исследования, направленные на создание биоактивных материалов на основе биосовместимых фосфатов и силикатов кальция, допированных другими металлами, в числе которых используется цинк [6]. Согласно опубликованным данным, добавка этого металла к биоматериалу позволяет придать последнему противомикробные свойства в отношении грамотрицательных и грамположительных бактерий, стимулировать ангиогенез, обеспечить подходящую среду для роста остеобластов [7, 8, 9], а также увеличить способность к раннему формированию новой кости путем модулирования пролиферации коллагена I и продукции остеокальцина [10, 11]. Это доказывает перспективность использования металлов в качестве допантов биосовместимых материалов с целью придания им антибактериальных свойств и потенцирования остеоиндуктивных.
Вместе с этим форма и размеры имплантируемого материала являются одними из важнейших факторов технологичности его использования. Одной из наиболее удобных для манипуляций при замещении костного дефектов представляется гранулированная форма биоматериалов, позволяющая максимально полно и рационально заполнить полость дефекта, исключить дополнительную травматизацию тканей, значительно сократить, в отличие от порошковых форм, вероятность гематогенной миграции из места имплантации. На основании вышеизложенного создание новых гранулированных композитных остеоиндуктивных материалов с антибактериальными свойствами перспективно и востребовано.
Цель исследования – получение и исследование физико-химических и антибактериальных свойств гранулированных материалов, включающих фосфат кальция (гидроксиапатит, ГА, Са10(РО4)6(ОН)2), силикат кальция (волластонит, ВТ, β-СаSiO3), желатин и варьируемое количество оксида цинка (ZnO).
Материалы и методы исследования
Гранулы получали по суспензионной технологии с использованием композитного порошка, включающего 60 масс.% Са10(РО4)6(ОН)2 и 40 масс. % β-СаSiO3, синтезированного согласно патенту РФ № 2657817, и порошка оксида цинка, осажденного щелочью из водного раствора ZnCl2 и просушенного при 300°С. Порошки предварительно просеивали с помощью лабораторных сит с размерами ячеек 40 и 71 мкм. Количество ZnO варьировали в диапазоне от 0 до 25 масс.%. Для получения гранул смесь порошков ГА/ВТ и ZnO массой 2 г смешивали с 3,2–3,5 мл водного раствора желатина 15 масс.%, разогретого до температуры 40°С, и быстро перемешивали до получения однородной суспензии, которую затем прикапывали в растительное масло, перемешиваемое при помощи магнитной мешалки со скоростью 1000 об/мин. Сформировавшиеся гранулы охлаждали, отфильтровывали, отмывали от масла изопропиловым спиртом и высушивали на воздухе.
Полученные гранулы исследовали методами рентгенофазового анализа («XRD-7000», Shimadzu), ИК-Фурье-спектроскопии («ФТ-801», Simex), растровой электронной микроскопии («JCM-5700», JEOL), термогравиметрического анализа («STA-449C», Netzsch). Также выполняли ситовой анализ образцов, определяли среднюю и истинную плотность гранул, их открытую пористость.
Антибактериальные свойств ионов цинка оценивали по влиянию на рост грамположительной (St. aureus) и грамотрицательной флоры (K. Pneumoniae, P. aeruginosa), полученной методом прямого суспендирования колоний микроорганизмов в стерильном изотоническом растворе с последующим серийным разведением каждой культуры до необходимой концентрации и последовательным высевом на чашки Петри с кровяным агаром или со средой Мюллер–Хинтона. Изучение антибактериального потенциала включало цикл исследований исходного материала – водного раствора ионов цинка на твердой культуральной среде – путем подсчета количества колониеобразующих единиц (КОЕ) с расчетом среднего арифметического в зонах нанесения 0,05 мл исследуемого раствора с молярными концентрациями ZnCl2 : 0,02; 0,1; 0,2; 1,0; 2,0; 10,0; 20,0 и 200,0 ммоль/л.
Для качественной оценки антибактериального эффекта фосфат-силикатного композита были изготовлены диски диаметром 10,2±0,8 мм, содержащие оксид цинка 5 масс%, 15 масс% и 25 масс%. Диски помещали на засеянные патогенами чашки с питательным агаром, на которых после инкубации изучали бактериальный рост в зоне контакта между агаром и испытуемыми образцами, а также наличие или отсутствие зоны подавления роста бактерий вокруг испытуемых образцов согласно Межгосударственному стандарту «Определение антибактериальной активности. Диффузное испытание в чашках с агаровой средой» ГОСТ ISO 20645-2014.
Статистическую обработку результатов проводили на персональном компьютере с использованием статистических функций в Microsoft Excel 2020 и пакета прикладных программ «STATISTICA 10.0». Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты исследования и их обсуждение
По методике, описанной выше, получена серия образцов гранул, включающих 5, 10, 15, 20, 25 масс.% оксида цинка или не содержащих его. Данные количества ZnO выбраны с целью исследования широкого диапазона концентраций соединения цинка для установления его содержания, достаточного для придания материалу антибактериальных свойств. На основании результатов предшествовавшего исследования [12] порошок с пропорцией ГА/ВТ 60/40 выбран в качестве основного минерального наполнителя гранул, поскольку, в сравнении с материалами с другими пропорциями компонентов, он обладает наилучшими остеорегенераторными характеристиками.
Установлено, что в ходе синтеза формировались шарообразные частицы, имеющие различные диаметры – от 0,1 до 3 мм. Основная доля (не менее 70 масс.%) приходилась на гранулы с d = 0,5–1 мм.
а  б
б 
Рис. 1. Общий вид и поверхность гранул (а), внутренняя структура частиц (б)
С применением растровой электронной микроскопии было установлено, что гранулы имели шероховатую поверхность, на которой визуализировались поры различных размеров (рис. 1а). Аналогичные поры определялись и при анализе внутренней структуры частиц, кроме этого, гранулы были пронизаны множественными каналами, которые соединялись между собой в полости, возникшие в результате высыхания связующего (рис. 1б). Пикнометрическим методом определена открытая пористость материалов (табл. 1). Она изменялась в пределах от 45 до 61%. Наличие пор, каналов и внутренних полостей является необходимой структурной составляющей биоматериалов, которая обеспечивает их быстрое смачивание биологическими жидкостями, а также предоставляет возможность миграции остеогенных клеточных элементов и прорастания микрососудов вглубь имплантата. Кроме этого, на этапе подготовки материала его внутренний свободный объем может быть заполнен лекарственным средством или иной субстанцией с требуемыми свойствами (антибактериальными, иммуностимулирующими, остеоиндуктивными и др.).
По данным термогравиметрического анализа было установлено, что гранулы содержали порядка 3 масс.% остаточной влажности, до 18 масс.% желатина, остальное приходилось на минеральные составляющие – Са10(РО4)6(ОН)2, β-СаSiO3 и ZnO (табл. 1).
Таблица 1
Состав и некоторые свойства гранул с варьируемым содержанием оксида цинка (M ± m)
|
WZnO, % |
Wвл, масс.% |
Wжел, масс.% |
Wмс, масс.% |
ρср, г/см3 |
ρист, г/см3 |
П, % |
|
0 |
3,29 ± 0,17 |
17,81 ± 0,30 |
78,89 ± 0,47 |
1,122 ± 0,010 |
2,73 ± 0,010 |
52,7 ± 0,2 |
|
5 |
2,72 ± 0,.03 |
17,27 ± 0,04 |
80,01 ± 0,06 |
1,102 ± 0,015 |
2,696 ± 0,091 |
61,1 ± 0,7 |
|
10 |
3,55 ± 0,.04 |
15,28 ± 0,08 |
81,17 ± 0,04 |
1,312 ± 0,021 |
2,754 ± 0,052 |
51,0 ± 0,9 |
|
15 |
3,24 ± 0,.10 |
16,73 ± 0,07 |
80,03 ± 0,06 |
1,349 ± 0,032 |
2,463 ± 0,087 |
45,2 ± 1,9 |
|
20 |
3,68 ± 0,08 |
14,81 ± 0,20 |
81,51 ± 0,12 |
1,354 ± 0,015 |
2,584 ± 0,049 |
47,8 ± 1,0 |
|
25 |
2,53 ± 0,57 |
16,10 ± 0,06 |
81,37 ± 0,51 |
1,460 ± 0,027 |
2,512 ± 0,046 |
41,9 ± 1,1 |
Примечание: WZnO – массовая доля оксида цинка в исходной порошковой смеси; Wвл, Wжел, Wмс – доля остаточной влажности, желатина и минеральных компонентов (суммарно ГА, ВТ, ZnO) в составе гранул; ρср, ρист – плотность гранул средняя и истинная; П – открытая пористость.
Присутствие каждого из названных компонентов было подтверждено методами рентгенофазового анализа. На дифрактограммах гранул присутствовали пики Са10(РО4)6(ОН)2, β-СаSiO3 и ZnO. Причем интенсивность рефлексов, характерных для оксида цинка, возрастала пропорционально росту его содержания в исходной порошковой смеси, использованной для синтеза гранул, ИК-спектры гранул также характеризовались набором полос поглощения группировок, входящих в состав гидроксиапатита, волластонита и желатина [13].
Изучение антибактериального потенциала ионов цинка включало цикл исследований исходного материала – водного раствора ZnCl2 и гранулированного фосфат-силикатного композита, имеющего различные соотношения ZnO.
В первой серии эксперимента оценивался антибактериальный эффект хлорида цинка при взаимодействии с инфектантами на чашках со средой Мюллер–Хинтона, куда наносили суточные бульонные культуры S. aureus и K. pneumoniae мутностью 0,5 по Мак-Фарланду (1×108 КОЭ/мл), засевая ее газоном. Дно каждой засеянной чашки расчерчивали в соответствии с исследуемой концентрацией ZnCl2, и в каждую часть засеянной среды в порядке возрастания пипеткой наносили каплю (0,05 мл) раствора ZnCl2. В контроле вместо хлорида цинка использовали нанесение 0,05 мл 0,9%-ного раствора NaCl. Далее проводили суточную инкубацию чашек при температуре 37°C. Учитывая наличие нескольких вариантов молярной концентрации хлорида цинка в анализируемом растворе, общее количество исследований составило 56. Результатом изучения антибактериального эффекта явилось отсутствие лизиса колоний S. aureus, наблюдаемого при молярной концентрации ZnCl2 : 0,02; 0,1; 0,2; 1,0; 2,0 ммоль/л – количество колоний в зоне нанесения раствора хлорида цинка в среднем составило 250±14 КОЭ/мл и не имело статистически значимой разницы ни при использовании приведенных выше молярных концентраций хлорида цинка (р=0,82), ни с количеством колоний, выросших в контроле (р=0,68). Аналогичные данные были зарегистрированы в опытных сериях с использованием в качестве патогена K. Pneumoniae. При использовании более высоких молярных концентраций хлорида цинка антибактериальный эффект увеличивался (рис. 2).

Рис. 2. Визуализация зон задержки роста S. aureus при внесении растворов ZnCl2 в концентрациях: 2 ммоль/л, 10 ммоль/л, 20 ммоль/л и 200 ммоль/л
Данные подсчета количества выросших колоний патогенов при молярной концентрации хлорида цинка 10 ммоль/л, 20 ммоль/л и 200 ммоль/л представлены в таблице 2.
Таблица 2
Результаты исследования антибактериального эффекта водных растворов хлорида цинка (КОЕ/мл) (М±m)
|
Микроорганизм |
Количество нелизированных колоний при различных концентрациях хлорида цинка |
Количество нелизированных колоний в контроле (КОЕ/мл) |
||
|
|
10 ммоль/л |
20 ммоль/л |
200 ммоль/л |
|
|
S. aureus |
220±12 |
210±23 |
4±1* |
240±22 |
|
K. pneumoniae |
200±16 |
190±20 |
6±3* |
210±18 |
Примечание: – * статистически значимые различия с группой контроля (p<0,01)
Анализ полученных данных свидетельствовал, что при воздействии на культуру золотистого стафилококка увеличение молярной концентрации хлорида цинка до 10 ммоль/л и 20 ммоль/л несущественно увеличивало антибактериальный эффект – хотя количество выросших колоний и уменьшалось, но все же не имело статистически значимой разницы ни с контролем (p>0,05), ни со сравниваемыми количествами хлорида цинка (p>0,05). При 200 ммоль/л отмечался гораздо более выраженный эффект – сливной (полный) лизис колоний патогенной флоры, имелась статистически значимая разница с контролем (p<0,01).
Подобная картина наблюдалась и при воздействии раствора ZnCl2 на представителя грамотрицательной флоры – K. pneumoniae: отсутствие лизиса было выявлено при молярной концентрации ZnCl2 0,02; 0,1; 0,2; 1,0; 2,0 и 10 ммоль/л. При 20 ммоль/л ZnCl2 абсолютное число колоний уменьшалось, однако было сравнимо с контролем (p>0,05). И только с увеличением концентрации ZnCl2 до 200 ммоль/л был выявлен отчетливый антибактериальный эффект (p<0,01). Следует подчеркнуть, что авторами статьи не было выявлено статистически значимой разницы при воздействии на различные категории патогенных культур (грамположительные и грамотрицательные) результативной концентрации хлорида цинка в растворе (p<0,01).
После выполнения исследований эффективности исходного водного раствора ионов цинка было изучено влияние изготовленного на его основе фосфат-силикатного композита, содержащего различные масс% количества оксида цинка. Для этого было проведено следующее исследование с испытанием имплантатов в виде дисков, с содержанием ZnO в 5 масс%, 15 масс% и 25 масс% соотношениях, имеющих идентичные сферическим гранулам физико-химические характеристики. По 7 дисков с соответствующими концентрациями оксида цинка были размещены на засеянные 1,0 мл культур S. Aureus и P. Aeruginosa с титром 1×108 КОЭ/мл чашки с кровяным агаром. Оценка эффективности основывалась на отсутствии или присутствии бактериального роста под испытуемыми образцами и на возможном появлении зоны подавления роста бактерий вокруг испытуемых образцов при изучении с помощью микроскопа с 20-кратным увеличением.
Зону подавления роста бактерий Н (мм) вычисляли по следующей формуле:
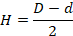
где D – общий диаметр испытуемого образца и зоны подавления, мм;
d – диаметр испытуемого образца, мм.
Антибактериальный эффект оценивался как «хороший» при отсутствии роста под образцами и наличии зоны подавления более 1,0 мм [14]; «предел эффективности» регистрировался при отсутствии зоны подавления, но при существенном подавлении роста под образцами (более двукратном снижении), и «недостаточный эффект» – при отсутствии зоны подавления и уменьшении роста под образцом менее чем на 50% (табл. 3).
Таблица 3
Размеры зон угнетения роста микробной флоры (М±m)
|
Патоген |
Зоны воздействия (мм) |
Содержание оксида цинка в образцах (масс%) |
||
|
5 |
15 |
25 |
||
|
S. aureus |
Зона контакта |
9,6±0,8 |
8,9±1,1 |
9,3±0,7 |
|
Зона подавления |
0,42±0,2 |
0,7±0,3 |
1,4±0,3 |
|
|
P. aeruginosa |
Зона контакта |
9,8±0,4 |
9,8±1,2 |
10,1±0,4 |
|
Зона подавления |
0,6±0,3 |
0,4±0,3 |
0,5±0,2 |
|
При взаимодействии дисков со средой, содержащей S. аureus, во всех случаях роста бактерий на питательной среде под образцом обнаружено не было, при этом площадь образца и площадь, в которой под образцом не было роста патогена, не имела статистически значимых различий (р>0,05). Зона подавления более 1 мм была зарегистрирована только у образца с 25 масс% содержанием оксида цинка, что позволило оценить такой антибактериальный эффект как «хороший». В остальных случаях зона подавления вокруг образцов имела неправильную округлую форму и в среднем не превышала в диаметре 1 мм, что соответствовало «пределу эффективности» антибактериального эффекта.
При исследовании антибактериального эффекта с грамотрицательной флорой (P. aeruginosa) во всех случаях отмечалось отсутствие верифицированных зон подавления (их размеры были значительно менее 1 мм). Изучение зон контакта не выявило при всех исследуемых масс% концентрациях ZnO роста колоний P. aeruginosa, при этом размеры зон угнетения роста так же, как и в случае воздействия на грамположительную флору, соответствовали площади антимикробных композитов и тоже не зависели от концентрации оксида цинка (р>0,05). Совокупность полученных данных позволила оценить антибактериальный эффект воздействия на грамотрицательную флору, как и в случае с грамположительной флорой, как «передел эффективности». Ограниченные зоны подавления во всех опытных чашках при воздействии на патогенную микрофлору, по-видимому, могут быть объяснены низкой степенью диффузии антимикробного компонента гранул в твердую культуральную среду, что соотносится с мнением разработчиков методики исследования. Таким образом, изучение антибактериального эффекта фосфат-силикатных имплантатов на грамположительную и грамотрицательную флору показало, что оптимальным антибактериальным литическим эффектом обладают биокомпозиты, содержащие 25 масс% оксида цинка. Полученные результаты служат основанием целесообразности проведения дальнейших серий исследований бактериолитического эффекта биокомпозитов, содержащих в составе ионы цинка, в жидких культуральных средах in vitro, а также продолжения исследования in vivo.
Выводы
1. Гранулированные биокомпозиты, содержащие фосфат кальция, силикат кальция и оксид цинка, обладают оптимальными физико-химическими характеристиками (соотношением исходных компонентов и связующего, формой, размерами, истинной плотностью и открытой пористостью) для использования в качестве материала в целях замещения костных дефектов различной формы и протяженности.
2. Антимикробный эффект ионов цинка в составе биокомпозитов проявляется при воздействии и на грамположительные, и на грамотрицательные культуры патогенов.
3. Антимикробный эффект водных растворов цинка (ZnCl2) на твердой культуральной среде достигается при концентрациях 200 ммоль/л.
4. Оптимальным количеством оксида цинка в гранулах, способствующим проявлению антимикробного эффекта, является 25 масс%.
5. Полученные первичные данные определяют необходимость дальнейших исследований эффективности антибактериального механизма перегрузки цинком in vivo.
Библиографическая ссылка
Дзюба Г.Г., Солоненко А.П., Шевченко А.Е., Матюшенко А.А., Полонянкин Д.А., Лысенко С.В., Волосникова А.Р., Ермолаева М.В., Рождественский А.А. ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ ГРАНУЛИРОВАННЫХ МАТЕРИАЛОВ, СОЧЕТАЮЩИХ БИОАКТИВНЫЕ И АНТИБАКТЕРИАЛЬНЫЕ КОМПОНЕНТЫ // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33908 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.33908



