Введение
С каждым годом по мере старения населения и изменения образа жизни растут показатели распространенности и смертности от злокачественных опухолей [1]. Хотя хирургические пособия остаются одним из основных методов лечения злокачественных новообразований, их эффективность снижается на поздних стадиях опухолевого процесса. К счастью, химиотерапия и целевые терапевтические препараты дают надежду таким онкологическим больным [2]. Кожная меланома (КМ) – очень агрессивное злокачественное новообразование, возникающее из меланоцитов. В промышленно развитых странах наблюдается постоянный рост заболеваемости КМ, при этом чаще всего она диагностируется у людей молодого и среднего возраста [3]. Ранняя диагностика опухоли и последующее хирургическое лечение обычно приводят к выздоровлению. КМ, которая не распознается клинически, часто проявляется на поздней стадии, практически не поддается традиционным методам лечения и имеет неблагоприятный прогноз. Для повышения эффективности используемых в настоящее время схем лечения КМ и преодоления приобретенной резистентности опухоли необходимы новые молекулярные мишени и стратегии лечения [4].
Рецептор эпидермального фактора роста (epidermal growth factor receptor – EGFR) имеет важное значение для клеточной пролиферации, дифференцировки, деления и развития клеток, в том числе злокачественных, способствуя их лекарственной устойчивости [5]. Этот рецептор был обнаружен практически во всех органах и тканях, в том числе и в нормальных меланоцитах кожи, однако экспрессия его здесь низкая [6]. Злокачественные опухоли кожи также часто характеризуются наличием EGFR. Установлено, что экспрессия EGFR повышена при некоторых формах базально-клеточной карциномы кожи [7]. Узловые КМ экспрессируют мембранную EGFR в 50% случаев, а многие образцы демонстрируют одновременную экспрессию мембранных и ядерных рецепторов. Было установлено, что EGFR экспрессируются только в подгруппе КМ с плохим прогнозом и влияют на метастатическую инвазию в сторожевые лимфатические узлы [8]. Амплификация копий генов EGFR также была связана с прогрессированием КМ и метастазированием [9]. Следовательно, EGFR может быть мишенью для таргетной терапии КМ. Немногочисленные данные о клинической эффективности ингибиторов EGFR при КМ обусловливают дальнейшее изучение способов прямого или косвенного подавления сверхэкспрессии этого рецептора у пациентов, особенно при прогрессировании онкологического заболевания [10].
Цель исследования – предварительная оценка противоопухолевой эффективности нового блокатора внутреннего домена EGFR (производного пиримидин-4-она) в эксперименте.
Материал и методы исследования Пятигорским медико-фармацевтическим институтом были предоставлены образцы нового блокатора внутреннего домена EGFR (PMSoVn) в виде мелкодисперсной коллоидной смеси на носителе (поливинилпиромидоне). Смесь имеет слабо-желтый цвет, прозрачна, водорастворима, без запаха. Синтез 2-винилензамещенных производных осуществляли путем взаимодействия соединения сулифамидного производного пиримидин-4(1Н)она с соответствующими альдегидами в среде этанола и диметилформамида по схеме синтеза (рис. 1).
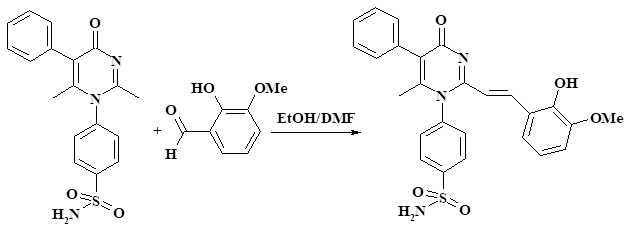
Рис. 1. Схема синтеза 2-винилензамещенных производного 4-{2-[2-(2-гидрокси-3-метоксифенил)-винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}-бензсульфамида (PMSoVn)
Исходный 4-(2,6-диметил-4-оксо-5-фенил-4H-пиримидин-1-ил) бензсульфамид в количестве 0,01 моль растворяли при нагревании в диметилформамиде. Далее прибавляли эквимолярное количество о-ванилина в 3 мл этанола. Реакционную смесь кипятили в течение 3 часов. Выделившийся при охлаждении реакционной среды осадок отфильтровывали и промывали водой. Полученный PMSoVn очищали перекристаллизацией из смеси этанола и ДМСО. Выход PMSoVn составил 68%, температура плавления 301–302°С. Вещество представляет собой желтый кристаллический порошок без запаха. ИК-спектры, см–1: 1632, 1609, 1581. Уф-спектр λmax: 214, 253, 322 нм (С-1∙10-5 моль /л в этаноле). ВЭЖХ: 99,8%. Растворим в диметилформамиде, диметилсульфоксиде, этаноле. Для улучшения растворимости PMSoVn в воде его соединяли с полимером-носителем – низкомолекулярным медицинским поливинилпирролидоном ФС 42-1194-98, а также в качестве поверхностно-активного вещества добавляли додецилсульфат-натрия.
Доклиническое изучение противоопухолевой активности PMSoVn проведено на 60 мышах линии С57BL/6, массой 25 г, которые поступили из ФГБУН «Научный центр биомедицинских технологий ФМБА» (филиал «Андреевка», Московская область). У мышей был свободный доступ к воде и пище, естественный режим освещения. Работа с животными осуществлялась в соответствии с правилами «Европейской конвенции о защите животных, используемых в экспериментах» (Директива 86/609/ЕЕС) и Международными рекомендациями по проведению медико-биологических исследований с использованием животных.
Мыши были разделены на три экспериментальные группы: основную, группу сравнения и контрольную – по 10 животных обоего пола в каждой. Всем животным перевивали меланому В16/F10 в подлопаточную область справа в разведении с физиологическим раствором 1:10 объемом 0,5 мл (штамм был получен из НМИЦ онкологии им. Н.Н. Блохина, г. Москва). Меланома В16/F10 является одной из обязательных опухолей, рекомендованной при изучении противоопухолевых действий новых фармакологических средств с противоопухолевой активностью [11, с. 640–654].
Через 6 часов после перевивки опухоли всем животным начали осуществлять введение. Мышам основной группы был введен новый блокатор PMSoVn внутримышечно в разовой дозе 0,375 мг/мышь в день (в расчете на массу мыши 18,75 мг/кг), растворенный ex tempore в 0,3 мл воды для инъекции. Животным группы сравнения перорально был введен осимертиниб (Тагрисса) – блокатор внутреннего домена EGFR – в дозе 0,86 мг/мышь в день (в расчете на массу мыши 42,86 мг/кг, исходя из рекомендаций для людей в пересчете на мышь). Животным контрольной группы вводили воду для инъекций в том же количестве и тем же путем, что и животным основной группы. Введения осуществляли ежедневно 1 раз в день в течение 4 дней. Состояние животных оценивали ежедневно, оценку динамики веса животных и объема подкожных опухолей осуществляли 2 раза в неделю на протяжении всего исследования.
Противоопухолевую эффективность новой субстанции оценивали по ТРО% – торможению роста опухоли – и УПЖ% – увеличению продолжительности жизни. Объем опухолей (V) определяли по формуле: а ˣ в ˣ с, где а, в, с – линейные размеры опухоли, измеренные в трех взаимно перпендикулярных направлениях; ТРО% рассчитывали как отношение V контроля – V опыта) к V контроля, умноженное на 100%, где V контроля – среднегрупповой объем опухоли в определенный момент времени в контрольной группе животных, V опыта – среднегрупповой объем опухоли в определенный момент времени у мышей основной группы; УПЖ% рассчитывали как отношение СПЖ опыта – СПЖ контроля) к СПЖ контроля, умноженное на 100%, где СПЖ опыта – среднегрупповая продолжительность жизни животных в опытной группе; СПЖ контроля – среднегрупповая продолжительность жизни животных в контрольной группе. Значения ТРО% ≥20–50% и УПЖ% ≥25% принимали за значимые [11, 12].
Статистическую обработку результатов проводили посредством программы Statistica 12. С помощью критерия Шапиро–Уилка оценивали нормальность распределения данных. Результаты представлены в виде среднего значения ± ошибка среднего (М±m). Для оценки значимости различий использовали t-критерий Стьюдента, критический уровень значимости принимали р<0,05.
Результаты исследования и их обсуждение Опухоль у мышей начинала визуализироваться на 1-й неделе эксперимента. У 20% самок, получавших PMSoVn, латентный период роста опухоли составил 3 дня, тогда как у остальных мышей – 7 дней. У 60% мышей контрольной группы латентный период составил 3 дня, из них было 40% самок и 20% самцов. В группе сравнения у большинства мышей латентный период составил 7 дней и только у 10% самок – 10 дней (табл. 1).
Таблица 1
Особенности латентного периода и показателей продолжительности жизни мышей (сутки) под влиянием PMSoVn в сравнении с другими экспериментальными группами
|
Группы |
Латентный период (М±m) |
Продолжительность жизни |
||
|
средняя (М±m) |
min |
max |
||
|
Самцы |
||||
|
Меланома В16 + вода |
6,20 ±0,80 |
23,60 ±1,09 |
14 |
34 |
|
Меланома В16 + осимертиниб |
7,00 ±0,0 |
26,60 ±3,20 |
21 |
39 |
|
Меланома В16 + PMSoVn |
7,00 ±0,00 |
28,80* ±2,06 |
19 |
40 |
|
Самки |
||||
|
Меланома В16 + вода |
5,40 ±0,98 |
22,80 ±1,49 |
15 |
30 |
|
Меланома В16 + осимертиниб |
7,6 ±0,6 |
26,60 ±1,51 |
16 |
32 |
|
Меланома В16 + PMSoVn |
6,20 ±0,80 |
29,25* ±2,76 |
19 |
112 1 самка жива до сих пор |
Примечание: * – статистическая значимость отличий относительно соответствующих контрольных значений (р<0,05)
Самая маленькая продолжительность жизни была у мышей контрольной группы – 2 недели (табл. 1). У мышей основной группы и группы сравнения минимальная продолжительность жизни была больше, чем без воздействия: у самок из группы сравнения – на 1 день, а у самок с PMSoVn – на 4 дня; у самцов из группы сравнения – на 4 дня, у самцов из группы с PMSoVn – на 7 дней относительно контроля. Самые маленькие значения максимальной продолжительности жизни также были у самцов и самок мышей контрольной группы – чуть более 4 недель, при этом у самок максимальная продолжительность жизни была на 4 дня короче, чем у самцов (табл. 1). На 2-м месте по максимальной продолжительности жизни располагались мыши группы сравнения – этот показатель у самцов был на 5 дней больше, а у самок – на 2 дня больше, чем у животных соответствующего пола контрольной группы; разница между самцами и самками составила 7 дней. Самая большая максимальная продолжительность жизни регистрировалась у мышей, получавших PMSoVn: у самцов – на 6 дней по сравнению с контролем, что было всего на 1 сутки больше, чем в группе сравнения, одна самка живет до сих пор (табл. 1). Причем максимальный объем опухоли у самки с максимальной продолжительностью жизни был зарегистрирован на 30-е сутки от перевивки опухоли (26-е сутки после окончания лечения) и составил 1,85 см3, после чего опухоль подверглась обратному развитию через некроз. В настоящее время подкожная опухоль не определяется. У всех животных, получавших PMSoVn, средняя продолжительность жизни была больше, чем у мышей контрольной группы: у самцов – на 17,0%, у самок – на 28,3%. Величина средней продолжительности жизни мышей обоего пола, получавших осимертиниб, занимая промежуточное положение между соответствующими значениями показателей основной и контрольной групп, значимо от них не отличалась (табл. 1). Значение УПЖ у самцов, получавших PMSoVn, составило 22,0%, у самок – 28,3%. Следовательно, только у самок мышей, получавших PMSoVn, показатель УПЖ значимо увеличивался по сравнению с контролем, поскольку был больше 25%.
Установлено, что через 7/3 дней значимых отличий по размерам опухолей между группами не было (табл. 2). Через 10/6 дней только у самок мышей, получавших PMSoVn, объем опухолевых узлов был меньше, чем у самок из других групп, – в 5,6 раза по сравнению с контрольной группой и в 3,6 раза по сравнению с группой сравнения. У самцов на этом этапе опухоли были одинакового размера во всех группах. Только в группе с PMSoVn объем опухолей у самцов был в 6,8 раза больше, чем у самок. Через 14/10 дней у самок с PMSoVn по-прежнему объем опухолевых узлов был меньше в 3,1 раза, чем у самок контрольной группы, и в 2,6 раза меньше, чем у самцов основной группы, но при этом значимо не отличался от объема опухолей у самок группы сравнения (табл. 2). Объем подкожных опухолей у самок, получавших осимертиниб, как и в основной группе, был меньше, чем в контроле, в 2,3 раза. Через 17/13 дней эта же закономерность у самок с PMSoVn сохранялась – объем их опухолей был меньше, чем у самок контрольной группы, в 3,1 раза, у самок группы сравнения – в 2,3 раза и у самцов с PMSoVn – в 2,4 раза (табл. 2). Через 21/17 дней после окончания лечения объемы опухолей у самок из группы сравнения и основной группы были меньше, чем у самок контрольной группы: в первом случае – в 2,2 раза, во втором случае – в 2,8 раза; у самцов значимых отличий между группами по этому показателю не было. Только в группе сравнения опухоли у самцов были в 1,4 раза (р<0,05) больше, чем у самок (табл. 2).
Таблица 2
Динамика подкожных опухолевых узлов меланомы В16 (сутки) под влиянием PMSoVn в сравнении с другими экспериментальными группами, М±m
|
Сутки от перевивки/ окончания лечения |
Меланома В16 + вода |
Меланома В16 + осимертиниб |
Меланома В16 + PMSoVn |
|||
|
♀ |
♂ |
♀ |
♂ |
♀ |
♂ |
|
|
7/3 |
0,09 ±0,05 |
0,06 ±0,02 |
0,0011 ±0,0009 |
0,0014 ±0,0006 |
0,05 ±0,02 |
0,025 ±0,018 |
|
10/6 |
0,28 ±0,06 |
0,42 ±0,12 |
0,18 ±0,07 |
0,26 ±0,08 |
0,05 ±0,03 р1=0,0003 р2=0,039 |
0,34 ±0,06 р3=0,016 |
|
14/10 |
1,94 ±0,42 |
3,73 ±2,10 |
0,83 ±0,22 р1=0,048 |
1,43 ±0,37 |
0,63 ±0,44 р1=0,063 |
1,64 ±0,26 р3=0,0033 |
|
17/13 |
4,04 ±0,74 |
3,18 ±0,34 |
3,04 ±0,70 |
3,81 ±0,57 |
1,29 ±0,67 р1=0,034 р2=0,015 |
3,04 ±0,44 р3=0,011 |
|
21/17 |
10,06 ±0,64 |
9,18 ±1,40 |
4,67 ±0,28 р1=0,00035 |
6,55 ±0,57 р3=0,029 |
3,55 ±1,97 р1=0,041 |
6,76 ±1,63 |
|
24/20 |
16,97 ±2,63 |
12,10 ±4,36 |
8,22 ±0,59 р1=0,0089 |
6,79 ±2,29 |
5,34 ±3,35 р1=0,0059 |
7,15 ±2,40 |
|
27/23 |
10,92 |
14,86 ±3,34 |
15,04 ±1,72 |
12,54 |
0,46 ±0,18 р2=0,0073 |
5,87 ±0,62 р1=0,048 р3=0,050 |
|
31/27 |
– |
12,54 ±2,43 |
7,5 |
18,70 |
1,04 ±0,80 |
9,24 |
|
38/34 |
– |
– |
– |
20,78 |
1,88 ±1,73 |
18,00 |
|
45/41 |
– |
– |
– |
– |
0,12 |
– |
|
48/44 |
– |
– |
– |
– |
0 жива |
– |
Примечание: Статистическая значимость отличий: р1 – относительно соответствующих значений мышей с меланомой В16 без воздействий; р2 – относительно соответствующих значений мышей с меланомой В16, получавших осимертиниб; р3 – самцов от самок в пределах одной группы (р<0,05).
Через 24/20 дней после окончания лечения у самок из основной группы и группы сравнения объемы опухолей оставались меньше, чем у самок контрольной группы, соответственно в 2,1 раза и в 3,2 раза; у самцов значимых отличий не было. Объемы опухолей у самцов и самок внутри групп не различались (табл. 2).
Поскольку через 27/23 дней в контрольной группе в живых оставалась только 1 самка, провести статистический анализ отличий по сравнению с этой группой не представлялось возможным, тем не менее, объем ее опухоли был в 23,7 раза больше, чем средний объем опухолей у самок в группе с PMSoVn, но в 1,4 раза (р<0,05) меньше, чем средний объем опухолей у самок с осимертинибом (табл. 2). Объем опухолей у самок основной группы был в 32,7 раза меньше, чем у самок группы сравнения, и в 12,8 раза меньше, чем у самцов основной группы. В группе сравнения также оставался 1 самец, поэтому и в этом случае статистический анализ выполнить было невозможно, однако объем опухоли у этого самца не отличался от среднего значения объема опухолей у самцов контрольной группы. У самцов, получавших PMSoVn, объем опухолей был в 2,5 раза меньше, чем у самцов контрольной группы (табл. 2). Через 31/27 дней в живых не осталось ни одной самки контрольной группы, а в группе сравнения была жива только 1 самка, при этом объем ее опухоли был в 7,2 раза больше, чем средний объем опухолей у самок основной группы. Объем опухоли 1 выжившего самца с PMSoVn на 31/27 и 38/34 сутки был соответственно в 8,9 раза и в 9,6 раза больше, чем средний объем опухолей у самок из этой же группы (табл. 2). На 45-е сутки от момента перевивки в живых оставалась 1 самка, получившая PMSoVn, объем ее опухоли на этом сроке составил 0,12 см3, что было в 15,7 раза меньше, чем средний объем опухолей у самок в этой же группе на предыдущем этапе исследований.
У мышей группы сравнения, получавших осимертиниб, через 7/3 дня значение ТРО было максимальным – более 90% (табл. 3). Через 10/6 дней значения ТРО в группе сравнения уменьшались по сравнению с предыдущим периодом: у самцов – на 59,6%, у самок – на 62,8%. Через 14/10 дней у самок ТРО вновь увеличивался на 20,4%, но не достигал максимального значения через 7/3 дней, у самцов величина ТРО снижалась еще больше – на 25,3% по сравнению с 10/6 сутками (табл. 3). Через 17/13 дней у самок значение ТРО вновь снижалось и становилось на 12,2% меньше, чем значение ТРО через 10/6 дней, а у самцов величина ТРО приобретала отрицательные значения, что свидетельствовало о прогрессии опухолевого процесса. Через 21/17 дней у самок группы сравнения значение ТРО вновь увеличивалось до значений через 14/10 дней. У самцов группы сравнения значение ТРО вновь становилось положительным, но не превышало 10%. Через 24/20 дней у мышей группы сравнения сохранялось значение ТРО, характерное для предыдущего периода наблюдения (табл. 3). Через 27/23 дней значение ТРО у самок приобретало отрицательную величину, становясь на 89,3% меньше, чем на предыдущем сроке наблюдения, что свидетельствовало о значительной активации опухолевого роста. У самцов через 27/23 дня величина ТРО, напротив, увеличивалась по сравнению с предыдущим периодом на 10,9%, следовательно, рост опухоли у самцов на заключительном этапе несколько замедлялся.
Таблица 3
Показатель торможения роста опухолей (ТРО, %) у мышей обоего пола под влиянием нового блокатора EGF-R
|
Группы |
Сутки от перевивки опухолей / окончания лечения |
|||||||
|
7/3 |
10/6 |
14/10 |
17/13 |
21/17 |
24/20 |
27/23 |
||
|
Меланома В16 – осимертиниб |
самки |
98,51 |
35,71 |
57,21 |
24,75 |
53,58 |
51,56 |
–37,73 |
|
самцы |
97,71 |
38,10 |
12,81 |
–25,33 |
3,11 |
5,04 |
15,9 |
|
|
Меланома В16 + PMSoVn |
самки |
45,95 |
82,14 |
67,53 |
68,07 |
64,71 |
68,53 |
95,79 |
|
самцы |
59,02 |
19,05 |
56,03 |
4,40 |
26,36 |
40,91 |
60,5 |
|
У мышей основной группы, получавших PMSoVn, значение ТРО через 7/3 дня имело меньшую величину, чем в группе сравнения: у самок – на 52,6%, у самцов – на 38,7% (табл. 3). Следовательно, на этом этапе наблюдения лучшие результаты по торможению роста опухолей отмечались у мышей, получавших осимертиниб, и худшие – у самок мышей, получавших PMSoVn, хотя и у них ТРО был более 50%, что свидетельствовало о хорошем противоопухолевом эффекте обоих препаратов через 3 дня после окончания их введения. Через 10/6 дней у самок основной группы значение ТРО увеличивалось в 1,8 раза по сравнению со значениями через 7/3 дней и становилось на 46,4% больше, чем у самок из группы сравнения, у которых отмечалось снижение этого показателя. У самцов основной группы, напротив, значение ТРО трехкратно уменьшалось по сравнению с предыдущим периодом и становилось на 63,1% меньше, чем у самок основной группы, и на 19,5% меньше, чем у самцов из группы сравнения (табл. 3). Через 14/10 суток показатель ТРО у самок основной группы снижался на 14,6% по сравнению со значениями через 10/6 дней, у самцов – увеличивался на 37%; разница между мышами разного пола с PMSoVn по ТРО составила 11,5%. Следовательно, и у самок, и у самцов мышей основной группы значения ТРО были выше, чем в группе сравнения, соответственно на 10,3% и на 43,2%. Через 17/13 дней значение ТРО у самок основной группы не отличалось от предыдущего периода исследования, а у самцов – резко уменьшалось, становясь ниже минимального значения ТРО через 10/6 дней на 14,7%. Разница между самцами и самками основной группы составила 63,7%. Тем не менее, и у самцов, и у самок с PMSoVn величина ТРО была выше, чем в группе сравнения: у самок на 43,3%, у самцов на 29,7% (табл. 3).
Через 21/17 и 24/20 дней значения ТРО у самок основной группы оставались на прежнем высоком уровне, а у самцов увеличивались по сравнению с минимальным значением через 17/13 суток: через 21/17 сутки – на 22,0%, через 24/20 сутки – на 36,5%. В результате в основной группе значения ТРО у самок были выше, чем у самцов: через 21/17 дней – на 38,4%, через 24/20 дней – на 27,6%. Значения ТРО в основной группе в эти сроки наблюдения превышали соответствующие показатели мышей из группы сравнения: у самок через 21/17 дней – на 11,1%, через 24/20 дней – на 17,0%, у самцов – на 23,3% и на 35,9% соответственно. Через 27/23 суток у самок основной группы отмечалось самое высокое значение ТРО – более 90%, у самцов – более 60%, что было больше, чем в группе сравнения (табл. 3).
Успехи молекулярной онкологии и разработка новых технологий позволили на современном этапе разработать и внедрить в онкологическую практику препараты таргетной направленности, в том числе блокаторы EGFR, которые с успехом применяются для лечения рака легкого, меланомы и некоторых других злокачественных опухолей [13]. К недостаткам блокаторов внутреннего домена EGFR можно отнести исключительно пероральный путь введения, который иногда становится невозможным из-за различных сопутствующих состояний пациентов, связанных с нарушением работы желудочно-кишечного тракта. Кроме того, все препараты с действием, направленным на подавление внутреннего домена EGFR, разработаны за рубежом. Введение санкций в отношении России делает актуальным вопрос импортозамещения лекарственных препаратов для сохранения экономического и технологического суверенитета Российской Федерации. Разработанный Пятигорским фармацевтическим институтом совместно с Ростовским НМИЦ онкологии новый блокатор внутреннего домена EGFR для парентерального введения показал свою противоопухолевую эффективность в отношении экспериментальной меланомы уже на начальном этапе доклинических исследований, что свидетельствует о перспективности его использования в качестве противоопухолевого агента для лечения кожной меланомы.
Следовательно, разработка и последующее внедрение в клиническую практику противоопухолевых препаратов, направленных на блокаду внутреннего домена EGFR, с возможностью парентерального их введения, а также синтезированных на территории Российской Федерации, являются оправданной стратегией.
Заключение Таким образом, вновь синтезированное соединение PMSoVn после 4 дней парентерального введения, показало себя более эффективным в сравнении с известным аналогом – осимертинибом, что делает его кандидатом для дальнейшего доклинического исследования с перспективой внедрения в клиническую практику. Данное исследование носило пилотный характер, считаем целесообразным увеличить длительность введения PMSoVn.
Библиографическая ссылка
Кит О.И., Кодониди И.П., Франциянц Е.М., Каплиева И.В., Глушко А.А., Трепитаки Л.К., Качесова П.С., Шейко Е.А., Шихлярова А.И., Алексеев Э.К. ПРЕДВАРИТЕЛЬНАЯ ОЦЕНКА ПРОТИВООПУХОЛЕВОЙ ЭФФЕКТИВНОСТИ НОВОГО БЛОКАТОРА РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33891 (дата обращения: 26.01.2026).
DOI: https://doi.org/10.17513/spno.33891



