Введение
Посттравматический остеоартрит представляет собой актуальную проблему современной медицины, имея высокую социально-экономическую значимость, что обусловливает большой интерес в поиске новых методов консервативного лечения данной патологии [1]. Травма выступает в качестве триггерного фактора, запускающего каскад воспалительных изменений, в том числе оксидативный стресс, способствующих формированию дегенеративно-дистрофических изменений в поврежденном суставе [2, 3]. Формирующиеся патологические изменения ведут к нарушению гистоморфометрических процессов (что проявляется дегенерацией клеточных структур хондроцитов), уменьшению их пролиферативного потенциала, утолщению синовиальной оболочки с последующим формированием необратимых фиброзных изменений в соединительнотканных структурах сустава [4, 5]. С учетом данных патогенетических механизмов закономерен вопрос о необходимости включения в схему терапии препаратов, производящих не только противовоспалительное, но и антиоксидантное действие.
Цель исследования – оценка влияния нового производного 3-гидроксипиридина (2-этил-6-метил-3-гидроксипиридиния-4-изобутилфенилпропаноат) на гистоморфометрические изменения суставных тканей при посттравматическом артрите в эксперименте.
Материалы и методы исследования
Экспериментальное исследование проводили на 59 белых беспородных крысах обоего пола, содержащихся в условиях вивария ФГБОУ ВО «Мордовский государственный университет им. Н.П. Огарёва» при температуре воздуха в помещении 22–230С и относительной влажности 40–60%. Исследование выполняли в соответствии с основными пунктами, изложенными в приказе Минздрава России от 01.04.2016 № 199н «Об утверждении Правил надлежащей лабораторной практики». Моделирование посттравматического остеоартрита осуществляли по методике Г.М. Дубровина под общим наркозом с использованием препарата «Золетил 100», вводимого внутримышечно в дозе 0,03 мл [6]. Проводили рассечение кожи, фасции и капсулы сустава с последующим введением иглы Дюфо, обточенной под углом 900, по направлению на медиальный мыщелок бедренной кости. Перфорировали суставной хрящ до упора в субхондральную кость, после чего иглу удаляли и производили послойное ушивание тканей.
Новое производное 3-гидроксипиридина (НПГ) – 2-этил-6-метил-3-гидроксипиридиния-4-изобутилфенилпропаноат – было получено путем химического синтеза в АО «Всесоюзный научный центр по безопасности биологически активных веществ», получен патент на изобретение RU № 2814495 [7]. Для сравнительной оценки эффективности НПГ были выбраны препараты ибупрофен и мексидол (2-этил-6-метил-3-гидроксипиридина сукцинат), производящие противовоспалительное и антиоксидантное действие соответственно.
Животные были разделены на 5 групп: интактная группа (n=15), имеющая здоровый сустав, и группы № 2–5, в которых осуществляли воспроизведение экспериментальной модели. Во 2-й группе (n=11) лечение не проводили. Особям 3-й группы (n=11) осуществляли внутрижелудочное (в/ж) введение ибупрофена в дозе, эквивалентной 2% показателя острой токсичности (LD50). В 4-й группе (n=11) проводили в/ж введение мексидола в дозе 5% показателя LD50. На животных 5-й группы (n=11) оценивали эффективность НПГ, вводимого в/ж в дозе, соответствующей 5% показателя LD50. Курс лечения составил 15 суток. Вывод животных из эксперимента проводили на 28-е сутки путем декапитации.
Оценку патоморфологических изменений суставного хряща и синовиальной оболочки проводили с предварительной декальцинацией этилендиаминтетрауксусной кислоты (ЭДТА), обезвоживанием в серии этанола, просветлением в ксилоле и заливкой в парафин полученных тканей с последующим окрашиванием серийных срезов гематоксилином и эозином. Исследование выполняли с использованием светового микроскопа исследовательского класса «HUMASCOPE ADVANCED LED» (Human GmbH, Германия). Морфометрическую оценку изменений суставного хряща и синовиальной оболочки проводили при увеличении препаратов в 400 раз с калибровкой изображений посредством использования объект-микрометра. Численную плотность хондроцитов определяли с применением методики Г.Г. Автандилова (1990).
Полученные морфометрические показатели обрабатывали с использованием прикладного программного комплекса SPSS Statistic 20.0 (IBM, USA) посредством однофакторного дисперсионного анализа и параметрического критерия Тьюки. Критический уровень значимости был равен 0,001.
Результаты исследования и их обсуждение. После моделирования травмы сустава в условиях эксперимента на 28-е сутки при макроскопической оценке в области нанесения травмы определяли фиброзную ткань, распространяющуюся за пределы дефекта. Вне дефекта обнаружены узуры, доходящие до глубокой хрящевой зоны. В поверхностной зоне визуализировалась потеря структуры бесклеточной пластики. В промежуточной зоне определяли деструкцию хрящевых клеток. В субхондральной кости визуализировались остеолитические очаги, на фоне которых определяли начальные признаки остеосклероза (рис. 1).
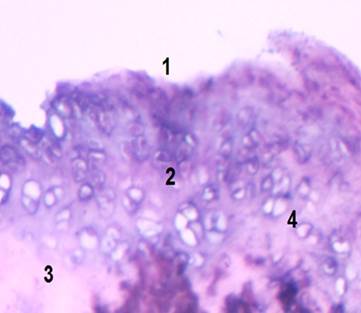
Рис. 1. Суставной хрящ коленного сустава крысы опытной серии без лечения.
Окраска гематоксилином и эозином. Увеличение×100. 1 – разрушение бесклеточной пластинки с образованием узур; 2 – нарушение зональной структуры хряща, исчезновение колонковых структур; 3 – фибриллярные бесклеточные участки промежуточной зоны; 4 – очаги некроза, пустые клеточные лакуны
При морфометрическом анализе выявляли достоверное увеличение общей толщины хряща на 35,9% (р<0,001) относительно аналогичного показателя интактных особей. При этом отмечали утолщение поверхностной, промежуточной и глубоких хрящевых зон на 107,1% (р<0,001), 31,8% (р<0,001) и 25,5% (р<0,001) соответственно по отношению к референсным значениям с нарушением их цитоархитектоники. Данные изменения обусловлены дезорганизацией межклеточного матрикса в сочетании с гипергидратацией основного вещества и коллагеновых волокон. Кроме того, при оценке состояния синовиальной оболочки определяли увеличение ее толщины на 173,0% (р<0,001) относительно интактных особей, что свидетельствует о хроническом синовите и начальных процессах фиброзирования (таблица).
Влияние нового производного 3-гидроксипиридина при экспериментальном посттравматическом артрите на морфометрические показатели суставного хряща и синовиальной оболочки
|
Показатель |
Интактные животные (n=15) |
Опытные серии |
|||
|
Контроль (n=11) |
Ибупрофен (n=11) |
Мексидол (n=11) |
Соединение 1 в/ж (n=11) |
||
|
Общая толщина хряща, мкм |
181,54±2,03 |
246,36±2,32* |
219,61±2,54*А |
198,58±1,73*^ А |
187,36±2,10*^ АВ |
|
Поверхностная зона, мкм |
23,15±1,59 |
47,96±1,58* |
42,69±0,83*А |
30,98±0,61*^ А |
24,76±0,98^ АВ |
|
Промежуточная зона, мкм |
86,24±1,93 |
113,63±1,77* |
99,27±1,05*А |
95,19±1,10*^ А |
89,35±1,98*^ АВ |
|
Глубокая зона, мкм |
69,10±0,97 |
86,71±1,42* |
76,68±1,64*А |
72,29±1,41*^ А |
70,33±0,85^ АВ |
|
Толщина покровного слоя синовиальной оболочки, мкм |
17,56±0,55 |
47,94±0,82* |
34,54±1,05*А |
32,81±0,73*^ А |
18,65±0,42^ АВ |
|
Численная плотность хондроцитов, мм2 |
218,98±3,84 |
171,80±1,70* |
191,48±1,51*А |
233,33±2,49*^ А |
238,90±2,14*^ А |
Примечание: * – достоверность различия к норме (p<0,001); А – достоверность различия по отношению к показателям серии без лечения (p1<0,001); ^ – достоверность различия по отношению к ибупрофену (p2<0,001); В – достоверность различия по отношению к мексидолу (p3<0,001) (одномерный дисперсионный анализ (ANOVA), критерий Тьюки).
В 3-й группе при применении ибупрофена при микроскопии суставного хряща визуализировалось отсутствие его четкой зональности. Так, в поверхностной зоне отмечали явления деструкции бесклеточной пластинки, определяли глубокие узуры, доходящие до промежуточной зоны, в которой выявляли беспорядочно расположенные хондроциты, запустевшие лакуны и сформированные участки бесклеточных зон. В глубокой зоне сохранялись хондроциты с признаками дегенеративных изменений. В области субхондральной кости определяли чередование остеолитических очагов с зонами остеосклероза, имеющими ограниченный характер. В капсуле и синовиальной оболочке находили скопление клеток макрофагального типа, отмечалась избыточная пролиферация кровеносных сосудов с утолщением их стенок. В области покровного слоя визуализировались синовиоциты с признаками дегенеративных изменений (рис. 2).
При морфометрическом исследовании отмечали некоторое уменьшение толщины общей толщины хряща на 10,9% (р1<0,001) относительно серии контроля. Кроме того, определяли увеличение численной плотности хондроцитов до 191,48±1,51 в 1 мм2, что на 11,5% (р1<0,001) выше аналогичного показателя контрольной серии, но на 12,6% (р<0,001) ниже серии интактных животных. Толщина покровного слоя синовиальной оболочки уменьшалась на 28% (р<0,001) относительно серии без лечения (таблица).
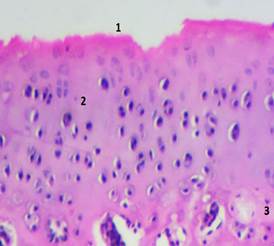
Рис. 2. Суставной хрящ коленного сустава крысы при применении ибупрофена.
Окраска гематоксилином и эозином. Увеличение×100. 1 – повреждение поверхностной зоны хряща; 2 – пустые лакуны в поверхностной и промежуточной зоне; 3 – разрастание фиброзной ткани
В 4-й серии при применении мексидола обнаруживали ограничение процессов вторичных деструктивных изменений, торможение процессов разрастания тканей мезенхимального происхождения. Однако в поверхностной хрящевой зоне были определены явления деструкции бесклеточной пластинки. Отмечали сохранение зональной структуры хрящевого матрикса в промежуточной и глубокой зонах, а также уменьшение общего числа разрушенных и дегенеративно-измененных хондроцитов. Кроме того, в субхондральной кости отсутствовали очаги остеосклероза. В промежуточной зоне на фоне применения мексидола определялись репаративные изменения, характеризующиеся увеличением количества хондроцитов и изогенных групп (рис. 3).
Морфометрическое исследование суставных тканей при применении мексидола выявило уменьшение толщины общей хрящевой зоны на 19,4% (p1<0,001) относительно особей группы контроля и на 9,6% (p2<0,001) относительно серии применения ибупрофена. Однако, несмотря на положительную динамику, сохранялось преобладание данного показателя над интактными особями на 9,4% (p<0,001). Кроме этого, при оценке толщины покровного слоя синовиальной оболочки отмечалось ее уменьшение на 31,6% (p1<0,001) относительно серии без лечения, но она на 86,8% (p<0,001) превышала аналогичный показатель здоровых особей, что свидетельствует о недостаточном терапевтическом эффекте и сохранении признаков хронического воспаления (таблица).
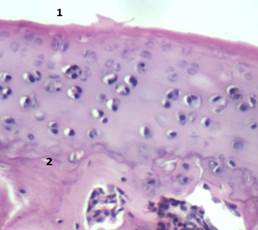
Рис. 3. Суставной хрящ коленного сустава крысы при применении мексидола. Окраска гематоксилином и эозином. Увеличение×100. 1 – нарушение целостности поверхностной бесклеточной пластинки; 2 – участки остеосклероза субхондральной кости
При применении НПГ микроскопически дефект в области наносимой травмы был выполнен регенератом, ограниченным размерами поврежденного участка, составляющими которого были хондроциты и фиброзная ткань. Вне зоны повреждения суставной хрящ имел равномерную окраску с сохранением нормальной цитоархитектоники и отсутствием очагов деструкции. Поверхностная бесклеточная пластинка сохранила свою равномерность и структуру без признаков истончения и отслойки. Хондроциты составляли изогенные группы, лишь единичные из них имели дистрофические изменения. В промежуточной зоне хряща наблюдались репаративные процессы, характеризующиеся увеличением количества изогенных групп, представленных скоплением хондроцитов с нормальными ядрами (рис. 4).
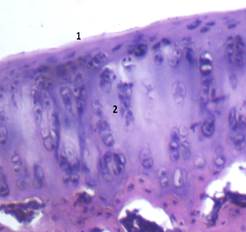
Рис. 4. Суставной хрящ коленного сустава крысы при применении НПГ. Окраска гематоксилином и эозином. Увеличение ×100. 1 – сохранная поверхностная бесклеточная пластинка; 2 – вертикальная столбчатость хондроцитов промежуточной зоны
При морфометрической оценке в серии применения НПГ определялось достоверное уменьшение общей толщины хряща на 23,9% (p1<0,001) относительно показателей серии без лечения, что на 13% (p2<0,001) ниже аналогичных значений групп применения ибупрофена. Кроме того, отмечалось уменьшение толщины синовиальной оболочки на 61,1% (p1<0,001) относительно контрольной серии с приближением изучаемого показателя к интактным значениям (таблица).
Заключение. Таким образом, применение нового производного 3-гидроксипиридина способствует развитию в области травматического дефекта суставного хряща фиброзно-хрящевой ткани с уменьшением выраженности воспалительных изменений в синовиальной оболочке.
Библиографическая ссылка
Захватов А.Н., Мосина Л.М., Тарасова Т.В., Саушев И.В., Хайдар Д.А., Паршина А.Ю., Коршунова А.А., Чигажов А.Н. ГИСТОМОРФОМЕТРИЧЕСКИЕ ИЗМЕНЕНИЯ СОЕДИНИТЕЛЬНОТКАННЫХ СТРУКТУР СУСТАВА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ПОСТТРАВМАТИЧЕСКОМ АРТРИТЕ НА ФОНЕ ПРИМЕНЕНИЯ НОВОГО ПРОИЗВОДНОГО 3-ГИДРОКСИПИРИДИНА // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33537 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33537



